МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ДЛЯ ПРАКТИЧЕСКИХ (СЕМИНАРСКИХ)
ЗАНЯТИЙ
Курс 4
Дисциплина: ПРОЕКТИРОВАНИЕ ХИМИКО-ФАРМАЦЕВТИЧЕСКОГО ПРОИЗВОДСТВА
Составитель:
Мурзагалиева Э.Т.
Алматы, 2017 г.
Практическое занятие № 8
План занятия.
- Разработка технологической линии производства стерильной фармацевтической продукции.
- Принципиальные технологические схемы производства стерильной продукции.
1. Задача создания технологической схемы нового производства состоит в разработке комплекса взаимосвязанных процессов, обеспечивающих получение требуемых продуктов нужного качества при минимальной себестоимости. Взаимосвязь отдельных процессов, возможность решения проблемы различными путями, необходимость экономического решения обусловливают участие в разработке технологической схемы специалистов разного профиля (химиков-технологов, механиков, специалистов по монтажу оборудования и автоматизации).
Исходными данными для разработки технологической схемы являются:
- задание на проектирование;
- материал предпроектной проработки (предполагаемый район строительства, мощность производства, сведения по технологии действующих производств или их аналогов и т. д.);
- общие данные по заводу (температура воздуха, воды, условия выброса сточных вод в общезаводскую канализацию, сброса отходящих газов в атмосферу, вывозка шлаков и отходов, особые условия и т. д.);
- рецептурные материалы к проектированию (регламент и все изменения и дополнения к нему, отчеты о научно-исследовательских разработках, материалы из учебников, монографий, справочников, периодических изданий, авторских свидетельств и патентов, материалы по обследованию родственных производств; систематизируется литература по методам расчета основных технологических процессов и аппаратов, которые будут использоваться при проектировании);
- уточненные ограничивающие параметры (запрещение использовать в виде промежуточных продуктов в технологической схеме канцерогенных или мутагенных веществ), выбор мероприятий, позволяющих исключить использование сильнодействующих ядовитых веществ, технико-экономические ограничения и т. д.
После сбора и обработки данных на разработку технологической схемы приступают к составлению операционной технологической схемы. Результаты изображают графически: отдельные процессы обозначают прямоугольником или кружками, пути перемещения материалов – сплошными линиями различной толщины. Каждому процессу и технологической линии присваивается номер; весь чертеж называется схемой материальных и технологических потоков производства.
Такая схема дает только общее представление о характере проектируемого производства, поэтому следующим этапом является составление операционных блок-схем отдельных стадий производства. Блок-схема обычно включает следующие стадии:
- подготовка сырья;
- проведение химического превращения;
- выделение и очистка целевого продукта;
- создание товарной формы целевого продукта.

Примерная схема стадий технологического процесса: 1- подготовка сырья; 2 – химическое превращение; 3 – выделение не превращенного сырья; 4 – выделение и очистка целевого продукта; 5 – придание товарной формы целевому продукту; 6 – регенерация и очистка непревращенного сырья; 7 – регенерация и очистка вспомогательных веществ; 8 – обезвреживание отходов
Следующим этапом детализации блок-схемы является разбивка каждой стадии процесса на отдельные физико-химические и химические операции.
Это один из важнейших моментов проектирования, определяющий технический уровень и качество всего проекта. Анализ большого числа технологических схем показал, что чаще всего встречается ограниченное число операций.
К ним можно отнести:
- подачу и выдачу газообразных, жидких и твердых веществ с их дозировкой, разбавлением или концентрированием;
- массообменные процессы – растворение, кристаллизация, простая перегонка и ректификация, экстракция, абсорбция, адсорбция, десорбция;
- гидромеханические процессы – осаждение, фильтрование, центрифугирование;
- теплообменные процессы – нагревание, охлаждение, испарение, конденсация, выпаривание, сушка;
- механические процессы – дробление, измельчение, классификация и дозирование твердых веществ;
- транспортирование и перемешивание жидкостей;
- химические процессы – хлорирование, нитрование, окисление, восстановление, гидрирование, пиролиз и т. д.
На этом этапе решаются вопросы о непрерывном, периодическом или полупериодическом режиме проведения отдельных операций с учетом экономической эффективности их работы. Прежде чем приступить к определению состава операций стадии подготовки сырья необходимо уточнить, какие формы состояния сырья наиболее рациональны для проведения в дальнейшем химических превращений в оптимальных условиях. Следует стремиться к созданию однофазной системы в аппаратах, где происходит химическое превращение, так как однофазные системы позволяют упростить технологическое и конструктивное оформление химического процесса и легче поддаются комплексной автоматизации.
Наиболее предпочтительна работа с жидкостями, так как в этом случае можно обрабатывать в единице объема реактора большую массу реагентов в единицу времени по сравнению с газовыми системами. Но газовые (паровые) системы имеют ряд достоинств, например возможность смешивать любые вещества в любом соотношении. Наименее предпочтительно использование трех и более фаз в одном аппарате.
При приеме газообразных продуктов уделяется внимание удалению конденсированных фаз, например фильтрованием, осушкой, сорбцией и т. д.
Иногда приходится прибегать к увлажнению газов, например для безопасной работы с ацетиленом в него добавляется ≪транспортный≫ водяной пар.
При приеме и удалении из цеха твердых продуктов уделяется внимание механизации следующих основных операций:
- доставка материалов в цех, разгрузка и размещение их в цехе;
- вскрытие тары и ее обработка;
- подготовка материалов к использованию;
- доставка материалов к технологическим аппаратам и их дозировка;
- обработка и удаление твердых и сыпучих отходов производства;
- переработка твердых целевых продуктов.
В некоторых случаях на стадии подготовки сырья приходится осуществлять процессы и операции по повышению качества сырья в связи с тем, что требования технологического процесса превышают показатели стандартов или ТУ. Обычно применяются процессы перегонки, сорбции, сушки, фильтрования и т. п. Иногда приходится использовать и химические процессы, например гидрирование для удаления следов ацетилена, разложение перекисей, которые могут образоваться во время хранения ряда продуктов, и т. д.
Особого внимания требует составление схемы стадий химического превращения, так как проведение технологического процесса при этом предопределяет во многом экономическую эффективность всего производства в целом.
Исходными данными для составления операционной схемы в этом случае являются данные по термодинамике, кинетике, механизму химической реакции, данные о фазовом состоянии реагентов. На основании этих данных необходимо задаться определенным типом аппарата. При проведении стадии химического превращения приходится иметь дело с явлениями различной физико-химической природы: химическими, тепловыми, диффузионными и гидромеханическими.
Выбирая определенную операцию или их набор, надо точно уяснить достигаемую цель. Необходимо иметь представление, как осуществляется та или иная операция. Например, целью перемешивания может являться:
- ускорение течения химической реакции;
- равномерное распределение твердых частиц в объеме жидкости;
- интенсификация теплообмена.
Перемешивание может происходить как в реакционных аппаратах, так и в специальных аппаратах-смесителях или в трубопроводах. Перемешивание может осуществляться механическими мешалками, газом или паром, циркуляцией с помощью насосов, вибраторами или пульсаторами.
При составлении операционной схемы стадии выделения целевого продукта решаются задачи:
- выпуск готовой продукции в соответствие с требованием стандартов и технических условий;
- максимально возможная утилизация побочных продуктов;
- выделение и регенерация не прореагировавшего сырья и вспомогательных продуктов.
Операционная схема должна решать и вопросы удаления отходов производства. Под отходами производства понимают удаляющиеся в технологическом процессе продукты, которые не могут быть использованы ни на данном, ни на другом предприятии, и поэтому подлежат уничтожению или обезвреживанию.
Отходами могут быть отработанная охлаждающая вода, отходящие газы, жидкие органические соединения, химически загрязненные водные стоки, кислотно-щелочные стоки, твердые отходы и т. д. Газовые отходы перед выбросом в атмосферу могут очищаться в скрубберах, циклонах, электрофильтрах или подаваться на факел к печам сжигания.
В зависимости от конкретных условий предусматриваются как общезаводские установки по переработке и обезвреживанию отходов, так и прицеховые.
2. После разработки операционной схемы приступают к составлению принципиальной технологической схемы, которая, по сути, является аппаратурным оформлением операционной.
Для составления принципиальной технологической схемы на листе сначала проводят линии коллекторов подачи и вывода материальных потоков, теплоносителей и хладоагентов. Рекомендуется линии газовых коллекторов проводить в верхней части листа, а жидкостных – в нижней его части. После этого на плоскости листа между коллекторами располагают условные изображения аппаратов и машин, необходимых для выполнения операций, в соответствии с разработанной операционной схемой. Условные изображения машин и аппаратов не имеют масштаба. Расстояние между ними по горизонтали не регламентируется, оно должно быть достаточным для размещения линий материальных потоков и средств контроля и автоматизации. Расположение условных изображений по вертикали должно отражать реальное превышение аппарата над другим без соблюдения масштаба. Размещенные на плоскости листа условные изображения машин и аппаратов соединяют линиями материальных потоков, подводят линии хладоагентов и теплоносителей. Производится нумерация позиций аппаратов и машин слева направо.
В процессе проектирования в технологическую схему могут вноситься изменения и добавления. Окончательное оформление технологической схемы производится после принятия основных проектных решений по расчету и подбору реакторов и аппаратов, по выяснении всех вопросов, связанных с размещением и расположением аппаратов проектируемого производства.
Технологическая схема не может являться окончательной, пока не проведена компоновка оборудования. Например, по первоначальному варианту предполагалась передача жидкости из аппарата в аппарат самотеком, который не удалось осуществить при разработке проекта размещения оборудования. В этом случае необходимо предусмотреть установку дополнительной передаточной емкости и насоса наносимых на технологическую схему.
Составляется описание технологической схемы, которая снабжается спецификацией. В спецификации указывается количество всех аппаратов и машин.
Устройство помещений для стерильного производства должно обеспечивать минимум возможности загрязнения готового продукта производства, т.е. минимум мест скопления пыли, подачу воздуха контролируемой чистоты, поддержание повышенного давления. При необходимости в помещении поддерживают определенную температуру и влажность. Такие помещения называют «чистыми».
«Чистым» помещением или «чистой» комнатой называется помещение, в котором счетная концентрация аэрозольных частиц и число микроорганизмов в воздухе поддерживается в строго определенных пределах.
Под частицей понимается твердый, жидкий или многофазный объект или микроорганизм с размерами от 0,005 до 100 мкм. При классификации «чистых» помещений рассматриваются частицы от 0,1 до 5 мкм.
«Чистое» помещение может содержать одну или несколько «чистых» зон. «Чистые» зоны могут быть и вне «чистого» помещения. «Чистые» зоны могут создаваться в локальных объемах: ламинарные шкафы, модули, изоляторы, блоки, укрытия и пр.
Производство стерильных лекарственных средств должно выполняться в чистых производственных зонах, в которые доступ персонала и/или оборудования и материалов должен происходить через воздушные шлюзы. В них должна поддерживаться надлежащая степень чистоты, регламентируемая правилами GMP, а поступающий вентиляционный воздух должен проходить очистку с использованием фильтров соответствующей эффективности.
Производство стерильных лекарственных средств должно осуществляться по методикам, четко изложенным в технологических регламентах и производственных инструкциях, с учетом принципов и правил надлежащей производственной практики, что необходимо для получения готовой продукции требуемого качества в соответствии с регистрационной и лицензионной документацией.
Не допускается производить различные лекарственные средства одновременно или последовательно в одном и том же помещении, за исключением тех случаев, когда не существует риска перекрестной контаминации, а также смешивания и перепутывания разных видов исходного сырья, полупродуктов, материалов, промежуточной и готовой продукции.
Контроль в процессе производства, осуществляемый в производственных помещениях, не должен оказывать отрицательного влияния на технологический процесс и качество продукции.
На всех стадиях технологического процесса, включая стадии, предшествующие стерилизации, необходимо осуществлять мероприятия, сводящие к минимуму микробную контаминацию.
Интервалы времени между началом приготовления растворов и их стерилизацией или стерилизующей фильтрацией должны быть минимальны и иметь ограничения (лимиты времени), установленные в процессе валидации.
Препараты, содержащие живые микроорганизмы, запрещается производить и фасовать в помещениях, предназначенных для производства других лекарственных средств.
Источники воды, оборудование для обработки воды и обработанную воду необходимо регулярно контролировать на химическую и микробиологическую контаминацию, а также, при необходимости, на контаминацию эндотоксинами, чтобы гарантировать соответствие качества воды требованиям нормативно-технической документации.
Любой газ, контактирующий в ходе технологического процесса с растворами или другой промежуточной продукцией, должен пройти стерилизующую фильтрацию.
Материалы, которым свойственно образование волокон с их возможным выделением в окружающую среду, как правило, не должны применяться в чистых помещениях, а при ведении технологического процесса в асептических условиях их использование полностью запрещается.
После стадий (операций) окончательной очистки первичной упаковки и оборудования при дальнейшем ведении технологического процесса они должны использоваться таким образом, чтобы не происходила их повторная контаминация.
Эффективность любых новых методик, замены оборудования и способов ведения технологического процесса должна быть подтверждена при валидации, которую необходимо регулярно повторять согласно разработанным графикам.
Существуют два принципиально разных вида производств стерильных препаратов:
1) производство продукции, допускающей стерилизацию в конечной форме (в окончательной упаковке, собранном виде), т. е. до пускающей финишную стерилизацию; 2) асептическое производство продукции, для которой такая стерилизация недопустима.
В первом случае стерилизация выполняется после завершения операций наполнения и герметизации (укупорки), т. е. стерилизуется готовый продукт. К этому виду относятся тепловая стерилизация (паром, водой, горячим воздухом) и радиационная стерилизация. Продукция стерилизуется в окончательной герметичной упаковке, и ее стерильность будет сохранена до тех пор, пока не будет нарушена целостность упаковки. Такой вид стерилизации для краткости называется финишной стерилизацией.
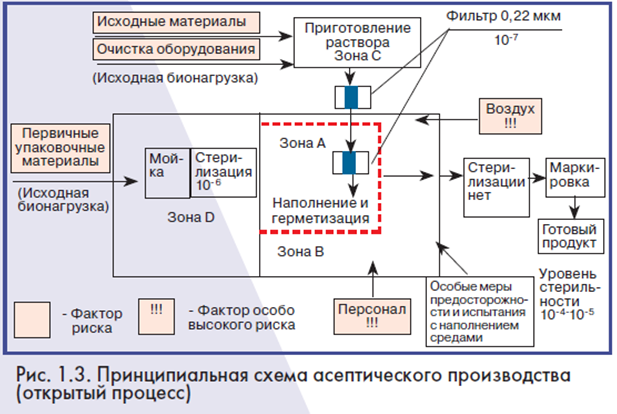
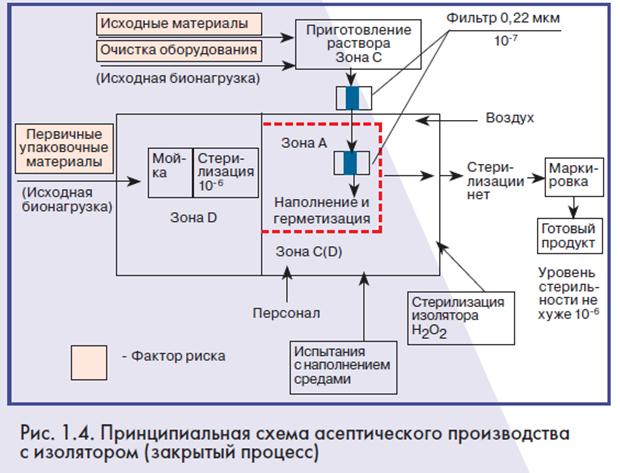
Во втором случае продукция не выдерживает режима стерилизации из-за своих свойств, например, разрушения при нагревании (препараты крови, вакцины и другие биологические препараты). Стерильность такой продукции или материалов обеспечивается иначе: нужно не уничтожать микроорганизмы в уже герметичной окончательной упаковке, а не допускать их в упаковку. Достигается это за счет стерилизующей фильтрации до наполнения. Такое производство называется асептическим. Производство может быть реализовано за счет открытых процессов и закрытых процессов (изолирующие технологии). Общим во всех процессах является получение стерильной продукции, используя исходные и упаковочные материалы. Стадии мойки и стерилизации первичной упаковки, приготовления растворов, наполнения и герметизации имеют сходный характер для всех производств. На рис. 1.2-1.4 красным цветом выделены факторы риска для стерильности.
Основными источниками загрязнений продукции являются:
– исходные и упаковочные материалы (исходная микробная нагрузка или бионагрузка);
– поверхности реакторов, в которых готовится продукт;
– технологические материалы (сжатый воздух, вода очищенная и вода для инъекций);
– воздух помещений, особенно в зоне наполнения и герметизации;
– персонал (выделение им частиц и микроорганизмов, ошибки и нарушения правил работы).

Литература:
Основная:
1. Основы проектирования химических производств: Учебник для вузов / Под ред. А. И. Михайличенко. – М.: ИКЦ «Академкнига» 2010. – 371 с.
2. Технология чистых помещений. Основы проектирования, испытаний и эксплуатации / В. Уайт. - Изд-во «Клинрум», 2008.
3. Проектирование чистых помещений. Под ред. В. Уайта. Пер. с англ. - М.: изд. "Клинрум", 2004. - 360 стр.
4. Основы проектирования химических производств: Учеб. пособие / Дворецкий С.И., Кормильцин Г.С., Калинин В.Ф. - М.: Издательство "Машиностроение-1". 2005. 280 с.
5. Нормирование фармацевтического производства. Обеспечение качества продукции / В. В. Береговых, А.П.Мешковский. – М.: Издательство ЗАО «Информационно-издательское агентство «Ремедиум», 2001. – 527 с.
Дополнительная:
1. Архитектурное проектирование: учебник для студ. сред. проф. образования / М. И. Тосунова, М. М. Гаврилова. – 4-е изд., перераб. и доп. – М.: Издательский центр «Академия», 2009. – 336 с.
2. Большой справочник по конструкциям и материалам современных зданий, 2006. — 620 с.
3. СТРК 1617. Надлежащая производственная практика (GMP).
4. Спицкий О.Р., Александров О.В. GEP — Надлежащая инженерная практика. Рецепт. — № 2 (88). — 2013. — С. 7—14.
5. Спицкий О.Р. Надлежащая инженерная практика (GEP) как система. инженерного менеджмента. Фармацевтическая отрасль. — № 6(29). — 2011. — С. 50—53.
6. Allen E., Iano J. Fundamentals of Building Construction: Materials and Methods, 6th Edition. — Hoboken, New Jersey: John Wiley & Sons, Inc., 2014. — XVI, 1007 p.
7. Hicks Tyler G. Handbook of Civil Engineering Calculations, Publisher: McGraw-Hill Publication: 2007, English Isbn: 9780071472937 Pages: 840
8. ICH Q10 Фармацевтическая система качества