Механизм сокращения мышечных волокон. Сокращением мышечного волокна управляют двигательные нейроны, выделяющие нейромедиатор ацетилхолин в нервно-мышечные синапсы. Цикл сокращения мышечного волокна реализуется в течение нескольких миллисекунд. Ацетилхолин диффундирует через синаптическую щель и взаимодействуют с холинэргическими рецепторами плазматической мембраны мышечных клеток. Открываются трансмембранные ионные каналы, происходит деполяризация клеточной мембраны вследствие поступления ионов натрия в саркоплазму (внутрь мышечных клеток). Потенциал действия быстро распространяется по всем направлениям, возбуждая все мышечные клетки. В цитозоле покоящихся клеткок концентрация Са2+ очень низка (менее 10-6 моль). В саркоплазматическом ретикулуме – существенно выше (около 10-3 моль). Высокая концентрация Са2+ в саркоплазматическом ретикулуме поддерживается Са2+-АТФ-азами и особым белком кальсеквестрином, содержащим много кислых аминокислот способных прочно связывать ионы Са2+. Переносу потенциала действия на саркоплазматический ретикулум индивидуальной миофибриллы способствуют поперечные трубочки Т -системы (трубчатые впячивания клеточной мембраны), находящиеся в тесном контакте с индивидуальными миофибриллами. Деполяризация плазматической мембраны передается через Т -трубочки на потенциал-управляемый мембранный белок «SR-foot» прилегающей мембраны саркоплазматического ретикулума. SR-foot открывает Са2+-каналы саркоплазматического ретикулума. Ионы Са2+ диффундируют из саркоплазматического ретикулума в саркоплазму, то есть в пространство между филаментами – актином и миозином. Концентрация ионов Са2+ в саркоплазме резко возрастает вплоть до величин 10-3 моль. Выброс Са2+ запускает механизм процесса сокращения миофибрилл. Данные ионы выполняют как определенную регуляторную пусковую функцию, так и способствуют энергообеспечению мышечного сокращения.
В расслабленной скелетной мышце комплекс белков тропонина с тропомиозином препятствует взаимодействию миозиновых головок с актином, закрыты сайты связывания Са2+ (рис. 1). Быстро поступивший в цитоплазму Са2+ связывается с тропонином С, что приводит к конформационной перестройке в тропонинного комплекса и вызывает диссоциацию тропонин-тропомиозинового коплекса. На молекуле актина освобождается участок связывания с миозином, что делает возможным взаимодействие активных центров актина с головками миозина, то есть запускает цикл мышечного сокращения. Ионы Са2+ присоединяются к кальцийсвязывающей субъединице тропонина тонких филаментов, изменяется конформация белка, молекула тропомиозина перемещается по желобку тонкого филамента, на молекулах глобулярного актина открываются центры связывания с головками миозина (рис. 1).
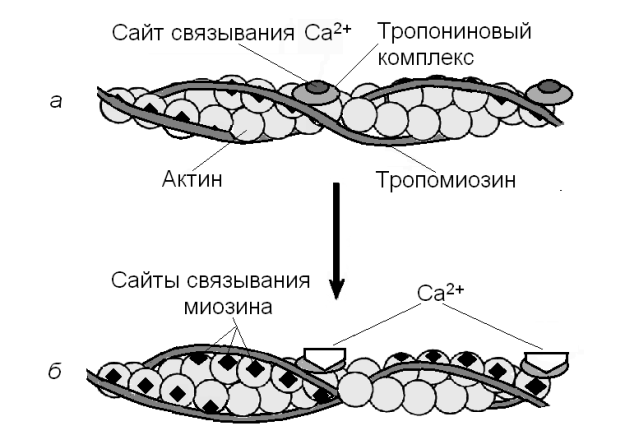
Рис. 1. Са2+-зависимые конформационные перестройки в актине: а – сайты связывания миозина с актином заблокированы; б – присоединение Са2+ к тропонину С тропонинового комплекса открывает сайты связывания с головками миозина
Сокращение мышечных волокон обусловлено продольным скольжением толстых миозиновых и тонких актиновых филаментов относительно друг друга (модель весельной лодки) рис. 2. На определённое небольшое расстояние. Осуществляется один цикл (рис 3). Головка молекулы миозина прочно связывается с открытым сайтом актиновой нити. Затем Са2+ инициирует взаимодействие головки с АТФ, это приводит к отделению головки миозина от актиновой нити, так как комплекс актин-АТФ обладает низким сродством к актину. Са2+-зависимая АТФ-аза головки миозина гидролизует АТФ, но удерживает близко друг от друга оба продукта реакции (АДФ и Фн). Считается, что процесс носит скорее стехиометрический, а не каталитический характер. Гидролиз АТФ вызывает аллостерические изменения в миозиновой головке и головка образует новый мостик с соседней молекулой актина. Актин ускоряет выброс продуктов АТФ-азной реакции из активного центра миозина. Происходит преобразование аллостерического напряжения и изменение конформации головки миозина. Движение изменения конформации подобно «гребку весла». Во время «гребка» миозиновые головки отклоняются на определенный угол от оси и перемещают миозиновый филамент вдоль актинового по направлению к Z-диску. Затем АДФ и Фн отсоединяются от миозина. Цикл повторяется до тех пор, пока имеется АТФ.
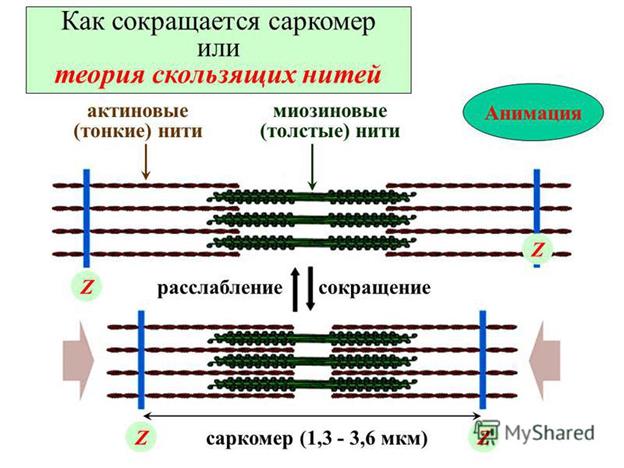
Рис. 2 Схематическое изображение укорачивания саркомера за счет скольжения миозиновых филаментов вдоль актиновых.
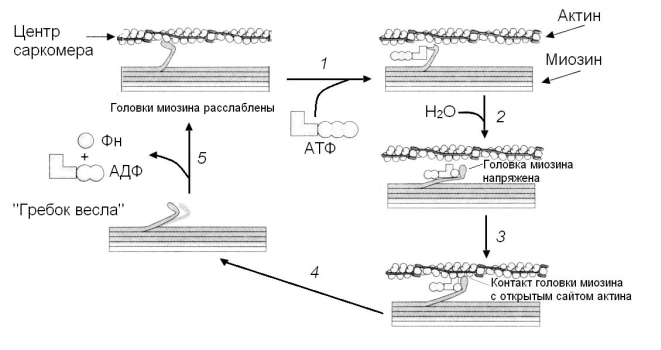
Рис. 3. Описание механизма сокращения мышечных волокон:
1. головки миозина в отсутствии АТФ прочно связаны с актиновыми нитями;
2. при связывании АТФ головки отделяются от актиновых нитей;
3. АТФ-аза головок миозина гидролизует АТФ, вызывая аллостерические изменения в головке;
4. образовавшиеся АДФ и Фн удерживаются вблизи друг от друга;
5. головка миозина образует новый мостик с соседней молекулой актина;
6. актин ускоряет выброс АДФ и Фн из активного центра миозина, конформация головки миозина изменяется, ее движение подобно «гребку весла» – миозиновые головки отклоняются на определенный угол от оси и перемещают миозиновый филамент вдоль актинового по направлению к Z-диску;
7. миозиновые головки готовятся к следующему движению.
Данное описание также изображено схематично на рис. 4.
При каждом цикле гидролиза АТФ головки миозина взаимодействуют со следующими молекулами актина. Это вызывает взаимное скольжение миозиновых и актиновых филаментов, т. е. сокращение мышечного волокна. 500 миозиновых головок толстого филамента в результате каждого «гребка» вызывают смещение на 10 нм. Во время сильных сокращений частота «гребков» приблизительно равна 5 раз в секунду. В отсутствие нервной инервации мышечных волокон АТФ-зависимые кальциевые насосы мембраны саркоплазматического ретикулума быстро снижают концентрацию ионов Са2+ до исходного уровня. Комплекс Са2+ с тропонином С диссоциирует, тропонин восстанавливает исходную конформацию, сайт связывания миозина на актине блокируется тромиозином, мышца расслабляется. КПД сокращения составляет примерно 50 %.
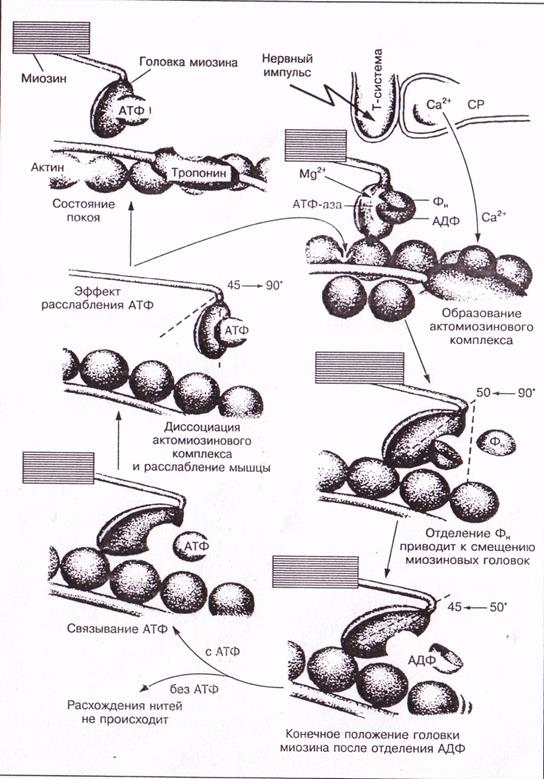
Рис. 4 Схематичное изображение механизма мышечного сокращения.