ВВЕДЕНИЕ
Для контроля примесей в объектах пищевой, микробиологической и фармацевтической промышленности, в мониторинге окружающей среды, для решения некоторых медицинских и биохимических задач в последние годы все шире применяют ферментативные методы анализа, основанные на использовании зависимости скорости катализируемой ферментом химической реакции от концентрации реагирующих веществ и фермента. Использование биологических катализаторов, отличающихся высокой активностью и избирательностью действия, позволяет значительно повысить чувствительность и селективность методов анализа. Эти качества в сочетании с простотой аппаратурного оформления и методики эксперимента, экспрессностью обосновывают широкое внедрение ферментативных методов в практику клинических, агрохимических, заводских лабораторий, научно-исследовательских институтов, природоохранных служб.
Ферментативными методами можно определять сами ферменты, их субстраты (то есть соединения, превращение которых катализируют ферменты), а также соединения, воздействующие на каталитическую активность ферментов, - их эффекторы, активаторы или ингибиторы (то есть вещества, которые либо повышают, либо понижают активность фермента).
ГЛАВА 1. СУЩНОСТЬ КИНЕТИЧЕСКИХ (ФЕРМЕНТАТИВНЫХ) МЕТОДОВ АНАЛИЗА
Кинетические методы основаны на использовании зависимости скорости химической реакции от концентрации реагирующих веществ, а в случае каталитических реакций и от концентрации катализатора:
 , (1)
, (1)
где v — скорость; K — константа скорости каталитической реакции; сА, сВ и скат — концентрации реагирующих веществ и катализатора; m, n и р — показатели степени при концентрациях реагентов и катализатора (обычно р = 1).
Аналитическим сигналом в кинетических методах является скорость процесса или пропорциональная ей величина.
Реакцию, скорость которой измеряется, называют индикаторной, а вещество, по изменению концентрации которого судят о скорости процесса — индикаторным веществом.
Индикаторные реакции могут быть основаны на катализе окислительно-восстановительных реакций, реакций замещения в координационной сфере ионов металлов, реакций гидролиза и декарбоксилирования органических соединений. Наиболее чувствительны и сравнительно просто выполнимы окислительно-восстановительные каталитические реакции. Они чаще всего используются в анализе неорганических веществ.
Кроме каталитических реакций в кинетических методах используют и некаталитические реакции окисления-восстановления, разложения, осаждения.
К индикаторной реакции предъявляют ряд требований:
· концентрация определяемого компонента за время наблюдения практически не должна меняться. Катализатор в ходе реакции не расходуется. Если же определяемым является одно из реагирующих веществ (некаталитический вариант метода), то с достаточной точностью его можно определять в тот начальный период, когда его концентрация изменяется не более чем на 5%;
· необходимо наличие быстрого, простого и доступного метода наблюдения за скоростью индикаторной реакции, т. е. за изменением концентрации индикаторного вещества во времени.
· скорость индикаторной реакции должна находиться в определенных пределах. Оптимальное время наблюдения за скоростью индикаторной реакции 5–15 мин. Однако с развитием методов изучения быстрых процессов все чаще используют реакции, протекающие с большой скоростью.
Существуют два варианта кинетических методов:
В каталитическом варианте кинетического метода (каталитическом методе, каталиметрии) определяемый компонент или связанные с ним соединения являются катализатором индикаторной реакции.
В некаталитическом варианте кинетического метода определяемым компонентом является одно из реагирующих веществ в некаталитической или каталитической индикаторной реакции.
Каталитические методы отличаются от других химических методов анализа высокой чувствительностью, а некаталитический вариант кинетических методов – высокой селективностью.
Возможны различные способы определения неизвестной концентрации вещества по данным кинетических измерений. Если индикаторным веществом является продукт реакции, и его текущую концентрацию обозначить через х, то скорость реакции можно выразить как
 (2)
(2)
На начальной стадии реакции концентрации определяемого вещества В и реагента А могут практически не изменяться за время наблюдения за скоростью процесса. Тогда, проинтегрировав уравнение (2), получим
 (3)
(3)
т. е. наблюдается линейная зависимость между концентрацией индикаторного вещества и временем. Кинетический метод, основанный на использовании этого уравнения, называют дифференциальным.
Если концентрация хотя бы одного из реагирующих веществ за время наблюдения за скоростью реакции заметно меняется (более чем на 10%), то между концентрацией индикаторного вещества и временем существует более сложная (например, логарифмическая, обратная и т. д.) зависимость. Такой кинетический метод называют интегральным. В интегральном варианте часто применяют построение зависимостей концентрации индикаторного вещества от времени в полулогарифмических, обратных или других координатах, т. к. для расчета неизвестной концентрации определяемого компонента удобнее использовать прямоугольные участки кинетических кривых. Характер кинетических кривых, а следовательно, и использование дифференциального или интегрального вариантов кинетических методов анализа определяется типом индикаторной реакции, ее механизмом.
В настоящее время наиболее распространенными являются три основных способа определения неизвестной концентрации по данным кинетических измерений. Это способы тангенсов, фиксированного времени, фиксированной концентрации. Рассмотрим их применительно к дифференциальному варианту кинетического метода анализа.
Способ тангенсов основан на определении тангенса угла наклона кинетических кривых tg при известных концентрациях определяемого вещества. При этом tg характеризует скорость индикаторной реакции и зависит от концентрации определяемого вещества. Градуировочный график строят в координатах: концентрация определяемого соединения — tg (рис. 1, а).
Способ фиксированного времени. При определенном, строго фиксированном интервале времени протекания реакции, измеряют концентрацию индикаторного вещества в пробах с известными концентрациями определяемого компонента. Градуировочный график строят в координатах концентрация определяемого вещества — концентрация индикаторного вещества при фиксированном времени протекания реакции tфикс. (рис. 1, б). Часто при работе этим методом индикаторную реакцию останавливают при tфикс.. Путем резкого охлаждения, изменения кислотности раствора, добавления ингибиторов.
Способ фиксированной концентрации. В отдельных пробах с известными концентрациями определяемого вещества проводят индикаторную реакцию до строго определенной (фиксированной) концентрации индикаторного вещества хфикс. и измеряют время достижения этой концентрации. Градуировочный график строят в координатах: концентрация определяемого компонента — величина, обратная времени достижения хфикс. (рис.1, в).
В интегральном варианте все способы определения неизвестной концентрации аналогичны, лишь между временем реакции и концентрацией индикаторного вещества существует более сложная функциональная зависимость. В этом случае находят функции концентрации индикаторного вещества, линейно изменяющиеся во времени (логарифмическая, обратная и т. д.).

Рис. 1. Способы определения неизвестной концентрации по данным кинетических измерений:
а — тангенсов; б — фиксированного времени;
в — фиксированной концентрации (х — концентрации индикаторного вещества, t — время, с3 > c2 > c1 — концентрации определяемого соединения
В)
Каталиметрическое титрование — процесс титрования в присутствии катализатора, в котором точку конца титрования определяют по резкому увеличению или уменьшению скорости реакции.
С целью автоматизации каталиметрического метода анализа скорость реакции часто измеряют в открытых системах. Открытой называют систему, в которую по мере протекания реакции вводят реагенты и/или из которой отводят продукты реакции. В ходе реакции растворы подаются в реакционную камеру с постоянной или регулируемой скоростью. Разработаны разные варианты открытых систем: на основе проточных методов и «стат»-методов.
Проточные методы. К ним относится метод непрерывной струи, основанный на смешении реагентов в струе и предложенный для быстро протекающих реакций с периодом полупревращения t1/2 = 0,01–10 с. Другой вариант проточного метода применяют для измерения скоростей сравнительно медленно протекающих реакций с t1/2 = 1–10 мин. В этом случае проточная ячейка одновременно является и смесительной камерой. Исходные реагенты индикаторной реакции и анализируемый раствор, содержащий катализатор с концентрацией скат, непрерывно подаются насосами в смесительную камеру вместимостью около 10 мл, продукты реакции и реагенты вытекают со скоростью 2–20 мл/мин. При каждом значении скат устанавливается постоянная концентрация индикаторного вещества и фиксируется постоянный сигнал, соответствующий скат. Смена раствора в кювете происходит за 1–2 мин, что определяет производительность анализатора 30 проб в час.
Стат-метод предполагает введение реагентов со скоростью, равной скорости их расходования в реакции, так что концентрация индикаторного вещества остается постоянной. Скорость введения реагента регулируется автоматически.
Воспроизводимость результатов кинетических измерений повышается при использовании метода одновременного компарирования. В анализируемый раствор и растворы шкалы стандартов одновременно с помощью стартовой пипетки вводят реагент, инициирующий протекание каталитической реакции. Через определенный промежуток времени сравнивают аналитические сигналы анализируемого раствора и шкалы стандартов и оценивают содержание определяемого вещества. Метод не требует термостатирования.
Для учета влияния примесей на скорость реакции применяют метод добавок. Скорость реакции измеряют в равных аликвотных частях анализируемого раствора без добавки и в присутствии определенных добавок катализатора. Метод добавок дает правильные результаты, если в растворе отсутствуют посторонние примеси, обладающие каталитическим действием на индикаторную реакцию.
Скорость реакции можно определять по времени внезапного появления окраски раствора в реакциях Ландольта. Реакции Ландольта — это медленные химические реакции, в которых образование окрашенного продукта реакции задерживается подходящим реагентом, специально добавленным для этой цели. Например, при окислении бромида персульфатом, катализируемом ионами меди(II), образующийся бром окисляет аскорбиновую кислоту и не взаимодействует с индикатором N,N-диметил-п-фенилендиамином. Когда практически вся аскорбиновая кислота окислится, появляется окраска индикатора. Метод, основанный на эффекте Ландольта, в ряде случаев обеспечивает более высокую воспроизводимость результатов анализа, чем обычный метод фиксированной концентрации, разновидностью которого он является.
Концентрацию катализатора можно определять по длительности индукционного периода tинд., по истечении которого скорость реакции становится заметной (рис. 2). Этот способ является разновидностью метода фиксированной концентрации. Индукционный период наблюдается не только в реакциях Ландольта, но и в автокаталитических реакциях, а также в реакциях, когда в начальный период изменяется соотношение форм катализатора. Длительность индукционного периода связана с концентрацией катализатора зависимостью
 или
или  .
.

Рис. 2. Кинетические кривые окисления KI (2 1–4 М) пероксидом водорода (2,4 * 10–3 М), катализируемого Ti(IV), в присутствии крахмала
За изменением концентрации индикаторного вещества во времени можно наблюдать любым методом, и при построении кинетических кривых вместо концентрации образующегося продукта использовать любую, пропорциональную ей величину — оптическую плотность, силу тока, потенциал системы и т. д. Чаще всего для наблюдения за скоростью индикаторной реакции используют спектрофотометрические и люминесцентные, реже — электрохимические, термометрические и титриметрические методы.
Некаталитические методы не отличаются высокой чувствительностью (она определяется, как правило, методом наблюдения за скоростью индикаторного процесса), но они селективны, часто позволяют определять в смеси близкие по свойствам вещества без их предварительного разделения. Эти методы применяют при анализе смесей органических соединений (спиртов, сахаров, аминов) и смесей таких близких по свойствам ионов металлов, как щелочно-земельные и редкоземельные элементы.
Каталитические методы анализа отличаются высокой чувствительностью, которая для многих неорганических веществ сравнима с чувствительностью масс-спектральных и активационных методов анализа, а для органических — с наиболее чувствительными вариантами хроматографии. В отдельных случаях, например, для серебра, хрома, кобальта, каталитические методы — наиболее чувствительные из всех известных методов анализа. При этом преимуществом каталитических методов является сочетание высокой чувствительности с простотой аппаратурного оформления и методики проведения анализа.
Среди каталитических методов высокую чувствительность и селективность имеют ферментативные методы, основанные на использовании реакций, катализируемых ферментами. Ферментативными методами определяют субстраты, сами ферменты и эффекторы ферментов (соединения, мешающие активности ферментов). Методы определения субстратов — веществ, на которые действуют ферменты — высокоселективны и даже специфичны, что позволяет определять субстраты непосредственно в матрице сложных объектов (кровь, биомассы и биожидкости, многокомпонентные технологические растворы). Чувствительность определения при этом обусловлена методом, выбранным для контроля за скоростью процессов. Часто в этих случаях используют ферментные электроды. Методы определения эффекторов ферментов высокочувствительны, но не всегда селективны.
В кинетических методах наиболее часто используют метод тангенсов как наиболее точный (использует большое число экспериментальных данных) и универсальный (применим для реакций с индукционным периодом). Реже применяют способ фиксированного времени и способ фиксированной концентрации, хотя эти способы более просты и менее трудоемки. Способ фиксированной концентрации используют обычно при автоматизации контроля, способ фиксированного времени — при проведении серийных анализов.
Метод каталиметрического титрования применяют для определения с повышенной точностью микросодержания ионов металлов или органических соединений, образующих с ионом металла устойчивые, каталитически неактивные комплексы, и следов органических веществ в неорганических солях особой чистоты. При титровании органического соединения избыток титранта (иона металла-катализатора) уже в концентрации 10–8–10–6 М вызовет протекание каталитической реакции и тем самым определит конечную точку титрования.
Основное применение каталитических методов в анализе реактивов и веществ особой чистоты — определение микроконцентраций переходных металлов. Именно каталитические методы позволяют определить ионы элементов, содержание которых часто лимитируется в технических условиях на вещества особой чистоты табл. 1.
Чистота цитирования примесей* в веществах особой чистоты [16] и пределы обнаружения их каталиметрическими методами
| Примесь | Чистота цитирования, % | Предел обнаружения, нг/мл | Примесь | Чистота цитирования, % | Предел обнаружения**, нг/мл |
| Fe | Ag | ||||
| Cu | Pb | ||||
| Ni | Ti | ||||
| Mn | 0,1 | V | 0,1 | ||
| Co | 0,1 | Mo | |||
| Cr | W |
Чаще всего лимитируется содержание железа и меди (допустимый уровень — 10–4–10–6%). Другие примеси определяют реже, но для некоторых веществ необходим контроль их содержания на уровне 10–7%, который не обеспечивается традиционными методами эмиссионной спектроскопии и спектрофотометрии. Особенно успешно каталитические методы применяются для определения Co, Mn, V, Mo, W, Nb, Ta. Кроме того, при анализе веществ особой чистоты каталитические методы позволяют определять отдельные анионы, органические соединения в неорганических солях, отклонения от стехиометрии в составе соединений.
Нижняя граница концентраций, определяемых с применением каталитических методов, для большинства элементов составляет 10–8–10–9 М (10–3–10–4 мкг/мл), т. е. на 1–2 порядка ниже, чем в методах спектрофотометрии, полярографии и пламенного варианта атомной абсорбции.
Скорость конкретной индикаторной реакции зависит от многих параметров: температуры, ионной силы раствора, концентрации мешающих компонентов, наличия ингибиторов и активаторов. Все эти параметры в кинетических методах анализа необходимо строго контрфолировать и поддерживать постоянными для получения надежной аналитической информации.
Каталитическая реакция является результатом протекания ряда элементарных процессов, поэтому влияние температуры на скорость процесса не всегда легко интерпретировать. Для практической оценки влияния температуры на скорость реакции используют температурный коэффициент  , который показывает, во сколько раз увеличивается скорость реакции при возрастании температуры на 10 К:
, который показывает, во сколько раз увеличивается скорость реакции при возрастании температуры на 10 К:
 ,
,
Кинетическим определениям могут мешать посторонние ионы и соединения:
· обладающие каталитической активностью;
· снижающие скорость каталитической реакции или изменяющие направление ее отдельных стадий. Мешающее влияние оказывают окислители и восстановители, взаимодействующие с реагентами индикаторной реакции и катализатором: Mn(VII), Cr(VI), I2,  ,
, 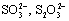 , HS; анионы и соединения, образующие с катализатором каталитически неактивные комплексы — F,
, HS; анионы и соединения, образующие с катализатором каталитически неактивные комплексы — F,  , NH3,
, NH3,  , ЭДТА; ионы переходных металлов, проявляющие каталитическую активность — Fe, Cu, Mn, Ti, Co; ионы металлов, образующие комплексы с реагентами и продуктами реакции — Al, Bi, Zr, Ti, TR и др.; ингибиторы и активаторы — в основном органические вещества, взаимодействующие с промежуточными продуктами реакции или с катализатором — оксалаты, фенолы, нафтолы, амины, а также инертные электролиты (например, нитраты и перхлораты щелочных металлов) и вещества, обладающие буферным действием.
, ЭДТА; ионы переходных металлов, проявляющие каталитическую активность — Fe, Cu, Mn, Ti, Co; ионы металлов, образующие комплексы с реагентами и продуктами реакции — Al, Bi, Zr, Ti, TR и др.; ингибиторы и активаторы — в основном органические вещества, взаимодействующие с промежуточными продуктами реакции или с катализатором — оксалаты, фенолы, нафтолы, амины, а также инертные электролиты (например, нитраты и перхлораты щелочных металлов) и вещества, обладающие буферным действием.
Избирательность индикаторных реакций характеризуется максимально допустимым содержанием посторонних ионов, при которых относительная погрешность определения анализируемого вещества не превышает заданного значения, например, 0,1.
Кислотность раствора влияет на избирательность определения, если в лимитирующей стадии индикаторной реакции участвует ион водорода, а также в случае образования в результате гидролиза при разных значениях рН гидроксокомплексов, обладающих различной каталитической активностью. Так, каталитически активные комплексы Ti образуются при рН = 3,8, а максимальное содержание каталитически активных  и
и  наблюдается при рН = 1,1 и pH = 2,2, соответственно.
наблюдается при рН = 1,1 и pH = 2,2, соответственно.
Для устранения мешающего влияния посторонних компонентов применяют традиционные для аналитической химии приемы отделения или маскирования мешающих примесей.
Кинетические методы (в том числе и ферментативные) при условии строгого соблюдения условий проведения анализа не уступают другим методам по точности, достаточно экспрессны, легко поддаются автоматизации. В практике аналитической химии эти методы применяют:
· при анализе смесей близких по свойствам органических соединений (некаталитический вариант);
· при определении микроколичеств ионов 3d-элементов, группы платиновых металлов, ряда анионов (I, Cl, Br) и органических веществ в природных и промышленных объектах;
· при определении присутствия токсичных и лекарственных препаратов, физиологически активных соединений в биологических объектах и объектах окружающей среды (ферментативные методы).