Фториды РЗЭ относятся к наименее растворимым соединениям этой группы элементов. В расплавах фторидов редкоземельных и щелочных металлов образуются соли NaLaF4, KСeF4, NaYF4, а также соединения состава M3LnF6 (Ln – Ce(III), Y, Sm, Gd, Er; M – Na, K, Rb, Cs).
Безводные фторидные комплексы РЗМ с щелочами и щелочноземельными металлами во внешней сфере изучали в основном при исследованиях систем MF – LnF3 или MF2 – LnF3. На основании большого экспериментального материала [12] был предложен эмпирический критерий возможности образования соединений в системах MF – LnF3 (Тома). Предлагается рассматривать значение отношений ионных радиусов Ln3+ и М+ или отношение напряженностей полей катионов Ln3+ и М+. При отношении  постулируется невозможность существования соединений; при 0,7<n*<1.4 в системе MF3 – LnF3 существуют соединения MLnF4, а при n*>>1.40 трифториды образуют с MF соединения M3LnF6 [13 - 15].
постулируется невозможность существования соединений; при 0,7<n*<1.4 в системе MF3 – LnF3 существуют соединения MLnF4, а при n*>>1.40 трифториды образуют с MF соединения M3LnF6 [13 - 15].
Соединения состава M3LnF6 плавятся конгруэнтно, тогда как соединения состава MLnF4 плавятся с разложением. Термическая устойчивость M3LnF6 увеличивается в ряду Na – Cs. В системах фторид цезия – фторид лантаноида реализуются соединения Cs3LnF6 для всех РЗЭ от церия до лютеция. В системах RbF-LnF3 соединения состава 3:1 образуются начиная с празеодима, а в системах КF-LnF3 подобные соединения образуются лишь начиная с самария.
Фториды M3LnF6 можно синтезировать фторированием смеси хлоридов щелочного металла и РЗЭ1 (1-кроме церия, празеодима, неодима, тербия и диспрозия) в молярном соотношении 3:1 при температуре 300-400˚С при спекании смеси фторида щелочного металла и трифторида РЗЭ в атмосфере азота (аргона). Следует отметить, что спекание лучше проводить в течение двух часов при температуре на 50˚С ниже температуры плавления образующегося комплекса (особенно это относится к рубидий- и цезийсодержащим комплексам). Применение другого режима синтеза зачастую приводит к загрязнению продукта из – за взаимодействия с материалом реактора, либо к непомерному увеличению времени синтеза, что, впрочем, не исключает заметной коррозии реактора.
Структурные данные для фторокомплексов MnLnF3+n не полны. Двойные фториды MLnF4 гексагональны и изоструктурны по всему ряду РЗЭ, либо обладают сходной структурой. Некоторые отличия в симметрии решетки, наблюдающиеся при замещении ионов Nd3+ на ионы других РЗЭ, объясняются частым смещением катионов, находящихся в различных позициях большинство комплексов РЗЭ обладают полиморфизмом.
Кристаллографические характеристики фторокомплексов
гадолиния
Таблица 1.1.
| Параметры элементарных ячеек гексафторгадолинидов калия | ||||||
| α-K3GdF6 | β-K3GdF6 | γ-K3GdF6 | ||||
| Куб.простр.группа Fm3m (z=4) | Тетрагональная пространственная группа 14/mmm (z=2) | Моноклинная пространственная группа Р21/n (z=2) | ||||
| a0 | a0 | c0 | a0 | b0 | c0 | β0 |
| 9,305 | 6,580 | 9,305 | 6,368 | 6,520 | 9,069 | 90˚40΄ |
Лантаноиды во фторидных расплавах образуют устойчивые трехвалентные комплексы типа MeIMeIIIF4 (MeI - Li, Na, K) и MeI3MeIIIF6 (MeI – K, Rb, Cs, NH4). Несколько лет назад Тома предсказал, что если отношение радиусов катионов Ме+/ Ме3+ находятся в интервале 0,77 – 1,4, комплексы типа МеIGdF4 могут существовать, а если Ме+/ Ме3+>1,43, то будет образовываться конгруэнтно плавящиеся комплексы типа Ме3IGdF6.
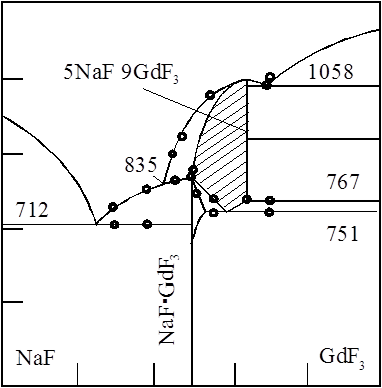 |
Большинство комплексов было идентифицировано в фазовых исследованиях [13-21] или при совместном сплавлении [22-25] стехиометрических количеств фторидов, входящих в состав соединений. Большое число равновесных фазовых диаграмм собрано в опубликованном обзоре Тома [26]. В отдельных случаях исследуемые фторидные системы были получены фторированием смесей 3:1 (хлорида щелочного металла и галогенида лантаноида) при 300 – 400˚С [27]; гидрофторированием смеси фтористого натрия и полуторной окиси лантоноидов [24] или нагреванием смесей фтористого натрия и двуокиси металла (металл – церий, празеодим, тербий) при 450 - 650˚С в смеси водорода и фтористого водорода.
Рис.1 Диаграмма состояния системы NaF-GdF3
Для получения полной картины строения фторидных расплавов, содержащих РЗЭ, в частности гадолиний, исследованы системы фторид натрия – фторид РЗМ и построены полные фазовые диаграммы в работе [14,15]. На рисунке 1 представлена диаграмма системы NaF – GdF3, где образуются равновесные комплексы NaGdF4 и Na5Gd9F32. Первый комплекс 1:1 NaGdF4 имеет гексагональную симметрию при низкой температуре, а при температуре выше 700˚С они превращаются в неупорядоченные кубические фазы переменного состава, подобные флюориту [14]. Верхний предел состава кубических фаз, установленный по показателю преломления, постоянной решетки и данными фазового перехода, соответствует составу Na5Gd9F32.
Твердые растворы кубической симметрии неустойчивы при температуре ниже 800 - 830˚С, и они при охлаждении переходят в различные продукты, состав которых зависит от состава разлагающихся фаз. Например, при эквимолярных составах фторидов наблюдается упорядочение и образуется фаза NaGdF4 с гексагональной симметрией. Из фазы Na5Gd9F32 в системе образуются гексагональные NaGdF4 и GdF3.
Комплексы систем: фторид калия, рубидия, цезия – трифторид РЗМ изучены менее подробно. Опубликовано относительно небольшое число сведений о комплексах, образуемых фторидом калия и трифторидом лантаноидов [22, 25, 28, 29].
Другими авторами были исследованы фторидные системы РЗ – К [30]. Фторид калия совместно с фторидами редкоземельных металлов образуют два типа комплексных соединений – КЭF4 и К3ЭF6, где Э – Y3+, La3+, Nd3+, Gd3+. Особенности образования соединений с различной координацией ионов фтора в расплавленном состоянии подтверждаются также результатами измерений плотности и электропроводности фторидных смесей. С уменьшением радиуса иона комплексообразователя – редкоземельного элемента – устойчивость фторидных комплексов возрастает. Минимум на изотерме мольного объема и молярной электропроводности для системы KF - GdF3 отвечает составу, содержащему 25 мол.% трихлорида гадолиния. Такой состав соответствует наиболее плотной упаковке ионов, которую можно объяснить высокой устойчивостью фторидных комплексов криолитового типа К3GdF6.
Для всех расплавленных смесей имеет место отклонение величин мольного объема от аддитивности. Величина молярной электропроводности в указанных выше системах понижается с повышением мольно-долевой концентрации фторида редкоземельного элемента. Это явление объясняется, по-видимому, присутствием в расплаве наряду с простыми ионами комплексных ионов типа: ЭF4- и ЭF63-.