В.М. Жихарев
Физико-химия металлургических процессов и систем: Упражнения, примеры, задачи
Учебное пособие
Часть I
Челябинск
Издательский центр ЮУрГУ
2013
Глава 3. Кинетические закономерности процессов диссоциации
Диссоциация химических соединений относится к топохимическим реакциям, протекающим на межфазной границе исходного соединения и его продукта разложения и скорость которых зависит от состояния и размера поверхности раздела фаз.
3.1. Механизм и кинетическая схема диссоциации
Основными кинетическими стадиями процесса являются следующие:
1. Распад частиц исходного соединения с образованием адсорбированных молекул газа и пересыщенного раствора продукта диссоциации в исходном соединении.
2. Кристаллохимические превращения, заключающиеся в образовании новой фазы.
3. Десорбция молекул газа и их диффузия из зоны реакции в газовый поток.
Первая стадия при диссоциации карбонатов может быть представлена схемой:
 .
.
При диссоциации оксидов идет переход образующихся по схеме

электронов к катионам металла, которые восстанавливаются при этом до ионов с более низким зарядом или до атомов металла. На этой стадии образуются пересыщенные растворы  в
в  или
или 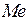 в
в  .
.
Вторая стадия – кристаллохимическая. Согласно теории зарождения и роста новых фаз из пересыщенных растворов она идет за счет гетерофазных флуктуаций, представляющих, по-существу, микроскопические зародыши нового вещества. При относительно невысокой величине поверхности исходного соединения эта стадия может быть заторможена в начальный период процесса. Определяющими кинетическими факторами для этой стадии являются реакционная активность исходного соединения, степень химического пересыщения и температура. Активность соединения характеризуется степенью дисперсности вещества и дефектностью его кристаллов. Мерой химического пересыщения может быть величина  , представляющая разность равновесного и фактического давления газа в реакторе:
, представляющая разность равновесного и фактического давления газа в реакторе:  или
или  .
.
На третьей стадии процесса адсорбционно-химическое звено сопрягается с диффузионными явлениями в слое твердого продукта диссоциации или в объеме газового потока. От величины диффузионных торможений зависит режим протекания процесса: кинетический, диффузионный или промежуточный (переходный).
Кинетика процесса обычно описывается при помощи двух характеристик:
– изменения скорости процесса  во времени;
во времени;
– изменения степени превращения  во времени t.
во времени t.
На рис. 3.1 в графическом изображении даны кинетические характеристики процесса. Как видно, можно выделить три характерных периода:

Рис. 3.1. Кинетика топохимических реакций
I – индукционный период, характеризующийся малыми скоростями процесса, связанными с трудностями зарождения новой фазы;
II – автокатализ, связанный с ускорением реакции из-за постоянно увеличивающейся поверхности раздела двух твердых фаз и деформацией сопрягающихся решеток фаз;
III – период замедления процесса; уменьшение скорости связано с уменьшением количества старой фазы и поверхности раздела.
Следует отметить, что при отсутствии торможений в зарождении новой фазы I и II периоды могут отсутствовать.