3.1. В таблице представлены экспериментальные данные по кинетике разложения карбоната кальция при 995 К ( – степень диссоциации карбоната, %).
– степень диссоциации карбоната, %).
| t, мин | ||||||||||
| α | 0,11 | 0,157 | 0,201 | 0,243 | 0,284 | 0,323 | 0,361 | 0,397 | 0,432 | 0,466 |
Представить данные графически. Проверить применимость известных кинетических выражений для описания кинетики топохимических реакций. Вычислить константу скорости процесса при температуре опыта.
3.2. В таблице представлены экспериментальные данные по кинетике разложения порошка карбоната кальция при 970 К ( –степень диссоциации карбоната).
–степень диссоциации карбоната).
| t, мин | ||||||||||
| α, % | 0,216 | 0,281 | 0,346 | 0,41 | 0,474 | 0,538 | 0,602 | 0,665 | 0,726 | 0,785 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени превращения α со временем t. Сделать вывод о режиме протекания процесса. Вычислить константу скорости процесса при температуре опыта.
3.3. В таблице представлены экспериментальные данные по кинетике разложения карбоната кадмия (α –степень превращения, %).
| t, мин | ||||||||||||||
| 553 К | α | 9,5 | 13,5 | 18,5 | 33,5 | 38,5 | 47,6 | 51,5 | ||||||
| 573 К | α | 37,5 | 88,5 | 96,5 | ||||||||||
| 593 К | α | 33,5 | 66,5 | 98,6 | 99,9 |
Представить данные графически. Проанализировать. Проверить применимость известных кинетических выражений для описания кинетики топохимических реакций. Вычислить константы скорости при температурах опыта и энергию активации процесса.
3.4. В таблице представлены экспериментальные данные по кинетике разложения карбоната кадмия в атмосфере водорода.
| 513 К | t, мин | |||||||||||||
| α, % | 1,7 | 6,5 | 13,7 | 18,5 | 28,5 | 46,5 | ||||||||
| 533 К | t, мин | |||||||||||||
| α, % | 6,7 | 11,5 | 18,5 | 33,5 | ||||||||||
| 553 К | t, мин | |||||||||||||
| α, % | 26,5 | 38,5 | 71,5 | 86,5 | 98,2 | |||||||||
| 573 К | t, мин | |||||||||||||
| α, % | 56,5 | 96,5 | 98,2 | |||||||||||
| 593 К | t, мин | |||||||||||||
| α, % | 86,5 | 96,6 | 99,9 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени превращения α со временем t. Сделать вывод о режиме протекания процесса. Вычислить константы скорости при температурах опыта и энергию активации процесса.
3.5. В таблице представлены экспериментальные данные по кинетике разложения карбоната марганца ( –степень диссоциации карбоната, %).
–степень диссоциации карбоната, %).
| 683 К | t, мин | 2,2 | 3,9 | 5,4 | 7,4 | 9,6 | 18,3 | 20,2 | 23,1 | 2,2 | 3,9 | 5,4 | ||
| α, % | 8,7 | 20,1 | 29,0 | 39,9 | 49,6 | 59,1 | 69,1 | 78,6 | 84,4 | 90,3 | 8,7 | 20,1 | 29,0 | |
| 725 К | t, мин | 5,7 | 7,1 | 8,7 | 10,7 | 13,3 | 15,2 | 17,2 | 19,6 | 5,7 | 7,1 | 8,7 | 10,7 | 13,3 |
| α, % | 39,9 | 49,6 | 59,1 | 69,1 | 78,6 | 84,9 | 89,5 | 94,7 | 39,9 | 49,6 | 59,1 | 69,1 | 78,6 | |
| 766 К | t, мин | 1,9 | 2,5 | 3,3 | 4,4 | 5,3 | 6,6 | 7,7 | 9,5 | 10,4 | 11,7 | 12,9 | ||
| α, % | 9,9 | 20,1 | 29,0 | 39,9 | 49,6 | 60,1 | 69,1 | 79,3 | 84,4 | 89,9 | 94,7 |
Представить данные графически. Проанализировать. Проверить применимость известных кинетических выражений для описания кинетики топохимических реакций. Вычислить константы скорости при температурах опыта и энергию активации процесса.
3.6. В таблице представлены экспериментальные данные по кинетике разложения карбоната марганца:
| 766 К | t, мин | 1,9 | 2,5 | 3,3 | 4,4 | 5,3 | 6,6 | 7,7 | 9,5 | 10,4 | 11,7 | 12,9 |
| α, % | 9,9 | 20,1 | 29,0 | 39,9 | 49,6 | 60,1 | 69,1 | 79,3 | 84,4 | 89,9 | 94,7 | |
| 873 К | t, мин | 0,6 | 1,6 | 2,7 | 3,3 | 4,4 | 5,7 | 6,6 | 7,6 | 8,8 | ||
| α, % | 10,4 | 20,1 | 29,5 | 49,6 | 59,1 | 69,9 | 79,7 | 84,9 | 89,9 | 94,7 | ||
| 923 К | t, мин | 0,9 | 1,1 | 1,7 | 2,1 | 2,9 | 3,6 | 4,7 | 5,7 | |||
| α, % | 30,4 | 39,9 | 49,6 | 60,1 | 69,9 | 79,9 | 89,9 | 94,7 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени превращения α со временем t. Сделать вывод о режиме протекания процесса. Вычислить константы скорости при температурах опыта и энергию активации процесса.
3.7. В таблице представлены экспериментальные данные по кинетике разложения сульфида железа FeS2 ( – степень диссоциации сульфида).
– степень диссоциации сульфида).
| 883 К | t, мин | ||||||
| α, % | 29,5 | 46,9 | 59,5 | 75,0 | 82,4 | ||
| 904 К | t, мин | ||||||
| α, % | 34,1 | 61,1 | 72,5 | 85,1 | 88,9 | ||
| 914 К | t, мин | ||||||
| α, % | 44,9 | 59,5 | 77,3 | 88,9 | 95,7 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени превращения со временем. Сделать вывод о режиме протекания процесса. Вычислить константы скорости при температурах опыта и энергию активации процесса.
3.8. В таблице представлены экспериментальные данные по кинетике разложения сульфида меди CuS (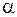 – степень диссоциации сульфида).
– степень диссоциации сульфида).
| 583 К | t, мин | 13,5 | 22,5 | ||||||||||||
| α, % | 13,8 | 42,5 | 51,2 | ||||||||||||
| 588 К | t, мин | 47,5 | 62,5 | ||||||||||||
| α, % | 7,5 | 37,5 | 48,8 | 56,2 | 62,5 | 67,5 | 78,8 | ||||||||
| 598 К | t, мин | 17,5 | 22,5 | 47,5 | |||||||||||
| α, % | 13,8 | 22,5 | 46,8 | 56,2 | 92,5 | 96,2 | 96,4 | ||||||||
| 611 К | t, мин | 1,2 | 2,5 | 12,5 | 27,5 | 32,5 | 67,5 | ||||||||
| α, % | 6,2 | 35,8 | 46,5 | 68,8 | 83,8 | 86,2 | 92,5 | 95,2 | 98,8 | 98,8 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени превращения со временем. Сделать вывод о режиме протекания процесса. Вычислить константы скорости при температурах опыта и энергию активации процесса.
3.9. В таблице представлены экспериментальные данные по кинетике разложения доломита (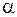 –степень диссоциации карбоната, %)
–степень диссоциации карбоната, %)
| 853 К | t, мин | ||||||||||||
| α, % | 9,5 | 23,0 | 37,8 | 51,4 | 63,5 | 74,3 | 82,4 | 89,2 | 94,6 | 97,3 | 99,2 | 100,0 | |
| 893 К | t, мин | ||||||||||||
| α, % | 13,8 | 26,4 | 36,8 | 43,7 | 60,9 | 69,0 | 77,0 | 88,5 | 92,0 | 96,6 | 97,7 | 100,0 | |
| 933 К | t, мин | ||||||||||||
| α, % | 26,7 | 48,9 | 77,8 | 91,1 | 97,8 | 98,9 | 99,6 | 100,0 | 100,0 |
Представить данные графически. Проанализировать. Проверить применимость известных кинетических выражений для описания кинетики топохимических реакций. Вычислить константы скорости при температурах опыта и энергию активации процесса.
3.10. В таблице представлены экспериментальные данные по кинетике разложения сульфида меди CuS в атмосфере азота ( – степень диссоциации сульфида).
– степень диссоциации сульфида).
| 581 К | t, мин | 7,5 | 62,5 | 92,5 | 122,5 | 142,5 | |||||
| α, % | 13,8 | 21,8 | 37,8 | 46,2 | 52,5 | 56,2 | 57,5 | ||||
| 600 К | t, мин | 4,5 | 17,5 | 27,5 | 44,5 | 85,5 | 132,5 | ||||
| α, % | 12,5 | 26,3 | |||||||||
| 618 К | t, мин | 1,5 | 5,5 | 27,5 | 112,5 | ||||||
| α, % | 7,5 | 21,2 | 33,8 | 49,5 | 58,8 | 71,3 | 81,8 | 88,8 | 92,5 | ||
| 649 К | t, мин | 2,5 | 4,5 | 8,5 | 12,5 | 17,5 | 26,5 | 32,5 | 57,5 | 91,5 | |
| α, % | 15,8 | 26,3 | 53,8 | 79,2 | 98,5 | 98,3 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени превращения со временем. Сделать вывод о режиме протекания процесса. Вычислить константы скорости при температурах опыта и энергию активации процесса.