Чтобы подтвердить индуцированное вакцинацией ингибирование ответов интерферона, выявленное с помощью scRNA-seq, мы стимулировали PBMC от вакцинированных лиц до и через 28 дней после вакцинации IFN-α / β. После 16 часов культивирования и 12 часов стимуляции мы использовали RT-qPCR для измерения относительной экспрессии основных регуляторов IRF2, IRF7 и STAT2. STAT2 и IRF7 были значительно подавлены после вакцинации, но IRF2 показал тенденцию к подавлению (рис. 5e, f). Анализ регулонов показал, что состояния периферической иммунной системы после вакцинации снизили ответы на интерферон I типа, что свидетельствует об ослаблении общей противовирусной способности, по крайней мере, через 28 дней после первой инокуляции.
Воспалительные реакции моноцитов, вызванные вакцинацией
Последние отчеты описали подписи иммунного ответа консервативных принимающей респираторные вирусные инфекции, а именно мета-сигнатуры вирусов (МВС), который также сохраняется в ТОРСЕ-коронавирус-2 инфекции 32, 33. Более высокие баллы MVS связаны с инфекцией 32, 33. Всего в нашем наборе данных было обнаружено 380 (158 положительно и 222 отрицательно повлияли на оценки MVS) из 396 (161 положительно и 235 отрицательно повлияли) генов, выбранных для измерения MVS. Чтобы исследовать иммунные ответы хозяина после вакцинации инактивированным SARS-CoV-2, мы разделили положительные и отрицательные наборы генов и рассчитали баллы MVS (рис. 6а). Баллы MVS были значительно выше после вакцинации (рис. 6b, c).), предполагая, что вакцинация имитирует инфекцию. Интересно, что положительный набор генов MVS преимущественно экспрессировался в моноцитах, тогда как отрицательный набор - в лимфоцитах, что указывает на то, что после вакцинации будут иметь место различные специфичные для клеточного типа иммунные ответы (дополнительный рисунок S3a, b).
|
|
Рис. 6: Моноциты показали высокие баллы MVS и пути, коррелированные с баллами MVS.
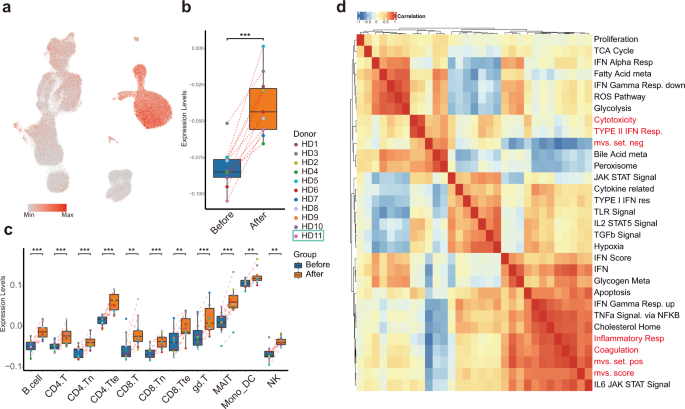
визуализация UMAP окрашены баллами MVS. b Показатели MVS в псевдогрупповых образцах, сочетающих все типы клеток, показали активацию после вакцинации. c Графики в рамке, изображающие распределение баллов среди 11 основных типов иммунных клеток до и после вакцинации. г Тепловая карта корреляции между оценками MVS и расширенными путями дифференциально экспрессируемых генов до и после вакцинации.
Полноразмерное изображение
Чтобы исследовать, какие пути были связаны с MVS-положительным набором генов и MVS-отрицательным набором генов, мы рассчитали корреляцию Спирмена между оценками наборов генов MVS и ранее идентифицировали дифференциально обогащенные пути, используя наши данные scRNA-seq (рис. 6d). Наиболее сильно коррелированным путем с оценкой MVS и положительным набором MVS была «передача сигналов воспалительного ответа», которая резко усиливалась в моноцитах после вакцинации вместе с CD14, FPR1, C5AR1, NAMPT, NLRP3, CDKN1A и IFNGR2. Принимая во внимание, что MVS-отрицательный набор хорошо коррелировал с «сигнатурой цитотоксичности», представленной экспрессией NKG7, CCL4, CST7, PRF1, GZMA, GZMB, IFNG и CCL3, значительно снизился во многих подтипах Т-клеток, но не в NK-клетках после вакцинации (дополнительная информация Рис. S3c).
Обсуждение
Это всестороннее исследование патофизиологических изменений, включая подробные иммунологические изменения у людей после вакцинации против COVID-19. Результаты показали, что вакцинация, помимо стимуляции выработки нейтрализующих антител, также влияла на различные показатели здоровья, в том числе связанные с диабетом, почечной дисфункцией, метаболизмом холестерина, проблемами свертывания крови, электролитным дисбалансом, как если бы добровольцы перенесли инфекцию. scRNA-seq PBMC от добровольцев до и после вакцинации выявила драматические изменения в экспрессии генов иммунных клеток, не только отражающие некоторые из клинических лабораторных измерений, но также предполагающие усиление воспалительных реакций, связанных с NF-κB, которые, как оказалось, в основном имели место. в классических моноцитах. Вакцинация также увеличивала содержание классических моноцитов. Более того, набор генов, положительно влияющий на оценки MVS, также известный как связанный с развитием тяжелых симптомов, был высоко экспрессирован в моноцитах. Ответы на интерферон I типа (IFN-α / β), предположительно полезные против COVID-19, были подавлены после вакцинации. Кроме того, отрицательные гены MVS были высоко экспрессированы в лимфоцитах (T, B и NK-клетки), но показали снижение экспрессии после вакцинации. В совокупности эти данные свидетельствуют о том, что после вакцинации, по крайней мере, к 28 дню, помимо выработки нейтрализующих антител, иммунная система людей, включая лимфоциты и моноциты, возможно, была в более уязвимом состоянии. предположительно полезные против COVID-19, были снижены после вакцинации. Кроме того, отрицательные гены MVS были высоко экспрессированы в лимфоцитах (T, B и NK-клетки), но показали снижение экспрессии после вакцинации. В совокупности эти данные свидетельствуют о том, что после вакцинации, по крайней мере, к 28 дню, помимо выработки нейтрализующих антител, иммунная система людей, включая лимфоциты и моноциты, возможно, была в более уязвимом состоянии. предположительно полезные против COVID-19, были снижены после вакцинации. Кроме того, отрицательные гены MVS были высоко экспрессированы в лимфоцитах (T, B и NK-клетки), но показали снижение экспрессии после вакцинации. В совокупности эти данные свидетельствуют о том, что после вакцинации, по крайней мере, к 28 дню, помимо выработки нейтрализующих антител, иммунная система людей, включая лимфоциты и моноциты, возможно, была в более уязвимом состоянии.
|
|
|
|
Интересно, что наши предварительные данные продемонстрировали, что если мы предварительно инкубировали RBD SARS-CoV-2 с PBMC (от добровольцев до и после вакцинации), а затем обработали клетки IFN-α / β, то ответы интерферона типа I действительно усилились. PBMC после вакцинации, что позволяет предположить, что вакцинация, хотя и снижает общую противовирусную способность человека, усиливает адаптивную иммунную функцию, особенно в отношении SARS-CoV-2 (дополнительный рисунок S4a). С другой стороны, при сравнении PBMC до вакцинации предварительная обработка SARS-CoV-2 S-RBD, по-видимому, снижает ответы на интерферон I типа (P <0,05, IRF2, IRF7, STAT2) (дополнительный рисунок S4b).), предполагая, что первое воздействие вирусного пептида на самом деле вызовет снижение интерфероновых ответов типа I в PBMC. Эти данные in vitro хорошо подтверждают результаты scRNA-seq.
Стоит упомянуть, что у одного человека в когорте А, который принимал антибиотики, не наблюдалось снижения экспрессии генов, связанного с реакцией на интерферон I типа, и у этого человека также был самый высокий титр нейтрализующих антител в когорте. Далее мы рассчитали коэффициент корреляции Пирсона между титрами нейтрализующих антител и воспалительными реакциями, измеренными по усредненной экспрессии генов, связанных с передачей сигналов TNFα через ответы NF-κB и интерферона-α (интерферон I типа). Результаты составили 0,32 и 0,39 при P > 0,05 (дополнительный рис. S4c.), соответственно, предполагая, что изменения иммунного ответа и адаптивная иммунная защита вакцины, по-видимому, не сильно коррелированы. Еще предстоит определить, могут ли антибиотики влиять на эффективность вакцины. Также довольно интересно, что, хотя когорты A и B имели разные профили продукции антител против SARS-CoV-2, их результаты scRNA-seq PBMC были очень похожими, включая их данные scRNA-seq B-клеток (дополнительный рисунок S5a – c).). Следует отметить, что после вакцинации большинство чувствительных В-клеток, особенно те, которые продуцируют зрелые антитела против COVID-19 (IgG), включая В-клетки памяти, должны в первую очередь локализоваться в периферических лимфатических тканях, таких как лимфатические узлы и селезенка, тогда как только несколько зрелых В-клеток могут существовать в кровообращении. Следовательно, популяция B-клеток в препаратах PBMC может не отражать весь спектр гуморального иммунитета.
Анализы, представленные в этом исследовании, в частности scRNA-seq PBMC, не проводились для предыдущих оценок вакцины, независимо от того, были ли изменения в генах, связанных с функцией иммунной системы, специфичными для COVID-19 или могут быть в целом применены к другим вакцинам или другим типам. вакцин против COVID-19 еще предстоит определить. Однако такие подробные анализы в целом должны быть полезны для разработки и применения вакцин. Наше исследование постулирует, что необходимо учитывать потенциальное долгосрочное влияние вакцинации на определенные медицинские состояния 34 или на общее состояние здоровья человека.
Материалы и методы
Участники, сбор клинических данных и процедуры
В программу были привлечены здоровые взрослые добровольцы. Все субъекты прошли медицинский осмотр и заполнили анкету квалифицированными врачами. В исследование были включены здоровые взрослые люди в возрасте 18–60 лет с подмышечной температурой ≤ 37,0 ° C, отрицательные по тесту на нуклеиновую кислоту SARS-CoV-2 и желающие завершить все запланированные процессы исследования. Исключались люди с эпилепсией, заболеваниями головного мозга или психическими заболеваниями, аллергией в анамнезе, неконтролируемыми серьезными хроническими заболеваниями и клинически значимыми отклонениями от нормы в биохимических исследованиях и гематологических исследованиях. Беременные или кормящие женщины также были исключены. Это исследование было одобрено этическим комитетом Шанхайской восточной больницы в соответствии с принципами Хельсинкской декларации (№2020 (096)). Письменное информированное согласие было получено от всех участников перед зачислением.
Всего было зарегистрировано и вакцинировано 11 участников для оценки клинической безопасности и динамических изменений иммунной системы. Среди них пять участников (когорта A) были вакцинированы дозой 4 мкг инактивированной вакцины SARS-CoV-2 (Vero Cell) в дни 1 и 14, а шесть участников (группа B) получили дозу вакцины 4 мкг в дни 1 и 28. Инактивированная вакцина против SARS-CoV-2 (Vero Cell) (China Biotechnology Group Corporation) вводилась внутримышечно в дельтовидную мышцу. Все вакцины были одобрены Национальным институтом по контролю за продуктами и лекарствами Китая.
Лабораторные тесты безопасности, включая показатели, связанные с инфекцией (C-реактивный белок, сывороточный амилоидный белок A), гематологические параметры (количество лейкоцитов, количество нейтрофилов, количество лимфоцитов, количество моноцитов, количество красных кровяных телец, гемоглобин, количество тромбоцитов), функция свертывания -связанные индексы (протромбиновое время, активированное частичное тромбопластиновое время / АЧТВ, фибриноген, активность протромбина / ПВ, международное нормализованное отношение / МНО), параметры, связанные с глюкозой крови (глюкоза в плазме натощак, HbA1c), липиды сыворотки (общий холестерин, триглицериды, ЛПВП -C, LDL-C), ферменты, связанные с сердечной функцией (креатининкиназа, CK-MB), электролиты (калий, натрий, хлорид, бикарбонат, общий кальций, магний), биомаркеры, связанные с функцией печени (например, альбумин, аланинаминотрансфераза / АЛТ, аспартатаминотрансфераза / АСТ, общий билирубин и др.),Были измерены маркеры, связанные с функцией почек (креатинин, мочевая кислота, азот в моче крови / АМК, расчетная скорость клубочковой фильтрации / рСКФ).
Тест на антитела к COVID-19 (IgG / IgM)
Ряд коммерчески доступных наборов для экспресс-тестирования антител COVID-19 (IgG / IgM), включая «Innovita (специфичный для S-белка)», «GenBody (специфический для N-белка)», «Livzon (S + N-белки)» и «AbKhan (S + N белки) »были использованы для тестирования анти-COVID-19 (IgM / IgG) позитивности плазмы добровольцев до и в разное время после вакцинации. Набор «АбХан» был наиболее чувствительным, и в этом исследовании использовались данные.
Тест на нейтрализующие антитела с помощью PRNT
Образцы сыворотки были протестированы с использованием теста нейтрализации уменьшения бляшек (PRNT) на SARS-CoV-2 (2019-nCoV-WIV04) в лаборатории BSL-3. Вкратце, сыворотки инактивировали нагреванием при 56 ° C в течение 30 минут и разбавляли до 1:50 с последующими трехкратными серийными разведениями (1:50, 1: 150, 1: 450, 1: 1350, 1: 4050 и 1: 12 150). Затем сыворотки смешивали с 100 БОЕ вируса и инкубировали при 37 ° C в течение 1 часа. Смеси для разведения вируса и сыворотки и вирусный контроль затем инокулировали в монослои клеток Vero E6 в 24-луночных планшетах в течение 1 часа, а затем добавляли верхнюю среду, включающую 1,5% метилцеллюлозу, при 37 ° C в течение 4–5 дней для образования бляшек. Затем планшеты фиксировали и окрашивали 2% кристаллическим фиолетовым в 30% метаноле в течение 30 минут при комнатной температуре, а бляшки подсчитывали и измеряли вручную.
Приготовление суспензий одноклеточных, подготовка библиотеки одноклеточной РНК и секвенирование.
PBMC выделяли из гепаринизированной венозной крови здоровых добровольцев с использованием среды Ficoll-Paque TM PLUS (GE Healthcare Inc.) в соответствии со стандартным методом центрифугирования в градиенте плотности, предоставленным производителем. PBMC замораживали в среде для замораживания (70% RPMI-1640, 20% FBS и 10% DMSO) и хранили в жидком азоте до использования. Захват отдельных клеток и конструирование библиотеки выполняли с использованием набора Chromium Single Cell 5 'Library & Gel Bead (10 × Genomics) в соответствии с инструкциями производителя. Библиотеки секвенировали с использованием платформы Novaseq 6000 (Illumina).
Анализ и статистика данных scRNA-seq
Данные одноклеточного секвенирования были сопоставлены и количественно оценены с использованием kallisto / bustools (KB, v0.25.0) 35 против эталонного генома человека GRCh38, загруженного с официального сайта 10 × Genomics. Затем для последующего анализа использовались предварительные подсчеты. Мы сделали конвейер для обработки данных. Вкратце, клетки с менее чем 200 генами были отфильтрованы, логарифмические нормализованные подсчеты и отбор верхних 3000 высоко вариабельных генов (HVG) были выполнены с помощью Scanpy 36.
Мы исключили определенные гены из HVG, включая гены митохондрий, гены иммуноглобулинов и гены, связанные с плохо поддерживаемыми моделями транскрипции (помечены префиксом «Rp-»). Затем был проведен анализ главных компонентов (PCA) с использованием HVG и алгоритм Harmony для удаления пакетных эффектов 25. Мы использовали подход PARC для идентификации кластеров 37 и выбранных функций с помощью функции «FeatureSelectionByEnrichment» из алгоритма 38cytograph2, за которым последовал еще один раунд PCA, Harmony и PARC. Впоследствии мы вычислили K ближайших соседей в графе KNN, выполнили аппроксимацию и проекцию однородного многообразия (UMAP) с помощью Pegasuspy 39 и идентифицировали кластеры с помощью PARC. Кроме того, мы применили Scrublet 40 для выявления потенциальных дублетов.
Контроль качества применялся к кластерам по результатам первого раунда конвейера:
- 1.
Кластеры с более чем 20% клеток, из которых количество дублетов> 0,4, определяли как кластеры дублетов.
- 2.
Кластеры с более чем 20% клеток, у которых> 20% их транскриптов было сопоставлено с митохондриальными генами, были определены как кластеры низкого качества.
- 3.
Кластеры с более чем 20% клеток, у которых было <0,05% их транскриптов, картированных с митохондриальными генами, были определены как ядра.
- 4.
Медиана экспрессии PPBP, PF4, HBB, HBA2> 0, что указывает на эритроциты и тромбоциты.
- 5.
Менее 50 ячеек.
- 6.
Количество обнаруженных генов <1000.
- 7.
Отношение среднего общего количества UMI к среднему значению обнаруженных генов <2.
- 8.
Скрублет выявил дублеты.
- 9.
Использование DBSCAN 41 для удаления выбросов.
После удаления низкокачественных клеток мы аннотировали клетки с помощью алгоритма одноклеточного распознавания типов клеток (SingleR), ссылаясь на наборы иммунных данных Монако 42.
Квалифицированные клетки подвергали последующему анализу. Точно так же мы повторно запускаем конвейер для определения основных типов клеток, включая Т-клетки (CD3D, CD3E, CD3G, CD40LG, CD8A, CD8B), В-клетки (MS4A1, CD79A, CD79B), NK-клетки (GNLY, NKG7, TYROBP, NCAM1), и моноциты (CST3, LYZ). Кроме того, мы запускаем конвейер для каждого типа клеток, соответственно, и далее идентифицировали подтипы на основе SingleR-идентифицированных типов клеток и хорошо охарактеризованных маркеров (рис. 3b).
Сравнение доли иммунных клеток
Для образцов из PBMC мы рассчитали пропорции иммунных клеток для каждого основного типа клеток и лежащих в основе подтипов. Для каждого образца соотношение типов ячеек рассчитывалось путем деления количества ячеек в определенном типе ячеек на общее количество ячеек. Чтобы определить изменения в пропорциях клеток между образцами в разных группах, мы выполнили тест Вилкоксона на пропорциях каждого из основных типов клеток, а также подтипов клеток в разных группах (дополнительный рисунок S2). Только те типы клеток, которые имеют статистически значимые различия (P <0,05) в пропорциях, показаны на рис. 3e.
Анализ дифференциальной экспрессии, анализ репрезентативности наборов генов и модули подписей оценок
Чтобы исследовать изменения иммунологических признаков, мы идентифицировали ДЭГ с помощью алгоритма 26 Маската с параметрами по умолчанию. Вкратце, мы сначала суммировали-свернули данные, суммируя UMI по клеткам для каждого здорового донора, чтобы получить общий профиль UMI в стиле RNA-seq для каждого образца. После этого агрегированные значения были загружены в функцию pbDS для идентификации DEG, а тепловые карты были построены с помощью функции pbHeatmap. Анализ избыточного представительства генов DEG (logFC> 0,5 и скорректированный P <0,05) был выполнен с использованием одностороннего точного теста Фишера (как реализовано в пакете «gsfisher» R) с генами «HALLMARK», «KEGG» и «REACTOME». наборы, производные от MSigDB. Наборы генов с P <0,05 считались значимыми. Баллы модуля подписи были рассчитаны с помощью функции «AddModuleScore» с настройками по умолчанию в Seurat. Вкратце, для каждой ячейки оценка была определена как средняя экспрессия списка сигнатурных генов за вычетом средней экспрессии соответствующего списка 43 контрольных генов. Списки генов, используемые для анализа, представлены в дополнительной таблице S11.
Metacell анализ
Мы использовали R-пакет MetaCell 27 для анализа данных. Мы удалили определенные митохондриальные гены, гены иммуноглобулинов и гены, связанные с плохо поддерживаемыми моделями транскрипции (помечены префиксом «Rp-»). Затем мы отфильтровали ячейки с менее чем 500 UMI. Характеристики генов были выбраны с использованием параметра Tvm = 0,08 и минимального общего количества UMI> 100. Впоследствии мы выполнили иерархическую кластеризацию корреляционной матрицы между этими генами (фильтрация генов с низким охватом и вычисление корреляции с использованием матрицы UMI с пониженной выборкой) и выбрали кластеры генов, содержащие якорные гены. Мы использовали K = 100 и 500 итераций начальной загрузки, а также стандартные параметры. Метацеллы были аннотированы наиболее многочисленными типами клеток, составляющими каждый метацелл.
Анализ регуляторной сети генов
Для идентификации и оценки активности регулона мы использовали pySCENIC 28,29рабочий процесс с лог-нормализованными данными метацелл для определения наборов коэкспрессируемых генов. Мы связали прямые мишени с соответствующими факторами транскрипции, используя базы данных RcisTarget (v1.2.1), и сохранили предполагаемые нижестоящие гены с обогащенными мотивами ДНК в 10 т.п.н. или 500 п.н. от сайта начала транскрипции (нормализованная оценка обогащения> 3). Наконец, мы использовали функцию AUCell для оценки активности каждого регулона по клеткам в наборе данных, которая была рассчитана как сумма генов, экспрессируемых на регулон, и создали бинарные матрицы активности на основе пороговых значений, скорректированных вручную после проверки распределений оценок AUC. Показатели специфичности регулона (RSS) рассчитывались функцией «регулон_специфичность_скорес» из алгоритма pySCENIC с параметрами по умолчанию.
Анализ IFN-α / β-ответа PBMC
PBMC выделяли из гепаринизированной крови с помощью Ficoll-Hypaque при 400 × g в течение 30 мин. РВМС (1 × 10 6 мл -1) доноров до и после вакцинации затем высевали в 48-луночные культуральные планшеты с RPMI-1640, содержащим 5% нокаутную замену сыворотки и 0,032% гепарина. На следующий день среду заменяли и клетки обрабатывали 100 нг / мл IFN-α и 10 нг / мл IFN-β в течение 12 часов. Некоторые клетки предварительно обрабатывали 250 нг / мл RBD в течение 16 часов с последующей обработкой IFN-α / β в течение 12 часов. После отмывки и экстракции общей РНК была проведена количественная ПЦР в реальном времени для обнаружения экспрессии генов, связанных с интерфероновым ответом типа I. Изменения складок относительно GAPDH рассчитывались как 2 -ΔΔCtи выражается как среднее ± SEM. Различия между группами оценивали с помощью парного t- критерия Стьюдента и считали значимыми при P <0,05.
статистический анализ
Клинические данные суммировались с использованием среднего (стандартное отклонение), медианы (Q1, Q3) или числа (процент), когда это было необходимо. Знаковый ранговый критерий Вилкоксона использовался для сравнения парных медиан с течением времени для лабораторных характеристик. Кроме того, для сравнения средних изменений по сравнению с исходным уровнем между когортами A и B.Мы классифицировали нежелательные явления в соответствии со шкалой, выпущенной Национальным управлением медицинских продуктов Китая (https://www.nmpa.gov. cn / xxgk / ggtg / qtggtg / 20191231111901460.html), а оценка результатов лабораторных испытаний была основана на диапазоне эталонных значений местного населения. Все статистические тесты были двусторонними. Статистическая значимость определялась как P ≤ 0,05. Статистический анализ выполняли с использованием SAS v9.4 (SAS Institute Inc., Кэри, Северная Каролина, США).
Доступность данных
Номера доступа для исходных данных секвенирования и обработанных данных в этой статье: Архив геномных последовательностей в BIG Data Center (GSA, Пекинский институт геномики Китайской академии наук): HRA001150.
использованная литература
1. 1.
Mulligan, MJ et al. Фаза I / II исследования РНК-вакцины COVID-19 BNT162b1 у взрослых. Nature 586, 589–593 (2020).