Задача № 1
Для реакции А+В = С+Д рассчитать изменение концентрации веществ А, В, С во времени, построить кинетические кривые, если к = 1,09∙10-4 м3/моль∙с, сА,0 = 30 моль/м3, сВ,0 = 20 моль/м3, τ = 5, 10, 20, 30 мин.
Решение:
1) По единице измерения константы − это реакция II порядка.
При сА,0≠сВ,0

сА = сА,0 – х, сВ = сВ,0 – х, сс = х моль/м3
τ = 0 мин сА = 30 – 0, сВ = 20 – 0, сс = 0 моль/м3
τ = 5 мин = 300 с

Тогда сА = 30 – 10,77 = 19,23 моль/м3, сВ = 20 – 10,77 = 9,23, сс = 10,77 моль/м3
τ = 10 мин х2 = 14,69 моль/м3
τ = 20 мин х3 = 17,80 моль/м3
τ = 30 мин х4 = 18,96 моль/м3
2) Сведем данные в таблицу:
| τ, мин | х = сс, моль/м3 | сА, моль/м3 | сВ, моль/м3 |
| 10,77 | 19,23 | 9,23 | |
| 14,69 | 15,31 | 5,31 | |
| 17,80 | 12,20 | 2,20 | |
| 18,96 | 11,04 | 1,04 | |
| Обозначения на графике | ○ | ∆ | □ |

Задача № 2
Для гомогенной реакции
СО+Н2О=СО2+Н2
известны константы скорости реакции при двух температурах:
Т1 = 288.2 К к1 = 0,31·10-3 л/моль·мин
Т2 = 313.2 К к2 = 8,15·10-3 л/моль·мин
Порядок реакции совпадает с молекулярностью; с0,СО = с0,Н2О = 3,85 моль/л. Найдите для этой реакции количество вещества, израсходованное при 303,2 К за 35 мин.
Решение: Уравнение Аррениуса:

Найдем значение энергии активации:

Зная величину Еа,рассчитываем k3 при 303,2 К.

Найдем расход вещества для реакции II порядка:
 , после преобразования, получим значение х:
, после преобразования, получим значение х:

Задача № 3
Константа скорости разложения органической кислоты зависит от температуры
| k·102, с-1 | 5,45 | 10,54 | 12,78 | 22,20 |
| Т, К | 274,4 |
Рассчитайте графически параметры уравнения Аррениуса.
Решение
1) Уравнение Аррениуса

2) Для построения графика находим:
| 1000/Т, К-1 | 3,64 | 3,484 | 3,412 | 3,303 |
| lnk | -2,909 | -2,249 | -2,057 | -1,505 |
| lnk+3 | 0,091 | 0,751 | 0,943 | 1,495 |

3) Из графика определяем:

4) 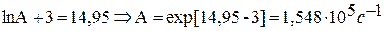
Задача № 4
Энергия активации реакции I порядка равна 104,5 кДж/моль. В уравнении Аррениуса k=А·exp[-Ea/RT] значение А равно 5·1013 с-1. При какой температуре период полупревращения для этой реакции будет равен 1 мин?
Решение:
1) Для реакции I порядка

2) Рассчитываем Т:
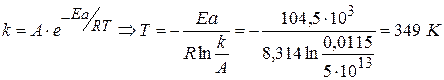
Тема 4: Определение порядков химических реакции
Задача № 1
Для гомогенной реакции А+В=С дана зависимость сА = f(τ). Построить кинетическую кривую, рассчитать константу скорости реакции, определить интегральным методом порядок реакции, определить время получения 50% фосгена от максимально возможного при 27 0С.
СО+Сl2=COCl2
| τ, мин | |||||
| сСО = сCl2·102, моль/л | 1,873 | 1,794 | 1,764 | 1,734 | 1,674 |
Решение:
1. Построим кинетическую кривую сСО = f (τ). По виду кинетической кривой можно определить, что это реакция II порядка.
2. Определение порядка реакции интегральным методом
Если реакция I порядка – ln(c0/cτ) = f (τ), если II порядка, то должна быть прямая в координатах 1/сτ = f (τ)
| τ, мин | |||||
| сСО·102, моль/л | 1,873 | 1,794 | 1,764 | 1,734 | 1,674 |
| ln(c0/cτ) | 0,0431 | 0,0599 | 0,0771 | 0,112 | |
| 10-3/c, моль-1 | 5,33 | 5,57 | 5,67 | 5,77 | 5,97 |
При анализе графических зависимостей ln(c0/cτ) = f (τ) и 1/сτ = f (τ) можно сделать вывод, что это реакция II порядка – все точки лежат на одной прямой.
3. сСО = сCl2, интегральное кинетическое уравнение реакции II порядка:
 =>
=> 







4. Рассчитаем τ1/2 для реакции II порядка:

Задача № 2
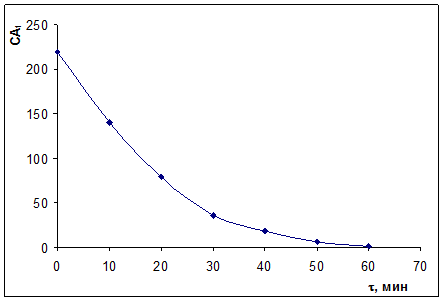
Для гомогенной реакции A1+A2+А3 = В дана зависимость А1 от времени, причем с0,А2 и с0,А3 значительно больше с0,А1. Постройте кинетическую кривую сА1 = f (τ), определите по ней дифференциальным методом частный порядок реакции по веществу А1 и эффективную константу скорости реакции (по методу изолирования Оствальда).
Решение:
A1+A2+А3 = В;
с0,А2 >> с0,А1 и с0,А3 >> с0,А1, тогда скорость реакции главным образом будет зависеть от сА1

1)
| τ, мин | |||||||
| сА1, моль/м3 |
По данным построим кинетическую кривую сА,1 = f (τ).
2) 

Логарифмируя, получим:

Строим график в координатах ln(ω) = f(lncA1).
Но для начала проведем соответствующие расчеты и сведем их в таблицу:
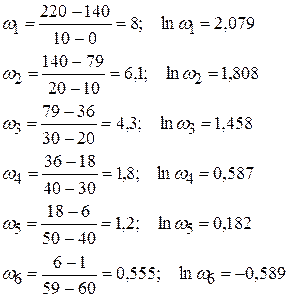



| ω, моль/м3·мин | 6,1 | 4,3 | 1,8 | 1,2 | 0,555 | |
| сср, моль/м3 | 109,5 | 57,5 | 3,5 | |||
| lnω | 2,079 | 1,808 | 1,458 | 0,587 | 0,182 | -0,589 |
| lncср | 5,19 | 4,69 | 4,05 | 3,29 | 2,48 | 1,25 |

3) Рассчитаем порядок по компоненту А1
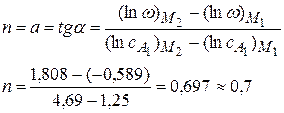
Частный порядок реакции по А1 равен 0,7
4) Рассчитаем из графика кэфф. Отрезок, отсекаемый по оси ординат равен
lnkэфф = −1,53 => кэфф = exp[−1,53]=0,216
Задача № 3
В реакции омыления эфира щелочью получены экспериментальные данные:
| τ, мин | 4,9 | 10,4 | 28,2 | ∞ | ||
| сNaOH, моль/л | 6,195 | 5,059 | 4,240 | 3,350 | 2,935 | ? |
Определить порядок реакции методом подстановки и по Раковскому (по времени полупревращения).
Решение:
1) Метод подстановки.
I порядок 

Максимальное отклонение от кср 22%. Разница в значениях k значительная.
II порядок (сА,0 = сВ,0)

Максимальное отклонение от kср 7%. Расчет константы скорости реакции говорит о том, что это реакция II порядка.
2) По Раковскому
По кинетической кривой cNaOH = f (τ) τ1/2 = 23 мин
II порядок реакции 
I порядок 