Задача №1. «Ленивый студент» (20 баллов)
В качестве контрольной задачи по качественному анализу студенту был выдан раствор, содержащий 6 ионов (4 катиона и 2 аниона ) из следующего списка: сульфат, хлорид, иодид, хлорат, гипохлорит; катионы алюминия, железа(II), железа(III), свинца, хрома(II), марганца, хрома(III) (не считая ионов водорода и гидроксид-ионов). Студент немного подумал и решил ограничиться определением реакции среды раствора: проба с индикаторной бумажкой показала сильно кислую среду. После этого студент сразу сдал правильный ответ преподавателю. Какие же ионы присутствовали в задаче? Ответ подтвердите уравнениями реакций.
Решение
Поскольку среда кислая, существование гипохлорит-иона представляется крайне маловероятным.
H+ + ClO- = HClO (2 балла)
Точно также в кислом растворе не существует ион Cr2+.
2Cr2+ + 2H+ = 2Cr3+ + H2 (2 балла)
Рассмотрим остальные комбинации:
| SO42- | Cl- | ClO3- | I- | |
| Cr3+ | – | |||
| Fe2+ | – | |||
| Pb2+ | ↓ | ↓ | ↓ | |
| Al3+ | ||||
| Mn2+ | – |
Pb2+ + SO42- = PbSO4 (2 балла)
Pb2+ + 2Cl- = PbCl2 (2 балла)
Pb2+ + 2I- = PbI2 (2 балла)
2Cr3+ + 2I- = 2Cr2+ + I2 (3 балла)
6Fe2+ + ClO3- + 6H+ = 6Fe3+ + Cl- + 3H2O (3 балла)
3Mn2+ + ClO3- + 3H2O = 3MnO2 + Cl- + 6H+ (3 балла)
Таким образом, выданный раствор содержал катионы хрома (III), железа(II), алюминия и марганца, анионы сульфат и хлорид. (1 балл)
Задача №2. «Кому все это нужно?!» (20 баллов) (в каждом задании было по 6 веществ)
Заполните предлагаемую таблицу, используя подсказки об агрегатных состояниях и областях применения веществ:
| Вещество | Агрегатное состояние при н.у. | Применение |
| ClF5 | ||
| SF6 | ||
| UF6 | ||
| ICl | ||
| SnCl4 | ||
| N2H4 |
При н.у. два вещества из представленных являются газообразными, одно жидким и три твердыми.
Применение: Добавка для закаливания стекла; Реактив в органическом синтезе; Изолятор и теплоноситель в высоковольтной технике; Практического значения не имеет; Для разделения изотопов; Ракетное топливо.
По 2 балла за каждое верно определённое агрегатное состояние (суммарно не более 10 баллов); по 2 балла за каждое верно определённое применение (суммарно не более 10 баллов).
Ответ на все варианты:
| Вещество | Агрегатное состояние при н.у. | Применение |
| HCN | ж | Боевое отравляющее вещество |
| HN3 | ж | Производные используются в качестве взрывчатых веществ |
| NF3 | г | При травлении кремниевых пластин |
| SO3 | тв | При производстве кислоты |
| OsO4 | тв | Краситель в микроскопии |
| Ga | тв | Производство полупроводников |
| SO2 | г | Консервант в виноделии |
| N2H4 | тв | Ракетное топливо |
| H2O2 | ж | Антисептик |
| BCl3 | ж | Флюс для пайки |
| TiCl4 | ж | Для постановки дымовых завес |
| SnCl4 | ж | Добавка для закаливания стекла |
| SF6 | газ | Изолятор и теплоноситель в высоковольтной технике |
| UF6 | тв | Для разделения изотопов |
| XeF2 | тв | Фторирующий агент |
| CF4 | г | В системах автоматического пожаротушения |
| HF | ж | При производстве алюминия |
| COCl2 | г | Боевое отравляющее вещество |
| ClF5 | Газ | Практического значения не имеет |
| Cs | тв | При производстве фотоэлементов и фотоумножителей |
| ICl | тв | Реактив в органическом синтезе |
Задача 3 «Старая банка». (20 баллов)
Юный химик нашел банку с белым кристаллическим веществом, этикетка которого была частично утрачена, от надписи остался лишь фрагмент «калия......т». Юный химик предположил, что в банке находится соль калия и решил провести серию экспериментов, чтобы выяснить, что это за соль. Прежде всего, Юный химик приготовил водный раствор неизвестной соли калия. Юный химик разлил раствор по нескольким пробиркам. К первой пробирке Юный химик добавил 20% раствор серной кислоты. При этом выделился бесцветный газ, медленно буреющий на воздухе. Ко второй, третьей и четвертой пробирке Юный химик добавил растворы перманганат калия, иодида кадия и избыток раствора сульфата железа(II). Видимого эффекта не наблюдалась. Затем Юный химик добавил к каждой пробирке немного раствора серной кислоты. В итоге, раствор с перманганатом калия обесцветился, а растворы с иодидом калия и сульфатом железа(II) приобрели бурый цвет. Продукт взаимодействия неизвестной соли с сульфатом железа(II) был прозрачный, хоть и имел бурую окраску. Юный химик смекнул, что образовано комплексное соединение железа. Юный химик пошел к своему другу, студенту-физику и попросил помочь с определением формулы. Студент-физик с помощью атомно-абсорбционной спектроскопии выяснил, что неизвестная соль содержит 45,9% калия по массе. Помогите Юному химику определить, что это была за соль в банке.
1) Определите, какая соль была в банке, напишите ее формулу.
2) Напишите уравнения всех реакций, соответствующим успешным экспериментам Юного химика
Объясните, почему раствор неизвестной соли реагирует с растворами перманганата калия, иодида калия и сульфата железа(II) только при подкислении.
Решение
Бесцветный газ, медленно буреющий на воздухе – NO (1 балл), который на воздухе образует бурый газ NO2
2NO + O2 = 2NO2 (1 балл)
С выделением NO при добавлении кислоты разлагаются нитриты, следовательно, неизвестная соль – нитрит калия (KNO2), доказательством служит и массовая доля калия равная 45,9 %. (2 балла)
2KNO2 + H2SO4 = NO↑ + H2O + K2SO4 + NO2↑ (2 балла)
Реакции с подкисленными растворами перманганата калия и иодида калия:
2KMnO4 + 5KNO2 + 3H2SO4 = 2MnSO4 + 5KNO3 + K2SO4 + 3H2O (2 балла)
(без подкисления реакция не идет, т.к. KMnO4 более сильный окислитель в кислой среде, в нейтральной среде KMnO4 недостаточный сильный окислитель для окисления нитритов в нитраты) (2 балла)
KNO2 + KI + H2SO4 = NO + I2 + K2SO4 + H2O (2 балла)
(без подкисления реакция не идет, т.к. в действительности идет реакция между HNO2 и KI, HNO2 более сильный окислитель чем нитрит-ион) (2 балла)
Реакция с подкисленным раствором сульфата железа(II):
Реакция идет в две стадии:
В результате добавления сульфата железа(II) и кислоты выделяется NO
2KNO2 + 2H2SO4 +2FeSO4 = 2NO ↑ +Fe2(SO4)3 + K2SO4 + 2H2O (2 балла)
который затем реагирует с избытком FeSO4 с образованием бурого комплекса FeNOSO4
FeSO4 + NO = FeNOSO4 (2 балла)
Принимается также реакция:
[Fe(H2O)6]SO4 + NO = [Fe(H2O)5 NO]SO4 + H2O
(без подкисления реакция не идет, т.к. для образование комплекса FeNOSO4 необходимо образование NO, а без подкисления реакция нитрита калия и сульфата железа(III) не идет, т.к. в действительности идет реакция между HNO2 и KI, HNO2 более сильный окислитель чем нитрит-ион) (2 балла)
Задача №4. «1000 советов молодой хозяйке» (20 баллов) (в каждом задании было по 3 совета + «предложите свой»)
В литературе приводится много различных советов молодым хозяйкам. Хотя они и выведены эмпирически, опытным путем, большинство из них имеет под собой вполне логичное научное (в ряде случаев – химическое) обоснование. Объясните с точки зрения химика следующие советы:
1) Поверхность золотых и позолоченных изделий со временем темнеет. Вернуть ювелирным изделиям первоначальный нарядный вид помогает выдерживание в крепком (25%-м) водном растворе аммиака.
2) В хрустальном графине не следует хранить вино, а коньяк и водку хранить можно.
3) В хрустальном графине не следует хранить фруктовые соки, а минеральную воду наливать можно;
4) Если потемнели столовые приборы из мельхиора, положите их в оцинкованное ведро и залейте подсоленной водой. Через 3-4 часа они станут совсем светлыми и чистыми.
5) Старые пятна от иода на ткани практически не поддаются удалению. Однако можно попробовать намочить ткань с таким пятном раствором иодида калия (1 чайная ложка на стакан воды) и сразу же промыть водным раствором тиосульфата натрия (2 чайные ложки на стакан воды).
6) Чтобы удалить черноту и зелень с медного или латунного изделия, протрите его поверхность тампоном, смоченным в нашатырном спирте.
7) Чтобы отмыть столовые приборы от жира, воспользуйтесь содой; при этом следует брать не кальцинированную и не питьевую, а стиральную соду.
8) Предложите еще один совет молодой хозяйке, обосновав его с точки зрения химии.
Решение
1) Темнеют ювелирные изделия из-за взаимодействия меди и серебра, входящих в состав сплава, с кислородом воздуха. (2 балла) Соответственно, при обработке аммиаком протекают следующие процессы:
CuO + 4NH3 + H2O = [Cu(NH3)4](OH)2
Ag2O + 4NH3 + H2O = 2[Ag(NH3)2]OH (3 балла)
2) В кислой среде силикат свинца, входящий в состав хрусталя и придающий ему блеск, будет частично выщелачиваться и переходить в раствор. (2 балла) С одной стороны, портится хрусталь (и теряет свой блеск), с другой – в растворе появятся ядовитые соли свинца (карбоксилаты свинца). (3 балла)
3) В состав мельхиора входит медь, никель, иногда железо и марганец. Потемнение связано прежде всего с окислением меди. (2 балла) В указанных условиях пойдет электрохимический процесс:
Zn + CuO + H2O = Cu + Zn(OH)2.
Хлорид натрия играет роль электролита и обеспечивает перенос электронов. (3 балла)
4) Сладкий вкус подмороженного картофеля связан с накоплением в нем глюкозы, являющейся хорошим восстановителем. Вместе с тем, в картофеле достаточно высоко содержание поташа, обусловливающего щелочную среду картофельного отвара. (2 балла) Тогда будет протекать реакция «серебряного зеркала»:
Ag2O + C6H12O6 + KOH = C6H11O7K + 2Ag + H2O (3 балла)
5) Иод переходит в раствор в виде дииодоиодата(I) калия, который затем восстанавливается тиосульфатом натрия (2 балла):
I2 + KI = K[I3]
K[I3] + 2Na2S2O3 = KI + 2NaI + Na2S4O6 (3 балла)
6) Чернота и зелень на медных и латунных изделиях – это оксид меди и карбонат гидроксомеди, соответственно. (2 балла)
При обработке аммиаком протекают реакции:
CuO + 4NH3 + H2O = [Cu(NH3)4](OH)2
(CuOH)2CO3 + 10NH3 + 2H2O= 2[Cu(NH3)4](OH)2 + (NH4)2CO3 (3 балла)
7) Стиральная сода Na2CO3∙10H2O из-за гидролиза по аниону создает сильнощелочную среду (2 балла). Жиры (сложные эфиры глицерина) эффективно гидролизуются в щелочном растворе. (3 балла)
8) За химически обоснованный совет - 5 баллов.
Задача №5. «Галогены» (20 баллов)
В одной старой неопубликованной рукописи неизвестного автора, юный химик обнаружил схему реакции металла М с избытком различных галогенов:
К сожалению, рукопись была сильно изъедена реактивами. Единственное, что можно было разобрать о характеристиках этих веществ, была массовая доля одного из элементов в соединениях D, Е, G и J, которая составляла 81,9%, 61,4 %, 54,4 %, и 48,8 % соответственно. Идентифицируйте соединения A - J. Напишите уравнения реакций. Как Вы думаете, кто мог быть автором данной рукописи, и когда она могла быть написана? Ответ аргументируйте.
Решение
Из схемы видно, что в задании приведено содержание иода в соединениях D, Е, G и J. Впрочем, Вы можете проверить остальные галогены и убедиться, что для этих случаев решения нет. Опираясь на массовую долю иода в D можем установить металл. В общем виде формулу иодида можно записать как MIx, где x – степень окисления металла.

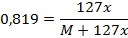

Для x = 2 получаем железо. (2 балла) Аналогично, можно установить и остальные формулы веществ, для которых дана массовая доля иода.
По 0,5 балла за правильное определение формул веществ A – D, по 1 баллу за правильное определение формул веществ E – I. (Всего 8 баллов)
По 0,5 балла за написанные уравнения реакций с участием железа, по 1 баллу за остальные реакции. (Всего 8 баллов)
Данная работа могла быть написана только после выделения фтора Анри Муассаном в 1886 году. Поэтому, автором мог быть, например, сам Муассан, а дата написания – вторая половина (конец) 19 века. (2 балла)
2. В одной старой неопубликованной рукописи неизвестного автора, юный химик обнаружил схему реакции металла М с избытком различных галогенов:
К сожалению, рукопись была сильно изъедена реактивами. Единственное, что можно было разобрать о характеристиках этих веществ, была массовая доля одного из элементов в соединениях С, Е, F и I, которая составляла 28,6%, 38,6 %, 69,3 %, и 45,7 % соответственно. Идентифицируйте соединения A - J. Напишите уравнения реакций. Как Вы думаете, кто мог быть автором данной рукописи, и когда она могла быть написана? Ответ аргументируйте.
3. В одной старой неопубликованной рукописи неизвестного автора, юный химик обнаружил схему реакции металла М с избытком различных галогенов:
К сожалению, рукопись была сильно изъедена реактивами. Единственное, что можно было разобрать о характеристиках этих веществ, была массовая доля одного из элементов в соединениях B, F, G и H, которая составляла 79,8%, 30,7 %, 45,6 %, и 27,2 % соответственно. Идентифицируйте соединения A - J. Напишите уравнения реакций. Как Вы думаете, кто мог быть автором данной рукописи, и когда она могла быть написана? Ответ аргументируйте.
4. В одной старой неопубликованной рукописи неизвестного автора, юный химик обнаружил схему реакции металла М с избытком различных галогенов:
К сожалению, рукопись была сильно изъедена реактивами. Единственное, что можно было разобрать о характеристиках этих веществ, была массовая доля одного из элементов в соединениях A, H, I и J, которая составляла 64,6 %, 72,8 %, 54,3 %, и 51,2 % соответственно. Идентифицируйте соединения A - J. Напишите уравнения реакций. Как Вы думаете, кто мог быть автором данной рукописи, и когда она могла быть написана? Ответ аргументируйте.