Общая характеристика металлов и сплавов
Металлы и их сплавы повсеместно используют для изготовления конструкций машин, оборудования, инструмента и т. д. Несмотря на широкий круг искусственно созданных материалов, керамики, клеев, металлы служат основным конструкционным материалом и в обозримом будущем по-прежнему будут доминировать. В природе металлы встречаются как в чистом виде, так и в рудах, оксидах и солях. В чистом виде встречаются химически устойчивые элементы (Pt, Au, Ag, Hg, Cu).
Из 109 открытых элементов, представленных в периодической системе элементов Д.И.Менделеева, 22 являются неметаллами.
Металлические материалы обычно подразделяют на две большие группы: железо и сплавы железа (сталь и чугун) называют черными металлами, а остальные металлы и их сплавы — цветными.
Цветные металлы, применяемые в технике, подразделяют на следующие группы:
- легкие металлы (Mg, Be, Al, Ti) с плотностью до 5 г/см3;
- тяжелые (Pb, Mo, Ag, Au, Pt, W, Ta, Ir, Os) с плотностью, превышающей 10 г/см3;
- легкоплавкие (Sn, Pb, Zn) с температурой плавления соответственно 232; 327; 410°С;
- тугоплавкие (W, Mo, Ta, Nb) с температурой плавления существенно выше, чем у железа (свыше 1536°С);
- благородные (Au, Ag, Pt) с высокой устойчивостью против коррозии;
- урановые, или актиноиды (актиниды), используемые в атомной технике;
- редкоземельные — лантаноиды, применяемые для модифицирования стали;
- щелочные и щелочноземельные (Na, K, Li, Ca), в свободном состоянии применяемые в качестве жидкометаллических теплоносителей в атомных реакторах; натрий также используется в качестве катализатора в производстве искусственного каучука, а литий — для легирования легких и прочных алюминиевых сплавов, применяемых в самолетостроении.
Свойства металлов разнообразны. Ртуть замерзает при температуре -38,8°С; вольфрам выдерживает рабочую температуру до 2000°С (температура плавления — 3410°С); литий, натрий, калий легче воды; иридий и осмий в 42 раза тяжелее лития; электропроводность серебра в 130 раз выше, чем у марганца. Вместе с тем металлы имеют характерные общие свойства. К ним относятся:
- высокая пластичность;
- высокая теплопроводность;
- высокая электропроводность;
- положительный температурный коэффициент электрического сопротивления, означающий рост сопротивления с повышением температуры, и сверхпроводимость многих металлов при температурах, близких к абсолютному нулю;
- хорошая отражательная способность (металлы непрозрачны и имеют характерный металлический блеск);
- термоэлектронная эмиссия, т. е. способность к испусканию электронов при нагреве;
- кристаллическое строение в твердом состоянии.
Кристаллическое строение металлов
Общее свойство металлов и сплавов — их кристаллическое строение, характеризующееся определенным закономерным расположением атомов в пространстве. Для описания атомно-кристаллической структуры используют понятие кристаллической решетки, являющейся воображаемой пространственной сеткой с ионами (атомами) в узлах.
Атомно-кристаллическая структура может быть представлена изображением не рядом периодически повторяющихся объемов, а одной элементарной ячейкой — ячейкой, повторяющейся во всех трех измерениях. Трансляцией этого наименьшего объема можно полностью воспроизвести структуру кристалла (рис. 2.1).
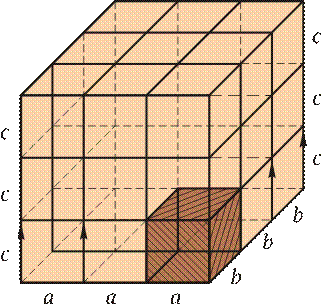 Рис. 2.1.Кристаллическая решетка с параметрами a, b, c
Рис. 2.1.Кристаллическая решетка с параметрами a, b, c
В кристалле элементарные частицы (атомы, ионы) сближены до соприкосновения. Для упрощения пространственное изображение принято заменять схемами, где центры тяжести частиц представлены точками. В точках пересечения прямых линий располагаются атомы; их называют узлами решетки. Расстояния a, b и c между центрами атомов, находящихся в соседних узлах решетки, называют параметрами или периодами решетки. Величина их в металлах примерно 0,1…0,7 нм, размеры элементарных ячеек 0,2…0,3 нм.
На рис. 2.2 показаны три типа элементарных ячеек кристаллических решеток, наиболее характерных для металлов: объемно-центрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ), а также схемы упаковки в них атомов. В ОЦК-решетке атомы расположены в вершинах куба, а один атом — в центре его объема (рис. 2.2, а). В ГЦК-решетке атомы расположены в вершинах куба и в центре каждой грани (рис. 2.2, б). В ГПУ-решетке атомы расположены в вершинах и в центре шестигранных оснований призмы, а три атома — в средней плоскости призмы (рис. 2.2, в).
 Рис. 2.2.Типы элементарных ячеек кристаллических решеток металлов и схемы упаковки в них атомов:
Рис. 2.2.Типы элементарных ячеек кристаллических решеток металлов и схемы упаковки в них атомов:
а — объемно-центрированная кубическая; б — гранецентрированная кубическая; в — гексагональная плотноупакованная решетка
Некоторые металлы при разных температурах могут иметь разную кристаллическую решетку. Способность металла существовать в различных кристаллических формах носит название полиморфизма.
Принято обозначать полиморфную модификацию, устойчивую при более низкой температуре, индексом a (например, Fea или a-Fe), при более высокой b, затем g и т. д.
Известны полиморфные превращения железа: Fea «Feg (a-Fe «g-Fe), титана: Tia «Tig (a-Ti «g-Ti) и других элементов.
Температура превращения одной кристаллической модификации в другую называется температурой полиморфного превращения.
При полиморфном превращении меняются форма и тип кристаллической решетки — происходит перекристаллизация. Так, при температуре ниже 911°С устойчиво a-железо, в интервале температур 911…1392°С устойчиво g-железо. При нагреве выше 911°С атомы ОЦК-решетки перестраиваются, образуя ГЦК-решетку. На явлении полиморфизма основана термическая обработка.
При переходе из одной полиморфной формы в другую меняются свойства, в частности плотность и, соответственно, объем вещества. Например, плотность g-железа на 3% больше плотности a-железа, а удельный объем соответственно меньше. Эти изменения объема необходимо учитывать при термической обработке.
Полиморфизм олова явился одной из причин гибели полярной экспедиции английского исследователя Роберта Скотта. Оловом были запаяны канистры с керосином. При низкой температуре произошло полиморфное превращение пластичного белого олова с образованием хрупкого порошка серого олова. Горючее вылилось, и на обратном пути экспедиция осталась без топлива. Превращение белого олова в серое называют оловянной чумой.
Исследование физико-химической природы этого явления позволило разработать способы борьбы с ним. Добавки в олово таких элементов, как висмут, свинец и сурьма, противодействуют восприимчивости олова к оловянной чуме.
Типы кристаллических решеток важнейших металлов приведены в табл. 2.1 и 2.2.
| Таблица 2.1. Типы кристаллических решеток важнейших металлов с одним типом решетки | |
| Металлы | Тип решетки |
| Ag, Au, Pt, Cu, Al, Pb, Ni | ГЦK |
| Na, K, V, Nb, Cr, Mo, W | ОЦK |
| Be, Mg, Zn, Cd | ГПУ |
| Таблица 2.2. Типы кристаллических решеток важнейших металлов с полиморфным превращением | |||
| Металл | Тип решетки | Аллотропическая форма | Диапазон температур существования данной модификации, °С |
| Fe | ОЦK | a | До 911 |
| ГЦK | g | 911…1392 | |
| ОЦK | d | 1392…1536 | |
| Co | ГПУ | a | До 477 |
| ГЦK | b | 477…1430 | |
| Sn | Алмазная | a | До 13 |
| Тетрагональная объемно-центрированная | b | 13 … 232 | |
| Mn | Kубическая сложная многоатомная | a | До 700 |
| Kубическая сложная многоатомная | b | 700…1079 | |
| Тетрагональная гранецентрированная | g | 1079…1143 | |
| ОЦK | d | 1143…1244 | |
| Zr | ГПУ | a | До 862 |
| ОЦK | b | 862…1852 | |
| Ti | ГПУ | a | До 882 |
| ОЦK | b | 882…1668 | |
| U | Ромбическая | a | До 663 |
| Тетрагональная объемно-центрированная | b | 663…764 | |
| ОЦK | g | 764…1130 |
Свойства материалов зависят от природы атомов, из которых они состоят, и силы взаимодействия между ними. Аморфные материалы характеризуются хаотическим расположением атомов. Поэтому свойства их в разных направлениях одинаковы, другими словами, аморфные материалы изотропны.
В кристаллических материалах расстояния между атомами в разных кристаллографических направлениях различны. Например, в ОЦК-решетке в кристаллографической плоскости, проходящей через грань куба, находится всего один атом, так как четыре атома в вершинах одновременно принадлежат четырем соседним элементарным ячейкам: (1/4)×4 = 1. В то же время в плоскости, проходящей через диагональ куба, будут находиться два атома: 1 + (1/4)×4 = 2. Из-за неодинаковой плотности атомов в разных направлениях кристалла наблюдаются разные свойства. Различие свойств в кристалле в зависимости от направления испытания называется анизотропией.
Разница в физико-химических и механических свойствах в разных направлениях может быть весьма существенной. При измерении в двух взаимно-перпендикулярных направлениях кристалла цинка значения температурного коэффициента линейного расширения (ТКЛР) различаются в 3—4 раза, а прочности кристалла железа — более чем в 2 раза.
Анизотропия свойств характерна для одиночных кристаллов, или так называемых монокристаллов. Большинство же технических литых металлов, затвердевших в обычных условиях, имеют поликристаллическое строение. Такие металлы состоят из большого числа кристаллов или зерен (рис. 2.3, а). При этом каждое отдельное зерно анизотропно. Различная ориентация отдельных зерен приводит к тому, что в целом свойства поликристаллического металла являются усредненными.
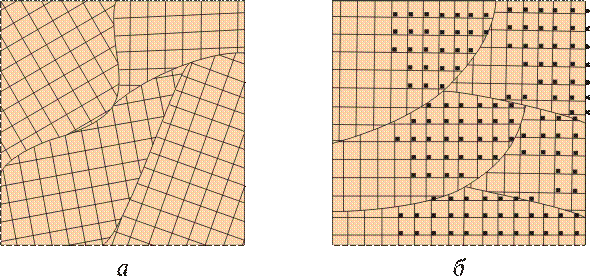 Рис. 2.3.Ориентация кристаллических решеток в зернах литого металла (а) и после обработки давлением (б)
Рис. 2.3.Ориентация кристаллических решеток в зернах литого металла (а) и после обработки давлением (б)
Поликристаллическое тело характеризуется квазиизотропностью — кажущейся независимостью свойств от направления испытания. Квазиизотропность сохраняется в литом состоянии. При обработке давлением (прокатка, ковка), особенно если она ведется без нагрева, большинство зерен металла приобретает примерно одинаковую ориентировку — так называемую текстуру (рис. 2.3, б), после чего металл становится анизотропным. Свойства деформированного металла вдоль и поперек направления главной деформации могут существенно различаться. Анизотропия может приводить к дефектам металла (расслой, волнистость листа). Анизотропию необходимо учитывать при конструировании и разработке технологии получения деталей.
Дефекты строения кристаллических тел
Общие сведения. Идеальная кристаллическая решетка представляет собой многократное повторение элементарных кристаллических ячеек. Для реального металла характерно наличие большого количества дефектов строения, нарушающих периодичность расположения атомов в кристаллической решетке, что оказывает существенное влияние на свойства материала.
Различают три типа дефектов кристаллического строения: точечные, линейные и поверхностные.
Точечные дефекты. Такие дефекты (рис. 2.4) характеризуются малыми размерами во всех трех измерениях. Величина их не превышает нескольких атомных диаметров. К точечным дефектам относятся свободные места в узлах кристаллической решетки — вакансии (рис. 2.4, а); атомы, сместившиеся из узлов кристаллической решетки в межузельные промежутки, — дислоцированные атомы (рис. 2.4, б); атомы других элементов, находящиеся как в узлах, так и в междоузлиях кристаллической решетки, — примесные атомы (рис. 2.4, в). Точечные дефекты примесных и дислоцированных атомов могут располагаться обособленно или образовывать цепочки. Точечные дефекты образуются в процессе кристаллизации под воздействием тепловых, механических, электрических воздействий, а также при облучении нейтронами, электронами, рентгеновскими лучами.
 Рис. 2.4.Точечные дефекты в кристаллической решетке:
Рис. 2.4.Точечные дефекты в кристаллической решетке:
а — вакансия; б — дислоцированный атом; в — примесный атом внедрения
Вакансии и дислоцированные атомы могут появляться вследствие теплового движения атомов. В характерных для металлов решетках энергия образования дислоцированных атомов значительно больше энергии образования тепловых вакансий. Поэтому основными точечными дефектами в металлах являются тепловые вакансии. При комнатной температуре концентрация вакансий сравнительно невелика и составляет 1 вакансия на 1018 атомов, но резко повышается при нагреве, особенно вблизи температуры плавления. Точечные дефекты не закреплены в определенных объемах металла, они непрерывно перемещаются в кристаллической решетке в результате диффузии.
Косвенным доказательством образования вакансий в кристаллической решетке может служить простой эксперимент с нагревом двух одинаковых образцов алюминия до температуры, на несколько градусов меньшей его температуры плавления. Если охлаждение этих образцов провести с разной скоростью, при комнатной температуре объем быстро охлажденного (закаленного) образца будет на 0,2% больше, чем объем медленно охлажденного (отожженного) образца. Объясняется это тем, что при температуре, близкой к температуре плавления, благодаря диффузии части атомов к поверхности в металле образуется большое число вакансий. В случае медленного охлаждения большинство атомов успевает вернуться в исходное положение. При быстром охлаждении эти вакансии не успевают вернуться в исходное состояние и остаются в структуре закаленного образца. Если же закаленный образец вновь нагреть и медленно охладить, разница между объемами образцов исчезнет.
Присутствие вакансий объясняет возможность диффузии — перемещения атомов на расстояния, превышающие средние межатомные расстояния для данного металла. Перемещение атомов осуществляется путем обмена местами с вакансиями.
Линейные дефекты. Такие дефекты характеризуются малыми размерами в двух измерениях, но имеют значительную протяженность в третьем измерении. Наиболее важный вид линейных дефектов — дислокации.
Теория дислокаций позволила объяснить природу прочности и пластичности металлов. Ее использование дало возможность объяснить огромную разницу между теоретической и практической прочностью металлов.
На рис. 2.5 приведена схема участка кристаллической решетки с одной лишней атомной полуплоскостью, т. е. краевой дислокацией. Линейная атомная полуплоскость PQQ ¢ P ¢ называется экстраплоскостью, а нижний край экстраплоскости QQ ¢ — линией дислокации. Если экстраплоскость находится в верхней части кристалла, дислокацию называют положительной и обозначают знаком ^, если в нижней — отрицательной и обозначают знаком  . Различие между дислокациями чисто условное. Перевернув кристалл, мы превращаем положительную дислокацию в отрицательную. Знак дислокации позволяет оценить результат их взаимодействия. Дислокации одного знака отталкиваются, а противоположного — притягиваются.
. Различие между дислокациями чисто условное. Перевернув кристалл, мы превращаем положительную дислокацию в отрицательную. Знак дислокации позволяет оценить результат их взаимодействия. Дислокации одного знака отталкиваются, а противоположного — притягиваются.
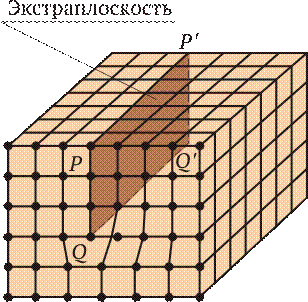 Рис. 2.5.Краевая дислокация
Рис. 2.5.Краевая дислокация
Помимо краевых дислокаций в кристаллах могут образовываться винтовые дислокации. Винтовые дислокации могут быть получены частичным сдвигом атомных слоев по плоскости, который нарушает параллельность атомных слоев.
Вблизи линии дислокации атомы смещены со своих мест и кристаллическая решетка искажена, что вызывает образование поля напряжений: выше линии дислокации решетка сжата, а ниже — растянута. Дислокации образуются уже при кристаллизации металлов, а также в ходе пластической деформации и фазовых превращений. Плотность дислокаций может достигать большой величины. Под плотностью дислокаций r обычно понимают суммарную длину дислокаций å l, приходящуюся на единицу объема V кристалла: r = å l / V. Таким образом, плотность дислокаций r выражается в см/см3, или см-2. Для отожженных металлов плотность дислокаций составляет 103…106 см-2, после холодной деформации она увеличивается до 1011…1012 см-2, что соответствует примерно 1 млн км дислокаций в 1 см3. Плотность дислокаций может быть определена экспериментально при больших увеличениях подсчетом числа выходов дислокаций на единицу площади предварительно протравленного металлографического шлифа, а также при изучении структуры тонких пленок на просвет в электронном микроскопе.
Установлено, что дислокации притягивают в свою зону атомы примесей, которые осаждаются в виде цепочки вдоль края экстраплоскости. Такие атомы снижают уровень упругих искажений дислокационной структуры. Цепочки инородных атомов образуют так называемые атмосферы Коттрелла, или облака Коттрелла. С повышением температуры облака Коттрелла рассеиваются. При понижении температуры до температуры, соответствующей пределу растворимости, они могут образовывать дисперсные выделения второй фазы.
Использование теории дислокаций позволило объяснить большое расхождение между теоретической и фактической прочностью металлов. Теоретическая прочность должна быть пропорциональна произведению сил межатомной связи на число атомов в сечении кристалла.
Расчетное усилие для смещения одной части кристалла относительно другой оказалось на 2—3 порядка выше фактически затрачиваемого при пластической деформации металла. Так, теоретическая прочность железа составляет примерно 13000 МПа, а фактическая — 250 МПа. Такое расхождение теоретической и фактической прочности объясняется тем, что деформация происходит не вследствие одновременного смещения целых атомных плоскостей, а вследствие постепенного перемещения дислокаций.
Влияние дислокаций на процесс пластической деформации на примере краевых дислокаций показано на рис. 2.6. Пластический сдвиг является следствием постепенного перемещения дислокаций в плоскости сдвига. Распространение скольжения по плоскости скольжения происходит последовательно. Каждый элементарный акт перемещения дислокации из одного положения в другое совершается путем разрыва лишь одной вертикальной атомной плоскости. Для перемещения дислокаций требуется значительно меньшее усилие, чем для жесткого смещения одной части кристалла относительно другой в плоскости сдвига. При движении дислокации вдоль направления сдвига через весь кристалл происходит смещение верхней и нижней его частей на одно межатомное расстояние. В результате перемещения дислокация выходит на поверхность кристалла и исчезает. На поверхности остается ступенька скольжения.
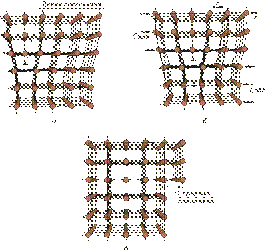 Рис. 2.6.Схема пластической деформации путем последовательного перемещения дислокации в простой кубической решетке:
Рис. 2.6.Схема пластической деформации путем последовательного перемещения дислокации в простой кубической решетке:
а — исходное состояние краевой дислокации (^); б — контур Бюргерса вокруг дислокации: b — вектор Бюргерса; x — направление перемещения; в — контур Бюргерса для неискаженной решетки после скольжения
В лекции о роли дислокаций Эгон Орован в качестве аналогии движения дислокаций указывал способы перемещения таких представителей животного мира, как дождевой червь или змея. Эти животные скользят по поверхности земли, последовательно перемещая участки своего тела. При этом участки, через которые прошла волна возмущения, восстанавливают исходную форму. В случае пластического сдвига позади переместившейся дислокации атомная структура верхних и нижних слоев восстанавливает свою исходную конфигурацию.
Другой аналогией движения дислокаций является перемещение складки на ковре (рис. 2.7). Последовательное перемещение складки потребует значительно меньше усилий, чем перемещение всего ковра по поверхности пола, хотя в обоих случаях будет достигнут один и тот же результат — ковер переместится на одинаковое расстояние.
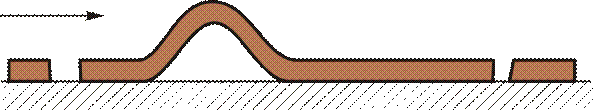 Рис. 2.7.Схема движения дислокации по аналогии с перемещением складки на ковре
Рис. 2.7.Схема движения дислокации по аналогии с перемещением складки на ковре
Дислокации легко перемещаются в направлении, перпендикулярном экстраплоскости. Чем легче перемещаются дислокации, тем ниже прочность металла, тем легче идет пластическая деформация.
Таким образом, причиной низкой прочности реальных металлов является наличие в структуре материала дислокаций и других несовершенств кристаллического строения. Получение бездислокационных кристаллов приводит к резкому повышению прочности материалов (рис. 2.8). Левая ветвь кривой (штриховая линия) соответствует созданию совершенных бездислокационных нитевидных кристаллов (так называемых усов), прочность которых близка к теоретической.
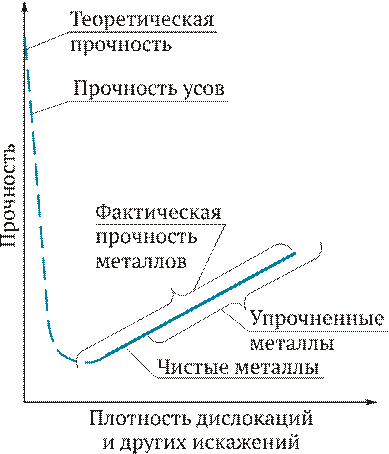 Рис. 2.8.Влияние искажений кристаллической решетки на прочность кристаллов
Рис. 2.8.Влияние искажений кристаллической решетки на прочность кристаллов
При ограниченной плотности дислокаций и других искажений кристаллической решетки процесс сдвига происходит тем легче, чем больше дислокаций находится в объеме металла. С ростом напряжений возрастает число источников дислокаций в металле, и их плотность увеличивается. Помимо параллельных дислокаций возникают дислокации в разных плоскостях и направлениях. Дислокации воздействуют друг на друга, мешают друг другу перемещаться, происходит их аннигиляция (взаимное уничтожение) и т. д. С повышением плотности дислокаций их движение становится все более затрудненным, требуется увеличение прилагаемой нагрузки для продолжения деформации. В результате металл упрочняется, что соответствует правой ветви кривой (сплошная линия) на рис. 2.8.
Упрочнению способствуют и другие несовершенства кристаллического строения, также тормозящие движение дислокаций. К ним относятся атомы растворенных в металле примесей и легирующих элементов, частицы выделений второй фазы, границы зерен или блоков и т. д. На практике препятствие движению дислокаций, т. е. упрочнение, создается введением других элементов (легированием), наклепом, термической или термомеханической обработкой. Снижение температуры также препятствует свободному перемещению дислокаций. При низких температурах прочность растет, а пластичность падает. Металл становится более прочным, но хрупким.
Повышение прочности металлов и сплавов может быть достигнуто двумя путями: получением металлов с более близким к идеальному строением кристаллической решетки, т. е. металлов, в которых отсутствуют дефекты кристаллического строения или же их число крайне мало, либо наоборот увеличением числа структурных несовершенств, препятствующих движению дислокаций.
Поверхностные дефекты. Такие дефекты имеют малую толщину и значительные размеры в двух других измерениях. Обычно это места стыка двух ориентированных участков кристаллической решетки. Ими могут быть границы зерен, границы фрагментов внутри зерна, границы блоков внутри фрагментов. Соседние зерна по своему кристаллическому строению имеют неодинаковую пространственную ориентацию решеток. Блоки повернуты относительно друг друга на угол от нескольких секунд до нескольких минут, их размер — 10-5 см. Фрагменты имеют угол разориентировки q не более 5°. Если угловая разориентировка решеток соседних зерен меньше 5°, такие границы называют малоугловыми границами (рис. 2.9). Все субзеренные границы (границы фрагментов и блоков) — малоугловые. Строение границ зерен оказывает большое влияние на свойства металла.
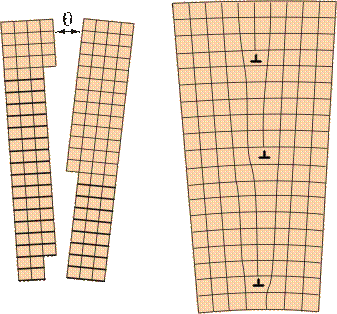 Рис. 2.9.Схема малоугловой границы между блоками
Рис. 2.9.Схема малоугловой границы между блоками
Граница между зернами представляет собой узкую переходную зону шириной 5—10 атомных расстояний с наружным порядком расположения атомов. В граничной зоне кристаллическая решетка одного зерна переходит в решетку другого (рис. 2.10). Неупорядоченное строение переходного слоя усугубляется скоплением в этой зоне дислокаций и повышенной концентрацией примесей.
 Рис. 2.10.Схема строения зерен и границы между ними
Рис. 2.10.Схема строения зерен и границы между ними
Плоскости и направления скольжения в соседних зернах не совпадают. Скольжение первоначально развивается в наиболее благоприятно ориентированных зернах. Разная ориентация систем скольжения не позволяет дислокациям переходить в соседние зерна, и, достигнув границы зерен, они останавливаются. Напряжения от скопления дислокаций у границ одних зерен упруго распространяются через границы в соседние зерна, в результате чего в них приводятся в действие источники образования новых дислокаций. Происходит передача деформации от одних зерен к другим, подобно передаче эстафеты в легкоатлетических соревнованиях.
Вследствие того что границы зерен препятствуют перемещению дислокаций и являются местом повышенной концентрации примесей, они оказывают существенное влияние на механические свойства металла.
Под размером зерна принято понимать величину его среднего диаметра, выявляемого в поперечном сечении. Это определение условно, так как действительная форма зерна в металлах меняется в широких пределах — от нескольких микрометров до миллиметров. Средний размер зерна оценивается 10 баллами по специальной стандартизованной шкале и характеризуется числом зерен, приходящихся на 1 мм2 поверхности шлифа, при увеличении в 100 раз (рис. 2.11).
 Рис. 2.11.Эталон номера зерна G 1 при 100-кратном увеличении:
Рис. 2.11.Эталон номера зерна G 1 при 100-кратном увеличении:
а — для сталей; б — для цветных сплавов
Процесс пластического течения, а следовательно, и предел текучести зависят от длины свободного пробега дислокаций до «непрозрачного» барьера, т. е. границ зерен металла. Предел текучести sт связан с размером зерна d уравнением Холла—Петча: sт = s0 + + kd -1/2, где s0, k — постоянные для данного металла. Чем мельче зерно, тем выше предел текучести и прочность металла. Одновременно при измельчении зерна увеличиваются пластичность и вязкость металла. Последнее особенно важно для металлических изделий, работающих при низких температурах. Повышенная пластичность и вязкость обусловлены более однородным составом и строением мелкозернистого металла, отсутствием в нем крупных скоплений, структурных несовершенств, способствующих образованию трещин.
Помимо перечисленных дефектов в металле имеются макродефекты объемного характера: поры, газовые пузыри, неметаллические включения, микротрещины и т. д., которые снижают прочность металла.
Процесс кристаллизации
Общая характеристика процесса. Еще Д.К.Черновым было установлено, что процесс кристаллизации состоит из двух элементарных процессов: зарождения центров кристаллизации и роста кристаллов из этих центров.
При температурах, близких к температуре затвердевания, в жидком металле образуются небольшие группировки атомов, так называемые флуктуации, в которых атомы упакованы так же, как в твердых кристаллах. Из части этих флуктуаций образуются зародыши, или центры кристаллизации. С увеличением степени переохлаждения возрастает число центров кристаллизации, образующихся в единицу времени. Вокруг образовавшихся центров кристаллизации начинают расти кристаллы. Одновременно в жидкой фазе образуются новые центры кристаллизации. Увеличение общей массы затвердевшего металла происходит как за счет возникновения новых центров кристаллизации, так и за счет роста существующих. Схема последовательных этапов процесса затвердевания приведена на рис. 2.12.
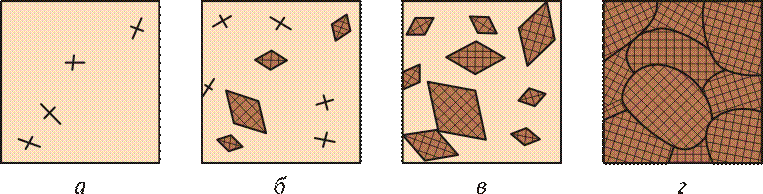 Рис. 2.12.Схема кристаллизации металла:
Рис. 2.12.Схема кристаллизации металла:
а — г — этапы затвердевания металла
Взаимным ростом кристаллов объясняется неправильная форма зерен. Реальные твердые кристаллы неправильной формы называются кристаллитами.
Суммарная скорость кристаллизации зависит от хода обоих элементарных процессов и определяется скоростью зарождения (СЗ) центров кристаллизации и скоростью роста (СР) кристаллов из этих центров (рис. 2.13). Величины СЗ и СР зависят от степени переохлаждения D Т. При равновесной температуре D Т = 0; СЗ = 0; СР = 0. С увеличением D Т растет разность свободных энергий D F = Fж - F тв, где F ж, F тв — свободная энергия жидкого и твердого металла соответственно, и при хорошей подвижности атомов СЗ и СР увеличиваются и достигают максимума. Последующее уменьшение СЗ и СР объясняется снижением подвижности атомов при снижении температуры. При малых значениях коэффициента диффузии затруднена перестройка атомов жидкости в кристаллическую решетку твердого тела. При очень сильном переохлаждении СЗ и СР равны нулю, жидкость не кристаллизуется, а превращается в аморфное тело.
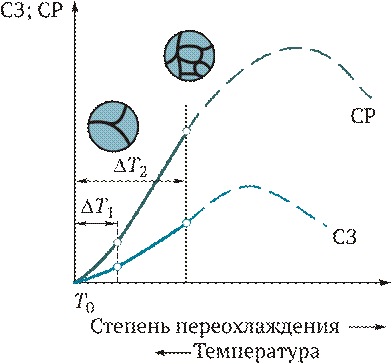 Рис. 2.13.Влияние степени переохлаждения D Т на скорость зарождения (СЗ) и скорость роста (СР) кристаллов:
Рис. 2.13.Влияние степени переохлаждения D Т на скорость зарождения (СЗ) и скорость роста (СР) кристаллов:
Т 0 — равновесная температура
Для реальных металлов, как правило, реализуются лишь восходящие ветви кривых СЗ и СР, и с ростом степени переохлаждения увеличиваются скорости обоих процессов.
Если раньше аморфное состояние достигалось лишь для солей, силикатов, органических веществ, то в настоящее время с использованием специальных приемов достигаются высокая скорость охлаждения (более 106°С/с) и стеклообразное состояние металла. Металлы в стеклообразном состоянии характеризуются особыми физико-механическими свойствами.
От соотношения СЗ и СР зависит размер зерен. При малом переохлаждении, например, при заливке металла в земляную форму с малой теплопроводностью или подогретую металлическую форму, СР — велика, СЗ — мала. В этом случае в объеме образуется небольшое количество крупных кристаллов. При увеличении D Т в случае заливки жидкого металла в холодные металлические формы СЗ возрастает, что приводит к образованию большого количества мелких кристаллов.
Размер зерна определяется не только степенью переохлаждения. Важную роль играют температура нагрева и разливки металла, его химический состав и особенно присутствие посторонних примесей. В реальных условиях самопроизвольное зарождение кристаллов в жидком металле затруднено. Источником образования зародышей служат различные твердые частицы: не<