Лабораторная работа №1
Цель занятия: Вспомнить основные понятия радиологии, рассчитать соотношение протонов и нейтронов радиоактивных рядов.
Радиоактивностью называется способность атомных ядер к самопроизвольному превращению в другие ядра с испусканием одной или нескольких заряженных частиц и фотонов.
Ядра, обладающие свойством самопроизвольно распадаться, называются радиоактивными, а ядра, не имеющие таких свойств, – стабильными. Из более чем 1700 известных в настоящее время нуклидов только 200 стабильны. Большинство радионуклидов получено искусственно.
Все встречающиеся в природе элементы с атомными номерами > 83 (висмут) радиоактивны. Они представляют собой отдельные звенья последовательных превращений – радиоактивные ряды. Существует четыре ряда радиоактивных превращений: три естественных (ряды урана-235, урана-238 (актиноурана, AcU), тория-232) и один искусственный (ряд нептуния).
Характерной особенностью трёх естественных семейств является наличие в ряду превращений газообразных радиоактивных продуктов – изотопов радона. Как видно из схем превращений, в некоторых случаях возможны два пути перехода одного и того же изотопа в два новых элемента с одной и той же скоростью в результате альфа- и бета-распада. Это так называемые «вилки» – одни и те же ядра с разными вероятностями претерпевают различные типы радиоактивного распада. Более вероятен тот процесс, по которому осуществляется превращение большей доли ядер. Обычно на схемах радиоактивных семейств в случае «вилок» под типом распада в скобках обозначена доля (%) превращающихся ядер.
Существуют также радиоактивные элементы, не входящие в ряды. Одним из наиболее важных радиоактивных изотопов, не связанных ядерными превращениями с другими, является калий-40 (Т1/2= 1,3·109; β-, k-захват). Несмотря на низкую активность и малую распространённость изотопа (около 0,0119%), калий-40 играет не менее важную роль в тепловом балансе Земли, чем уран и торий. Элементов сТ1/2<108 лет на Земле не существует: они давно «вымерли». Их следы можно обнаружить по стабильным продуктам распада. Атомное ядро содержит более 99,95% всей массы атома, имеет размеры порядка 10-12–10-13 см.
Атомные ядра состоят из элементарных частиц – протонов и нейтронов, их массы близки между собой. Протон электрически положителен (его заряд равен заряду электрона), нейтрон – электрически нейтрален. Протон и нейтрон, входящие в состав атомного ядра, объединяются под общим названием нуклон.
Общее число нуклонов в ядре называется массовым числом и обозначается через А. Число протонов в ядре называется атомным номером химического элемента (Z, зарядное число). Число нейтронов в ядре обозначается через N.
В нормальном состоянии атом электрически нейтрален. Химические свойства атома определяются особенностями структуры его электронных оболочек и числом электронов.
Тип атомного ядра обозначают:
AZ X,
где А – массовое число;
Z – атомный номер химического элемента;
N – число нейтронов.
Следовательно:
N + Z = A.
Ядра с одним и тем же числом Z, но различным числом А называются изотопами химического элемента с атомным номером Z, например изотопы водорода:
11H (Z =1, N =0) – обычный водород, или протий;
21 H (Z =1, N =1) – тяжёлый водород, или дейтерий;
31 H (Z =1, N =2) – радиоактивный водород, тритий.
Ядра с одинаковыми величинами А, но разным Z называются изобарами.
Пример триады изобаров: аргон 4018 Ar, калий 4019 K, кальций 4020 Ca.
Возбуждённое ядро может находиться в метастабильном состоянии. Это объясняет существование изомеров – ядер с одинаковыми А и Z, но с различным запасом энергии.
Наиболее часто явление ядерной изомерии встречается у искусственно радиоактивных изотопов.
Нуклиды – группы атомов с одинаковыми значениями А и Z. Радиоактивные нуклиды называются радионуклидами.
К числу радиоактивных явлений относят:
· α-распад;
· β-превращение;
· γ-излучение;
· нейтронное излучение;
· протонную и двухпротонную радиоактивность;
· кластерную радиоактивность и др.
Ядерной реакцией называется процесс взаимодействия ядра с другим ядром, элементарной частицей или фотоном, в результате которого образуется одно или несколько новых ядер. Кроме того, ядерная реакция сопровождается излучением фотонов или некоторых элементарных частиц. Первой ядерной реакцией, осуществленной человеком, было превращение азота в кислород (Э. Резерфорд, 1919 г.):
1417N+42 He→178O+11H
Сокращенно эту реакцию можно записать так:
1417N(α, p)178O
Каждый отдельный химический элемент может существовать в виде устойчивых ядерных структур – стабильных протонов. И неустойчивых - радиоактивных изотопов. Устойчивость или стабильность определяется соотношением числа протонов (Р) и нейтронов (n). У стабильных и легких элементов это соотношение равно 1:1 или близко к нему, но к концу периодической системы Менделеева уменьшается и достигает 1:1,6 (у урана). Замечено, что более устойчивы ядра с четным числом n (или хотя бы только Р). Значительная часть радиоактивных ядер имеет нечетное число протонов и нейтронов.
При недостатке или избытке нейронов ядерные структуры оказываются неустойчивыми, что приводит к возможности радиоактивного распада того или иного типа.
Радиоактивный распад происходит самопроизвольно, без какого-либо воздействия извне. Это внутренний ядерный процесс, на который обычные физические или химические факторы (температура, давление, магнитное поле, химические реагенты) воздействовать не могут. Как не могут в какой-то мере задержать или ускорить ход радиоактивных превращений.
Контрольные вопросы:
1. Что такое радиоактивность?
2. Каких нуклидов больше – стабильных или радиоактивных?
3. Что такое радиоактивные ряды? Приведите примеры.
4. Существуют ли радиоактивные элементы, не входящие в ряды?
5. Что такое нуклон?
6. Как схематически обозначают тип атомного ядра?
7. Что такое изотопы, изобары и изомеры?
8. Что такое нуклиды?
9. Что такое ядерная реакция?
Задания:
1. Определите, что изображено на рисунке:
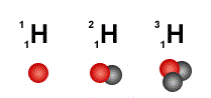
2. Определить число нейтронов и рассчитать соотношение протонов и нейтронов радиоактивных рядов тория и актиния
Пример решения:
Уран 23892U
А=238 – массовое число изотопов (Р+n)
Z=92 – атомный номер элемента
N=А- Z=238-92=146
Р=238-146=92
Соотношение Р:n
92:146
1:1,59
Вариант1 Радиоактивный ряд тория
Вариант 2 Радиоактивный ряд актиния