Тема: Основные понятия и законы химии
Законы химии
Рассмотрим основные стехиометрические (элемент, измерять) законы химии.
Стехиометрия – это учение о массовых и объемных соотношениях между реагирующими веществами.
В основе стехиометрии лежат законы сохранения массы вещества, постоянства состава вещества, закон Авогадро и др.
Закон сохранения массы веществ. Открыт М.В. Ломоносовым (1748 г.) и сформулирован А. Лавуазье (1789 г.).
Общая масса веществ, вступивших в химическую реакцию, равна общей массе веществ, образовавшихся в результате этой реакции.
Закон постоянства состава вещества. Ж. Пруст 1799 г.
Каждое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Например, поваренная соль NaCl может быть получена разными способами, но она всегда состоит из атомов натрия и хлора, при этом массовое соотношение этих элементов всегда будет постоянное.
Именно на основе этого закона мы записываем уравнения химических реакций, указывая для каждого участника реакции строго определенную формулу, и проводим по этим уравнениям расчеты.
Закон Авогадро. Для расчетов объемов газов.
В равных объемах разных газов при одних и тех же условиях содержится одинаковое число молекул.
Следствие 1. При одинаковых условиях 1 моль любого газа занимает один и ото же объем. Этот объем называется молярным (Vm) при нормальных условиях (давление р0 = 101 325 Па, абсолютная температура Т0 = 273 К) равен 22,4 л.
Vm = 22,4 л/моль
Следствие 2. Отношение масс двух разных газов, занимающих одинаковый объем при одинаковых условиях, равно отношению их молярных масс.
Отношение массы газа 1 (m1)к массе газа 2 (m2)при том, что эти газы занимают одинаковый объем при одинаковых условиях, называют относительной плотностью (D) газа 1 по газу 2.
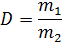
Согласно второму следствию из закона Авогадро получаем:

Где М1и М2 – молярная масса газа 1 и газа 2.
Например: Относительную плотность некоторого газа Х по водороду можно рассчитать по формуле:

(Задача 1).
Для расчета газов также используют уравнение Менделеева-Клапейрона (уравнение состояния идеального газа).
 ,
,
Где р – давление, V – объем газа, m–масса газа, M–молярная масса газа, R–универсальная газовая постоянная (R = 8,314 Дж/(моль*К)),Т – температура, 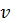 – количество вещества газа (моль).
– количество вещества газа (моль).
Основные классы неорганических соединений
Все неорганические вещества делят на простые (образованны атомами одного химического элемента) и сложные (образованны атомами двух и более элементов). Простые вещества подразделяют на неметаллы и металлы, отдельно выделяют газы.
Сложные вещества подразделяют на ряд классов.К основным относят: оксиды, основания (гидроксиды), фосфиды, нитриды и другие.
Оксиды
Оксиды – это сложные вещества, состоящие из атомов кислорода в степени окисления -2 и какого-либо другого элемента.
Все химические элементы кроме гелия, неона и аргона образуют оксиды.
По химическим свойства оксиды делят на солеобразующие и несолеобразующие.
К несолеобразующим относятся оксиды не взаимодействующие с основаниями и кислотами и не образующие солей (например, N2O, NO, SiO).
Солеобразующие оксиды делят на основные, кислотные и амфотерные.
Основные оксиды.
Это оксиды, которым соответствуют основания. Основными являются оксидыметаллов Iи IIгрупп Периодической системы.
Свойства:
1) оксиды щелочных (Li, Na, K, Rb, Cs, Fr) и щелочноземельных (Ca, Sr, Ba, Ra) металлов при взаимодействии с водой образуют основания, например:
K2O+H2O=2KOH
BaO+H2O=Ba(OH)2
2) основные оксиды взаимодействуют с кислотами, образуя соль и воду
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Кислотныеоксиды
Оксиды, которым соответствуют кислоты. К кислотным относятся оксиды неметаллов и металлов в высших степенях окисления. Например оксиды: N2O3, P2O5,SO3.
Свойства:
1) взаимодействуют с водой с образованием кислот, например:
SO3 + H2O = H2SO4
Mn2O7 + H2O = 2HMnO4
2) реагируют с основаниями (щелочами), образуя соль и воду:
N2O5 + Ca(OH)2 = Ca(NO3)2 + H2O
3) взаимодействуют с основными оксидами, образуя соли:
SiO2 + FeO = FeSiO3
Амфотерные оксиды
Оксиды металлов, которые могут проявлять и основные, и кислотные свойства, то есть реагируют и с кислотами и с основаниями.