Регуляция тканеспецифической экспрессии генов с использованием энхансеров и сайленсеров, а также некоторых других негативных регуляторных процессов часто происходит по механизмам, принципиально отличающимся от ранее рассмотренных. Речь идет о регуляторных эффектах, реализующихся через изменение структуры хроматина.
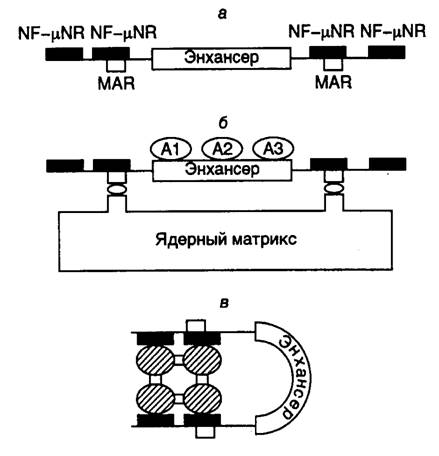
Рис. I.33. Модель негативной регуляции активности интронного энхансера гена тяжелой цепи иммуноглобулина мышей
а – структура фрагмента ДНК в окрестностях энхансера. Обозначены сайты связывания фактора NF-mNR, а также MAR-последовательности; б – активное состояние энхансера, при котором MAR-последовательности ассоциированы с ядерным матриксом, а сам энхансер взаимодействует с активаторами А; в – неактивное состояние энхансера, при котором тетрамер фактора NF-mNR предотвращает взаимодействие MAR-последовательностей с ядерным матриксом и изменяет пространственную структуру энхансера
Интронный энхансер гена тяжелой цепи иммуноглобулина содержит много сайтов связывания для различных тканеспецифических, а также других широко распространенных факторов транскрипции. Максимальная активность энхансера наблюдается в зрелых B-лимфоцитах, где ген претерпевает ряд соматических перестроек. Активность этого энхансера обнаруживается и в некоторых нелимфоидных тканях. Однако в печени или фетальных фибробластах, а также в нескольких других тканях его активность полностью подавлена. Исследования с использованием сайт-специфического мутагенеза показали, что такой энхансер фланкирован негативными регуляторными последовательностями нуклеотидов, которые ингибируют его активность в незрелых B-клетках или клетках других типов, но не обладают аналогичными свойствами в зрелых B-лимфоцитах (рис. I.33, а). Оба этих регуляторных элемента требуются для проявления ингибирующей активности, для которой важно также их положение относительно энхансера. В регуляторных элементах обнаружены сайты связывания транскрипционного фактора NF-mNR, содержание которого особенно велико в клетках, где активность энхансера подавлена. Поскольку фактор NF-mNR способен образовывать тетрамеры, предполагается, что прямое взаимодействие между этими молекулами, ассоциированными с сайтами связывания, фланкирующими энхансер, может приводить к структурной перестройке сегмента ДНК, заключенного между такими сайтами и содержащего энхансер (см. рис. I.33, б,в). Кроме того, регуляторные последовательности, связывающие NF-mNR, содержат MAR-сайты, взаимодействующие с ядерным матриксом, и последовательности, с которыми контактирует ДНК-топоизомераза II, что еще раз указывает на необходимость структурных перестроек ДНК в процессе изменения ее регуляторных функций.
В рассматриваемом случае механизм негативной регуляции активности энхансера можно представить в следующем виде. В клетках, где отсутствует фактор транскрипции NF-mNR (зрелые B-лимфоциты), последовательности MAR, которые фланкируют энхансер, ассоциированы с ядерным матриксом, что сопровождается формированием пространственной структуры энхансера, открытой для взаимодействия с активаторами транскрипции (см. рис. I.33,б). Это приводит к эффективной транскрипции всего гена иммуноглобулина. В клетках же, где фактор NF-mNR присутствует в больших количествах, фрагмент ДНК с энхансером не ассоциирован с ядерным матриксом, так как MAR-сайты блокированы фактором (см. рис. I.33,в). Энхансер приобретает закрытую для позитивных регуляторных факторов конформацию, что сопровождается подавлением транскрипции регулируемого им гена. Рассмотренный пример иллюстрирует один из частных случаев изменения пространственной структуры ДНК и хроматина, а также уровня транскрибируемости ДНК под действием коротких последовательностей нуклеотидов, фланкирующих регулируемый генетический локус. Подобный принцип широко используется для регуляции экспрессии генов у эукариот. Другие примеры этого впечатляющего явления в обобщенном виде будут рассмотрены ниже.
Эффект положения и концепция пограничных последовательностей: инсуляторы. Давно известно, что перенос гена или группы генов в гетерохроматиновые (неактивные в отношении транскрипции) участки хромосом часто сопровождается ослаблением или прекращением его экспрессии (так называемый эффект положения), и, наоборот, некоторые гены после переноса сохраняют свою активность и в гетерохроматиновом окружении. Подавление экспрессии таких транслоцированных генов может быть полным при стабильном эффекте положения и варьировать в зависимости от типа соматических клеток, в которых находится хромосома с транслокациями. Поскольку в последнем случае в организме образуются клоны соматических клеток, с разной эффективностью экспрессирующих транслоцированные гены (вплоть до полного подавления их транскрипции), такой эффект положения называют эффектом положения мозаичного типа (position effect variegation – PEV). Дальнейшее подтверждение существования эффекта положения получено с развитием методов трансгеноза – введения чужеродных рекомбинантных генов в геном клеток зародышевой линии высших организмов.
Исследование этого явления привело к открытию так называемых пограничных последовательностей нуклеотидов (boundaries), фланкирующих функционально активные домены хроматина. Оказалось, что существуют определенные последовательности нуклеотидов длиной в несколько сотен пар оснований, которые обладают способностью подавлять позитивное и негативное влияние эухроматина и гетерохроматина на экспрессию трансгенов, интегрированных в этот хроматин и фланкированных указанными последовательностями в новом сайте интеграции. Фактически такие участки ДНК как бы изолируют ген, находящийся между ними, способствуя сохранению его обычной пространственной структуры, которая может отличаться от структуры окружающего хроматина. Эти последовательности известны кроме того под названием инсуляторов (англ. insulate – изолировать), а также как регуляторные области локусов (locus control regions – LCR). К таким пограничным последовательностям относятся, например A-элементы, фланкирующие ген лизоцима цыплят, scs-элементы (specialized chromatin structure elements), окружающие ген hsp70 Drosophila melanogaster, а также последовательности нуклеотидов, разделяющие регуляторные элементы iab комплекса Bithorax того же объекта. Введение одного из таких элементов между энхансером и промотором регулируемого гена приводит к функциональной изоляции энхансера и подавлению экспрессии гена, а фланкирование гена пограничными последовательностями предохраняет его от инактивирующего действия окружающего конденсированного гетерохроматина, т.е. снимает эффект положения. При подавлении активности энхансеров инсуляторами ярко проявляется еще одно их свойство – полярность действия. Инсуляторы однонаправленно выключают энхансеры, расположенные дистально (на значительном расстоянии) по отношении к регулируемому промотору, но не рядом с ним (подробнее см. ниже). В дополнение к этим функциональным свойствам инсуляторов показано, что они могут разделять два участка хроматина, резко различающиеся по пространственной структуре. В этом случае по одной стороне от пограничной последовательности располагается сильно компактизованный хроматин, ДНК которого недоступна действию нуклеаз, а по другой – хроматин в открытой конформации, характерной для компетентных в отношении транскрипции генов.
Способность последовательностей нуклеотидов ДНК выполнять функции инсуляторов обычно определяют в функциональных генетических тестах по их способности обеспечивать экспрессию генов, искусственно интегрированных в хромосому (трансгенов), независимо от локализации сайта интеграции. В качестве гена-репортера при определении активности инсуляторов часто используют ген white дрозофилы, поскольку изменение уровня его экспрессии сопровождается легко измеряемым изменением окраски глаз у трансгенных мух, которая может меняться от красного, свойственного организмам дикого типа, до желтого и, наконец, белого, встречающегося у так называемых нуль-мутантов, для которых характерно полное подавление экспрессии мутантного гена. В такого рода исследованиях была обнаружена высокая эволюционная консервативность инсуляторов и регуляторных белков, взаимодействующих с ними. В частности, LCR-последовательности b-глобинового гена цыплят эффективно функционируют в этой системе в качестве инсуляторов. Одной из наиболее хорошо изученных последовательностей нуклеотидов, обладающей свойствами инсулятора, является транскрибируемый нетранслируемый участок ДНК ретротранспозона gypsy у дрозофилы, содержащий сайты связывания белка-супрессора Hairy-wing (su(Hw)), свойства которого будут подробнее рассмотрены ниже.
До настоящего времени окончательно не разрешен вопрос о способности MAR/SAR-последовательностей, разделяющих функциональные домены хроматина, выполнять функции пограничных последовательностей. Хотя показано, что некоторые SAR-последовательности не способны подавлять эффект положения, для других аналогичных последовательностей такая способность была продемонстрирована. Например, свойствами инсуляторов обладают соответствующие последовательности уже упомянутого выше гена тяжелой цепи иммуноглобулина, а также генов лизоцима цыплят, b-интерферона и аполипопротеина B человека. В последнем случае сайты прикрепления ДНК к ядерным мембранам расположены за 5 т.п.о перед точкой инициации транскрипции и на 43 т.п.о. ниже этой точки, на границах между конденсированной и открытой формами хроматина. Последовательности, располагающиеся в этих участках хроматина, обладают повышенной чувствительностью к ДНКазе I и обеспечивают правильную экспрессию интегрированного в хромосомы гена-репортера в клетках-трансфектантах гепатомы, вызывая 200-кратную стимуляцию его транскрипции, не зависимую от локализации места интеграции. Все это указывает на то, что данные 3’- и 5’-концевые MAR APOB -локуса человека обладают всеми свойствами пограничных последовательностей. Функционирование SAR-последовательностей в качестве инсуляторов в ряде случаев не является конститутивным, но зависит от типа клеток и стадии развития организма. Например, SAR-последовательности гена b-интерферона человека, фланкирующие мышиный ген теплового шока HSP70.1, функционируют как инсуляторы в клетках эмбрионов мышей на стадии предимплантации, но не в дифференцирующихся тканях новорожденных и взрослых трансгенных мышей. На такого рода наблюдениях основано заключение, что топологические домены хромосом, выделяемые MAR/SAR-последовательностями, не являются статическими образованиями, но могут изменяться в процессе индивидуального развития организма, что, в свою очередь, сопровождается изменением характера экспрессии больших блоков генов в дифференцирующихся клетках.
Структурно-функциональный анализ инсуляторов в вышеупомянутой системе с геном white показал, что последовательности участков инсуляторов, гиперчувствительных к ДНКазе I, необходимы для их функционирования, тогда как центральная А/T-богатая область, устойчивая к действию нуклеазы, для этого не требуется. Удаление части последовательностей из гиперчувствительных сайтов сопровождается понижением активности инсуляторов, тогда как простое увеличение числа копий последовательностей восстанавливает их активность. На этом основании делается вывод, что активность пограничных последовательностей может обеспечиваться определенным критическим количеством молекул связавшихся с ними белков, неспецифичных в отношении типа инсулятора, которые могут действовать на энхансеры либо непосредственно, либо через изменение структуры хроматина.
Природа белкового компонента, взаимодействующего с пограничными последовательностями, была определена в случае типичного инсулятора: scs’-последовательности гена теплового шока дрозофилы. Из ядер культивируемых клеток был выделен белок BEAF-32 (boundary element associated factor) с молекулярной массой 32 кДа, который взаимодействует с палиндромной последовательностью, фланкирующей два гиперчувствительных к ДНКазе участка в scs’. С помощью иммунохимических методов локализовали множественные высокоспецифические места связывания BEAF-32 на политенных хромосомах с одной из сторон пуффов, образующихся на определенных стадиях развития личинок мух, что подчеркивает двухкомпонентный состав последовательностей нуклеотидов инсуляторов. Хотя белки, связывающиеся с противоположной частью этой пограничной последовательности, еще не идентифицированы, предполагают, что белки двух частей инсулятора взаимодействуют друг с другом. Полагают также, что такого рода связывание белков, ассоциированных с различными инсуляторами, может быть одним из необходимых условий формирования большого числа разнообразных функционально активных доменов хромосом, что, в свою очередь, может обеспечивать специфическую экспрессию заключенных в них генов на разных стадиях онтогенетического развития организма.
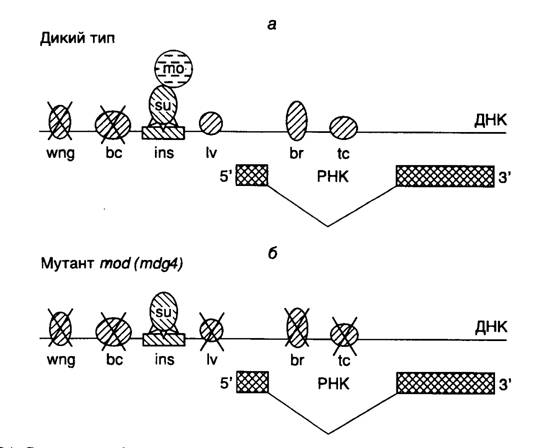
Рис. I.34. Структура и функционирование инсулятора ретротранспозона gypsy дрозофилы
а – последовательность инсулятора (ins), представленная 12 копиями сайта связывания белка su(Hw) (su), взаимодействующего с белком mod(mdg4) (mo). Комплекс этих белков, связанных с инсулятором, однонаправленно подавляет активность энхансеров (перечеркнутые заштрихованные эллипсы) гена yellow в соответствующих тканях; б – инактивация белка mod(mdg4) под действием мутации разрушает белковый комплекс su–mo, и подавление транскрипции под действием инсулятора становится неспецифическим (двунаправленным).
Обозначения тканей дрозофилы: wng – крылья, bc – катикула тела, lv – ткани личинки, tc – тарзальные коготки, br – щетинки
Вышеупомянутый инсулятор ретротранспозона gypsy содержит 12 сайтов связывания белка su(Hw). Коровая последовательность этих сайтов гомологична октамерной последовательности, обнаруженной в различных энхансерах и промоторах позвоночных. Эта последовательность фланкирована AT-богатыми участками, которые способствуют изгибанию молекулы ДНК, требуемому для правильных ДНК-белковых взаимодействий в этом участке генома. Полипептидная цепь белка su(Hw) содержит 12 доменов типа "цинковые пальцы", необходимых для его связывания с ДНК и функционирования инсулятора. Кроме того, белок su(Hw) обладает двумя кислыми доменами, локализованными вблизи его С-конца, которые обеспечивают его взаимодействие с энхансерами и нужны для подавления эффекта положения. Абсолютно необходимым для функционирования инсуляторов является и a-спиральный участок полипептидной цепи этого белка, гомологичный второму спиральному участку (helix-coiled coil) основных факторов транскрипции группы HLH-bzip, содержащему домен типа "лейциновая застежка". Поскольку такой домен обычно требуется для осуществления белок-белковых взаимодействий, полагают, что для функционирования этого инсулятора кроме белка su(Hw) необходимы и другие белки.
С помощью классического генетического анализа был идентифицирован второй компонент инсулятора su(Hw). Мутации в гене modifier of mdg4 (mod(mdg4)) ингибировали полярное действие инсулятора на энхансеры (рис. I.34, а) и усиливали мозаичный эффект положения для генов, транслоцированных в гетерохроматин. У таких мутантов действие инсулятора на подавление активности энхансеров было двунаправленным и не зависело от расстояния между энхансерами и промотором (см. рис. I.34, б). Ген mod(mdg4) кодирует, по крайней мере, три белка, которые возникают в результате альтернативного сплайсинга и содержат BTB-домен, характерный для многих факторов транскрипции, например уже упоминаемого GAGA-фактора, осуществляющего свое действие через изменение структуры хроматина. Полагают, что двунаправленное подавление функций энхансеров инсулятором gypsy в отсутствие функционально активного белка mod(mdg4) являются следствием гетерохроматизации последовательностей, окружающих инсулятор. В этой связи подавление активности энхансеров у мутантов mod(mdg4) может происходить из-за изменений в нуклеосомной структуре данных участков ДНК. Поскольку для развития эффекта требуется наличие нативных доменов типа "лейциновая застежка" и кислых доменов белка su(Hw), предполагают, что процесс гетерохроматизации ДНК в отсутствие функционального белка mod(mdg4) является следствием взаимодействия белка su(Hw) с другими белками. Ингибирующее действие инсулятора ретротранспозона gypsy может распространяться на энхансеры, находящиеся по отношению к нему в транс- положении, т.е. на гомологичной хромосоме.
Дальнейшим указанием на то, что действие пограничных последовательностей на соответствующие гены осуществляется через изменение структуры хроматина, было получено при исследовании их влияния на дозовую компенсацию у дрозофилы. Для экспрессии генов, расположенных на X-хромосоме самцов и самок этого организма, характерен одинаковый уровень, хотя содержание (доза) таких генов у самок в два раза выше, чем у самцов. Это равновесие достигается за счет механизма, повышающего вдвое скорость транскрипции сцепленных с X-хромосомой генов у самцов и получившего название дозовой компенсации. На X-хромосоме самцов происходит сборка мультимерных белковых комплексов (так называемых летальных комплексов), которые изменяют нуклеосомную структуру хромосомы за счет ацетилирования остатков Lys-16 гистона H4. Способность к дозовой компенсации полностью отсутствует у локусов X-хромосомы, перенесенных на аутосомы, т.е. последние подавляют этот эффект. Однако если трансген фланкирован пограничными последовательностями ретротранспозона gypsy, то у 90% трансгенов, интегрированных в аутосомы, происходит правильная дозовая компенсация. Механизм этого явления пока непонятен. Предполагают, что изменение структуры хроматина в трансгене под действием инсуляторов делает возможным сборку на нем летального комплекса или может препятствовать доступу деацетилаз к гистонам нуклеосом.
Результаты исследований белков BEAF-32, su(Hw) и mod(mdg4) указывают на то, что инсуляторы и пограничные последовательности формируют мультибелковые комплексы, регулирующие экспрессию генов через изменение структуры соседнего с ними хроматина. Такие изменения конформации хроматина могут оказывать влияние на взаимодействия между энхансерами и промоторами генов, не изменяя функциональной активности энхансеров как таковых. При этом изменения структуры хроматина, вызываемые инсуляторами, не препятствуют элонгации РНК РНК-полимеразами.
В настоящее время идентифицированы и другие хромосомные белки, обеспечивающие инактивацию генов через конденсацию хроматина, которые, кроме того, необходимы для поддержания хроматина и целых хромосом в конденсированном неактивном состоянии. К таким белкам, в частности, относится белок гетерохроматина 1 (HP-1) дрозофилы, ассоциированный с b-гетерохроматином. Мутации в гене, кодирующем белок HP-1, являются супрессорными, подавляющими мозаичный эффект положения (PEV). В то же время дупликация этого локуса усиливает PEV, что указывает на зависимость упаковки гетерохроматина, инактивирующей гены, от внутриклеточной концентрации белка HP-1. Для такого белка характерна высокая эволюционная консервативность, и его гомологи обнаружены у мышей, человека и растений. Использование переходов конденсации–деконденсации хроматина для регуляции экспрессии как отдельных генов, так и их громадных массивов, по-видимому, является прерогативой эукариот. Еще одним ярким примером такого рода служит инактивация одной из X-хромосом самок млекопитающих в раннем эмбриогенезе.
Инактивация X-хромосом. Поскольку соматические клетки самок млекопитающих содержат две половые X-хромосомы, а самцов – только одну, у самок возникает необходимость в компенсации двойной дозы генов, сцепленных с этими хромосомами. Такая проблема решается путем инактивации одной из X-хромосом, являющейся следствием перевода ее хроматина в высококонденсированное состояние с подавленной транскрипцией. Хотя в большинстве случаев в разных клетках одного и того же животного случайным образом инактивируется или материнская, или отцовская X-хромосома, имеются специальные случаи, когда во всех клетках только отцовская хромосома становится транскрипционно неактивной. Последний случай, получивший название "импринтный тип инактивации X-хромосомы", характерен для сумчатых животных и обнаружен в некоторых клетках эмбрионов мышей. (Более подробно о генетическом импринтинге см. раздел 3.2.5.)
Лучше всего молекулярные механизмы инактивации X-хромосомы изучены у человека, мышей и сумчатых животных. В ранних эмбрионах мышей и человека обе X-хромосомы активны. У мышей инактивация X-хромосомы впервые обнаруживается в ранних эмбрионах на стадии бластоцисты, когда для всех внеэмбриональных клеток характерен импринтный тип инактивации только отцовских X-хромосом. Позднее, через 6 дней эмбрионального развития во всех клетках зародыша материнские и отцовские X-хромосомы инактивируются случайным образом. Неактивное состояние хромосом высокостабильно, и их реактивация (повторная активация) имеет место лишь у самок в клетках зародышевой линии. В клетках зародышевой линии самцов единственная X-хромосома инактивируется в раннем сперматогенезе.
Свойства инактивированных X-хромосом. Все инактивированные X-хромосомы обладают некоторыми общими свойствами. Их ДНК реплицируется в поздней S-фазе клеточного цикла, а в интерфазе они присутствуют в высококонденсированном состоянии в виде так называемых телец полового хроматина (sex chromatin bodies). Все это происходит на фоне низкого уровня ацетилирования гистонов и появления нового гистона macro H2A1, что указывает на возможные изменения структуры нуклеосом. В эмбриональных соматических клетках (но не в клетках зародышевой линии) плацентарных млекопитающих метилированы CpG-островки генов инактивированной X-хромосомы, в отличие от CpG-островков остальной части генома. Неметилированными остаются и CpG-островки инактивированных X-хромосом сумчатых животных. Большая часть вышеперечисленных свойств инактивированных X-хромосом присуща и обычному гетерохроматину. Поэтому процесс инактивации рассматривают как гетерохроматизацию X-хромосом.
У редко встречающихся индивидуумов с ненормальным числом X-хромосом – X0, XX, XXY и т.п. независимо от их числа – по-прежнему инактивированной остается только одна половая хромосома. В отличие от этого, в клетках триплоидных организмов, содержащих по три набора хромосом, инактивируется или одна, или две X-хромосомы, а у тетраплоидов – две. Такого рода данные указывают на существование механизма, поддерживающего в активном состоянии одну X-хромосому на каждые два набора аутосом. Таким образом, перед инактивацией в эмбриональных клетках происходит определение числа наборов аутосом, выбор X-хромосом, остающихся активными, и инициация инактивации остальных X-хромосом.
Инициация инактивации X-хромосом. Процесс инактивации X-хромосом начинается на определенном участке, получившем название центра инактивации X-хромосомы (X-inactivation center). В этом участке был картирован ген Xist (X inactive specific transcript), который впоследствии был клонирован. Сегменты X-хромосомы, у которых центр инактивации удален в результате делеций или транслокаций, не подвергаются инактивации. С помощью генного нокаута Xist было установлено, что для инактивации X-хромосом требуется его транскрипция. Введение гена Xist с помощью трансгеноза в аутосомы было достаточным для инициации инактивации последних.
Ген Xist как основной регулятор инактивации X-хромосом. С помощью генного нокаута удалось показать, что за определение внутриклеточного числа X-хромосом (counting) и инициацию их инактивации отвечают разные участки гена Xist. 5'-Концевая часть гена необходима для инициации инактивации, а его 3'-концевая зона участвует в счете хромосом, в результате которого определяется, какая хромосома остается активной. X-Хромосомы с поврежденной 3'-концевой частью гена Xist всегда инактивируются. В этой серии экспериментов было также установлено, что ген Xist требуется как для случайной инактивации хромосом, так и для инактивации импринтного типа, однако его участие, возможно, не требуется для инактивации X-хромосом в мужских зародышевых клетках. В связи с тем, что на активных X-хромосомах ген Xist сильно метилирован, полагают, что его метилированное состояние сопровождается репрессией гена, препятствующей инактивации X-хромосом.
Удивительным свойством гена Xist является то, что он не кодирует белки. В результате экспрессии гена образуется большая РНК, длина которой составляет 15–17 т.о. После окончания синтеза РНК остается в ядре, а в клетках, где X-хромосома уже инактивирована, эта РНК создает "оболочку" вокруг неактивной хромосомы. В недифференцированных эмбриональных стволовых клетках, где обе X-хромосомы активны, зоны экспрессии гена Xist выявляются с помощью гибридизации in situ в виде отдельной точки на каждой хромосоме на фоне общего низкого содержания Xist-РНК. Во время дифференцировки клеток зона содержания Xist-РНК расширяется вдоль будущей неактивной хромосомы на фоне увеличения ее количества. Одновременно резко уменьшается уровень экспрессии гена Xist на хромосоме, остающейся активной.
Повышение внутриклеточного уровня Xist-РНК происходит не за счет стимуляции транскрипции гена, но вследствие стабилизации самих молекул РНК. При этом стабильная и нестабильная РНК транскрибируются с разных промоторов одного и того же гена. И стабилизация, и хромосомная локализация Xist-РНК являются необходимыми, но не достаточными условиями инактивации X-хромосомы. В ранних эмбрионах мышей на стадии предимплантации отцовские X-хромосомы покрыты оболочкой Xist-РНК, однако остаются в активном состоянии. Это указывает на участие дополнительных факторов в эмбриональной инактивации X-хромосом, которые отсутствуют в клетках ранних эмбрионов.
Установление и поддержание неактивного состояния X-хромосом. Механизм распространения зоны неактивного хроматина вдоль X-хромосом от центра инактивации пока остается непонятным. В аутосомах, содержащих транслоцированный центр инактивации или интегрированный трансген Xist, инактивация распространяется в обе стороны на многие миллионы пар оснований. Однако в этом случае гетерохроматизация хроматина происходит менее эффективно и по-разному на индивидуальных хромосомах. При этом некоторые гены аутосом остаются в активном состоянии. Полагают, что для X-хромосом характерно наличие специфических последовательностей, необходимых для их эффективной гетерохроматизации при инактивации, которые отсутствуют в аутосомах.
Некоторые гены инактивированных X-хромосом продолжают функционировать. Часть из них имеет гомологов на Y-хромосоме и поэтому не требует дозовой компенсации. В ряде случаев их активированное состояние является следствием реактивации предварительно инактивированного хроматина. Однако для большинства таких генов механизм поддержания в активном состоянии на фоне молчащего генетического окружения остается неизвестным.
Ген Xist транскрибируется в клетках всех женских особей в присутствии метилированных CpG-островков генов инактивированных X-хромосом. В культивируемых клетках деметилирующие агенты вызывают частичную реактивацию молчащих генов на этих хромосомах. Не исключено, что кроме этих механизмов инактивированное состояние X-хромосом поддерживает и поздняя репликация их ДНК. У сумчатых животных имеет место поздняя репликация, однако не наблюдается дифференциального метилирования CpG-островков, и у них инактивированное состояние X-хромосом менее стабильно, чем у плацентарных млекопитающих. В последнем случае даже прекращение транскрипции гена Xist не сопровождается реактивацией молчащих X-хромосом, однако на фоне слабого метилирования такая реактивация иногда происходит. Таким образом, поддержание инактивированного состояния X-хромосомы является сложным многоуровневым процессом.
Импринтная инактивация только отцовских X-хромосом рассматривается как эволюционно более примитивная форма дозовой компенсации у животных. Действительно, в этом случае повышается вероятность вредного воздействия на организм мутантных материнских генов, локализованных на X-хромосоме. Такая вероятность должна быть меньше при случайной инактивации в разных клетках отцовских и материнских хромосом. Наличие молекулярных механизмов, регулирующих экспрессию генов через дозовую компенсацию, позволило высказать предположение, что эволюционный обмен генами между аутосомами и половыми хромосомами является вредным для биологического вида, так как может приводить к регуляторному дисбалансу экспрессии транслоцированных генов. Был сформулирован так называемый закон Оно, в соответствии с которым гены, сцепленные с X-хромосомой у одного вида млекопитающих, должны оставаться сцепленными с X-хромосомой и у всех остальных.
Аналогично тому, что было показано на примере X-хромосомы сумчатых млекопитающих, при делении во время митоза дочерние клетки могут наследовать от родительских не только прямую генетическую информацию в виде новой копии всех генов, но и определенный уровень их активности (в данном примере – активное или неактивное состояния). Такой тип наследования генетической информации получил название эпигенетического наследования. Современная эпигенетика изучает наследуемые особенности (паттерны) экспрессии генов, вызываемые потенциально обратимыми изменениями структуры хроматина и(или) метилирования ДНК, не сопровождаемые изменениями ее первичной структуры.
Импринтинг
Другим характерным примером регуляции экспрессии генов, приводящей к эпигенетическому наследованию признаков, является уже упомянутый выше импринтинг, при котором специфический характер дифференциальной активности генов определяется полом организма, от которого эти гены унаследованы. В частности, у некоторых насекомых, например грибных комариков (Sciaridae), весь набор отцовских хромосом элиминируется во время сперматогенеза. У этих организмов отцовские хромосомы маркируются в цитоплазме клеток зародышевой линии, удаляются при созревании гамет и не передают свои гены следующему поколению. У млекопитающих и высших цветковых растений отцовские и материнские гены оказывают разный эффект на развитие эмбриона, но в одинаковой степени представлены в гаметах, образующихся в результате мейоза. В этом случае вклады отцовского и материнского геномов в развитие организмов не эквивалентны и происходит видимое искажение менделевских правил наследования некоторых признаков. Иными словами, характер экспрессии отцовского и материнского аллелей одного и того же гена в организме-потомке может быть различным, так как зависит от их происхождения. Молекулярные механизмы этого явления в настоящее время до конца непонятны. Предполагается, что в развитие феномена импринтинга вносят вклад зависимые от пола модификации ДНК определенных генов, в частности метилирование их регуляторных участков.