| Класс рецепторов | Четвертичная структура | Система переноса сигнала | Лиганд |
| 1. Олигомеры, окружающие каналы: а) активируемые снаружи; б) активируемые изнутри | Гетеромеры / гомомеры | Ионные каналы, регулируемые медиаторами | а) g-аминомасляная кислота, Gly, ацетилхолин и т.п. б) cGMP, cAMP, ATP, ионы Ca2+ и т.п. |
| 2. Полипептиды с семью гидрофобными доменами. Суперсемейства: I. Основное суперсемейство II. Рецепторы секретина, VIP, паратиреоидного гормона и кальцитонина III. Рецепторы глутамата | Мономеры / гомодимеры /, посттрансляционно образующиеся гетеродимеры | Через G-белки: а) вместе с диффундируемым переносчиком; б) непосредственно действуют на каналы в) после расщепления пептидным гормоном, действующим как сайт-специфическая протеиназа с образованием самоактивирующегося рецептора | а) низкомолекулярные медиаторы (кроме Gly): нейропептиды, одоранты, цитокины (IL-8), липиды и подобные агонисты (PAF, эйкозаноиды) б) атриальные мускариновые, нейроновые, a1-адренергические лиганды в) тромбин |
Таблица I.12 (окончание)
| Класс рецепторов | Четвертичная структура | Система переноса сигнала | Лиганд |
| 3. Полипептиды с одним гидрофобным доменом: I. Содержащие одну трансмембранную ТМ-последовательность II. Не содержащие ТМ-последовательность, но обладающие якорной последовательностью для закрепления в мембране | Мономеры / гомодимеры /, гетеродимеры, образующиеся посттрансляционно / нативные гетеродимеры / гетеротримеры | С помощью лигандсвязывающей субъединицы, являющейся: а) тирозиновой киназой, стимулируемой лигандами б) гуанилатциклазой, стимулируемой лигандами в) с неизвестной ферментативной активностью | Полипептиды: а) митогенные факторы роста, инсулин б) натрийуретические пептиды в) нейротрофины, гормон роста, пролактин и цитокины |
Как было упомянуто выше, внеклеточные сигналы, воспринимаемые рецепторами на поверхности клеток, запускают цепь внутриклеточных биохимических реакций, опосредуемых вторичными мессенджерами, в которые вовлекаются десятки и даже сотни внутриклеточных белков. Для организации адекватного координированного ответа на конкретный внеклеточный сигнал эукариотическая клетка использует две основные стратегии. В соответствии с одной из них происходит изменение активности предсуществующих белков (ферментов, белков цитоскелета, ионных каналов и т.п.) как следствие аллостерических воздействий или в результате ковалентных модификаций (фосфорилирование протеинкиназами или дефосфорилирование). Индуцированные таким образом новые активности белков, в свою очередь, вызывают ответ клетки, основанный на второй стратегии – изменении уровней экспрессии конкретных генов. В результате реализации второй стратегии в клетках меняются число молекул конкретных белков и их качественный состав.
Циклический AMP в роли вторичного мессенджера. В ряде хорошо изученных случаев внеклеточные лиганды после взаимодействия с рецепторами индуцируют образование вторичных мессенджеров через участие GTP-связывающих и GTP-гидролизующих гетеродимерных белков, названных G-белками. Во всех этих системах имеет место последовательность реакций, отображенная на рис. I.23, а. Внеклеточный лиганд специфически распознается трансмембранным рецептором, который, в свою очередь, активирует соответствующий G-белок, локализованный на цитоплазматической поверхности мембраны. Активированный G-белок изменяет активность эффектора (обычно фермента или белка ионного канала, в рассматриваемом случае – аденилатциклазы), который повышает внутриклеточную концентрацию вторичного мессенджера (в нашем примере – cAMP). Каждый вид рецептора взаимодействует только с определенным представителем семейства G-белков, а каждый G-белок – со специфическим классом эффекторных молекул. Таким образом, в одном конкретном случае гормон или нейромедиатор, реагируя со своим рецептором, вызывает активацию GS-белка, стимулирующего аденилатциклазу. Этот фермент-эффектор превращает внутриклеточный ATP в cAMP – классический вторичный мессенджер. Внутриклеточный уровень cAMP может специфически понижаться под действием фосфодиэстеразы, которая превращает cAMP в 5’-AMP.
cAMP активирует множество cAMP-зависимых протеинкиназ, каждая из которых фосфорилирует определенные белки-субстраты. В большинстве клеток животных присутствуют, по крайней мере, две хорошо охарактеризованные cAMP-зависимые протеинкиназы, фосфорилирующие белки-мишени по остаткам Ser и Thr (серин/треониновые A-киназы). Обе A-киназы представляют собой тетрамеры, состоящие из регуляторного (R) и каталитического (C) димеров полипептидных цепей. R-Димер является мишенью для cAMP, с которым он взаимодействует. Это сопровождается диссоциацией комплекса и освобождением C-цепей, обладающих протеинкиназной активностью. Образующиеся полипептиды, свободно диффундируя в цитоплазме, попадают в ядро, где могут фосфорилировать подходящие белки-мишени, в том числе, факторы транскрипции, что сопровождается их активацией и индукцией транскрипции соответствующих генов. Внутриядерными мишенями киназы A являются, в частности, факторы транскрипции CREB, CREMτ, AP2, SRF, Sp1, участвующие в контроле большого числа клеточных функций, включая пролиферацию и дифференцировку клеток, метаболизм гликогена, регуляцию ионных каналов и т.д.
Каким же образом такой простой механизм обеспечивает избирательность регуляторных воздействий cAMP? Специфичность обеспечивается наличием в клетках определенных типов только им присущих тканеспецифических белков, являющихся субстратами для A-киназ. Например, клетки печени обогащены фосфорилазой-киназой и гликогенсинтазой, активность которых регулируется избирательным фосфорилированием их по cAMP-зависимому механизму, что сопровождается накоплением или освобождением углеводов в гепатоцитах. Адипоциты обогащены липазой, фосфорилирование которой по тому же механизму приводит к освобождению этими клетками свободных жирных кислот. Точно также в клетках других типов, запрограммированных на определенные тканеспецифические функции, содержатся специфические наборы ферментов, активность которых регулируется через их cAMP-зависимое фосфорилирование.
При понижении концентрации гормонов во внеклеточной среде и уменьшении уровня гормонального воздействия на рецепторы внутриклеточное содержание сАМР быстро уменьшается, так как фосфодиэстераза сразу же превращает сАМР в 5’-AMP. Одновременно происходит дефосфорилирование белков-мишеней A-киназ под действием фосфатаз. Активность некоторых фосфатаз также регулируется по cAMP-зависимому механизму. Кроме того, большинство клеток синтезирует белок, названный ингибитором протеинкиназы (PKI), который блокирует активность C-субъединиц A-киназы. Это сопровождается инактивацией соответствующих факторов транскрипции и подавлением экспрессии регулируемых ими генов.
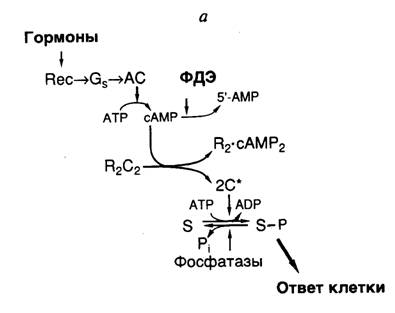
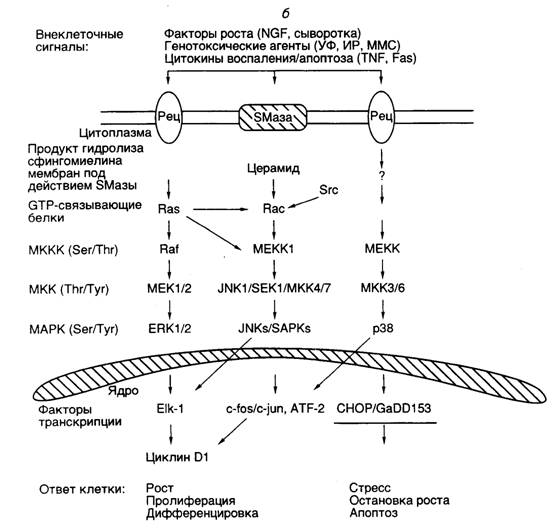
Рис. I.23. Механизмы передачи сигнала с участием cAMP в качестве вторичного мессенджера (а) и протеинкиназ, активируемых митогенами (MAPK) (б), а также регуляции клеточного цикла (в)
а: Rec – рецепторы, Gs – G-белок, AC – аденилатциклаза, ФДЭ – фосфодиэстераза, R и C – соответственно регуляторная и каталитическая субъединицы протеинкиназы, S и S–P – белок-субстрат протеинкиназы и его фосфорилированная форма соответственно 2С* – освобожденный димер каталитической субъединицы А-киназы, Pi – неорганический ортофосфат
б: УФ – ультрафиолетовый свет, ИР – ионизирующая радиация, MMS – метилметансульфонат, SMаза – сфингомиелиназа, MAPKK – киназы, фосфорилирующие MAPK, MAPKKK – киназы, фосфорилирующие MAPKK
в: Образование специфических комплексов циклин–CDK обеспечивает прохождение клетки через соответствующие фазы клеточного цикла. Отмечены места действия белков-ингибиторов клеточного цикла
Передача сигнала с участием протеинкиназ, активируемых митогенами (MAPK). Протеинкиназы, активируемые митогенами (MAPK – mitogen activated protein kinases), играют исключительно важную роль в регуляции экспрессии генов при всех основных проявлениях жизнедеятельности клеток: их пролиферации и дифференцировке, а также задержке роста и апоптозе в ответ на стрессовые воздействия окружающей среды. После получения внеклеточных сигналов в виде митогенного или генотоксического (мутагенного) воздействия, а также в ответ на действие цитокинов, вызывающих реакции воспаления или апоптоз, в клетках начинают развиваться каскады реакций фосфорилирования, завершающиеся специфической активацией или подавлением активности факторов транскрипции или других регуляторных белков, что сопровождается изменением уровней экспрессии соответствующих генов (см. рис. I.23, б). MAPK-каскады реакций фосфорилирования протеинкиназ и других регуляторных белков обеспечивают пошаговое декодирование первичных эффекторных сигналов путем их передачи от поверхности клеток к ядру или другим внутриклеточным компонентам, завершающееся кооперативными ответами клеток организма.
По крайней мере, 11 известных MAPK животных осуществляют регуляторное фосфорилирование ядерных факторов транскрипции, белков цитоскелета клетки и белков-участников передачи сигнала на последних этапах этого процесса. К членам семейства MAPK относятся: 1) киназы, регулируемые внеклеточными сигналами, ERK1 и 2 (extracellular signal-regulated kinases); 2) киназы N-концевой части фактора транскрипции Jun и протеинкиназы, активируемые стрессом JNK/SAPK α, β и γ (NH2-terminal Jun kinase/stress-activated protein kinases); а также 3) группа MAPK p38, состоящая из четырех белков α, β, γ и δ (см. рис. I.23,б). MAPK этих групп специфически распознаются и фосфорилируются протеинкиназами 1) MEK1 и 2, известными также под аббревиатурой MKK1 и 2; 2) JNKK1, SEK1, а также MKK4 и 7; 3) MKK3 и 6. Полипептидные цепи MAPK и их киназ MKK обладают высокой гомологией, что указывает на возможное происхождение генов всего каскада через дупликацию генов модуля MAPK.
Активация MAPK своими MKK происходит по общему механизму через фосфорилирование аминокислотных остатков, находящихся в одинаковом контексте. При этом MKK являются представителями редкого класса протеинкиназ с двойной специфичностью: они могут фосфорилировать как остатки Ser/Thr, так и остатки Tyr.
Сами киназы MAPK (MKK) также активируются через фосфорилирование остатков Ser/Thr киназами киназ MAP-киназ (MKKK, или в другом обозначении MAPKKK). В отличие от MAPK, каждая из которых распознается и фосфорилируется специфической протеинкиназой (MKK), любая MKK может быть фосфорилирована и активирована несколькими различными MKKK, включая белки семейства Raf, MEK-киназы (MEKK), c-Mos и MLK (multilineage protein kinase). Такая неразборчивость MKK в отношении своих активирующих партнеров обеспечивает большое разнообразие путей активации MAPK, начиная с определенных стадий каскада реакций фосфорилирования.
Одни из непосредственных мишеней воздействия сигнала, передаваемого с участием MAPK, протоонкогены fos и jun кодируют белки, которые являются основными компонентами многосубъединичного фактора транскрипции AP-1 (подробнее о факторах транскрипции см. ниже). В состав фактора входят гомодимеры или гетеродимеры белков семейства Fos (FosB, Fra-1 и Fra-2) и семейства Jun (c-Jun, Jun-B и Jun-D). Фосфорилирование компонентов AP-1 модулирует (увеличивает или уменьшает) активность фактора. Так, фосфорилирование остатков Ser-63 и Ser-73 в полипептидной цепи c-Jun под действием киназы JNK активирует транскрипцию собственного гена после образования гомодимера c-Jun/c-Jun или гетеродимера c-Jun/ATF2. С другой стороны, индукция гена c-fos под влиянием митогенов или стресса (например УФ-облучения) опосредована фосфорилированием белка ELK-1, входящего в состав фактора транскрипции TCF (ternary complex factor), который взаимодействует с регуляторной последовательностью SRE промотора этого гена.
Гены, кодирующие белки Fos и Jun, принадлежат к семейству непосредственно ранних генов, индукция которых не требует синтеза белка de novo и происходит чрезвычайно быстро в клетках многих типов в ответ на вышеупомянутые внеклеточные и внутриклеточные стимулы. Имеющиеся данные указывают на то, что многокомпонентные факторы транскрипции AP-1, которые представляют собой гомо- и гетеродимеры белков Fos и Jun, играют ключевую роль в регуляции пролиферации, терминальной дифференцировки и программируемой гибели клеток. Например, гены fos/jun индуцируются временно в покоящихся фибробластах в ответ на действие сыворотки. Однако во время дифференцировки миелоидных клеток происходит их стабильная индукция, и уровень транскрипции генов становится максимальным в зрелых клетках, претерпевших терминальную дифференцировку. Все это указывает на возможность участия белков Fos/Jun в инициации и развитии программы терминальной дифференцировки гематопоэтических клеток, а также поддержании их дифференцированного состояния. Передача сигнала с участием MAP-киназ играет не менее важную роль и в регуляции клеточного цикла.
Клеточный цикл и его регуляция. Рост и деление клеток являются одними из тех фундаментальных процессов, которые лежат в основе жизни любого организма. Прежде чем совершить деление, клетка должна с высокой точностью копировать свой геном (клеточную ДНК) и подготовить его передачу в дочернюю клетку, а также синтезировать многочисленные высоко- и низкомолекулярные соединения. Повторяющаяся совокупность событий, обеспечивающих деление эукариотических клеток, получила название клеточного цикла. Продолжительность клеточного цикла зависит от типа делящихся клеток. Некоторые клетки, например нейроны человека, после достижения стадии терминальной дифференцировки прекращают свое деление вообще. Клетки легких, почек или печени во взрослом организме начинают делиться лишь в ответ на повреждение соответствующих органов. Клетки некоторых типов, например клетки эпителия кишечника, делятся на протяжении всей жизни человека. Но даже у этих быстро пролиферирующих клеток подготовка к делению занимает ~24 ч.
Фазы клеточного цикла. Активный клеточный цикл эукариотических клеток разделяют на четыре фазы. Наиболее легко обнаруживаемой является стадия непосредственного деления клеток – митоза, при котором конденсированные метафазные хромосомы поровну распределяются между дочерними клетками (M-фаза клеточного цикла – mitosis). Митоз был первой идентифицированной фазой клеточного цикла, а все остальные события, происходящие в клетке между двумя митозами, были названы интерфазой. Развитие исследований на молекулярном уровне позволило выделить в интерфазе стадию синтеза ДНК, получившую название S-фазы (synthesis). Эти две ключевые стадии клеточного цикла не переходят непосредственно одна в другую. После окончания митоза до начала синтеза ДНК имеет место кажущаяся пауза (gap) в активности клетки – G1-фаза клеточного цикла, в которой внутриклеточные синтетические процессы подготавливают репликацию генетического материала. Второй перерыв в видимой активности (фаза G2) наблюдается после окончания синтеза ДНК перед началом митоза. В фазе G2 клетка осуществляет контроль за точностью произошедшей редупликации ДНК и исправляет обнаруженные сбои. В ряде случаев выделяют пятую фазу клеточного цикла (G0), когда после завершения деления клетка не вступает в следующий клеточный цикл и длительное время остается в состоянии покоя. Из этого состояния она может быть выведена внешними стимулирующими (митогенными) воздействиями. Все перечисленные фазы клеточного цикла не имеют четких временных и функциональных границ, отделяющих их друг от друга, однако при переходе от одной фазы к другой происходит упорядоченное переключение синтетических процессов, позволяющее на молекулярном уровне дифференцировать эти внутриклеточные события.
Циклины и циклин-зависимые киназы. Клетки вступают в клеточный цикл и осуществляют синтез ДНК в ответ на внешние митогенные стимулы. Лимфокины (например интерлейкины), цитокины (в частности интерфероны) и полипептидные факторы роста, взаимодействуя со своими рецепторами на поверхности клеток, индуцируют каскад реакций фосфорилирования внутриклеточных белков, сопровождающихся передачей сигнала от поверхности клеток к ядру и индукцией транскрипции соответствующих генов. Одними из первых активируются гены, кодирующие белки циклины, получившие свое название от того, что их внутриклеточная концентрация периодически изменяется по мере прохождения клеток через клеточный цикл, достигая максимума на его определенных стадиях. Циклины являются специфическими активаторами семейства циклин-зависимых протеинкиназ (CDK – cyclin-dependent kinases) – ключевых участников индукции транскрипции генов, контролирующих клеточный цикл. Активация индивидуальной CDK происходит после ее взаимодействия со специфическим циклином, и образование этого комплекса становится возможным после достижения циклином критической концентрации. В ответ на уменьшение внутриклеточной концентрации конкретного циклина происходит обратимая инактивация соответствующей CDK. Некоторые CDK активируются более чем одним циклином. В этом случае группа циклинов, как бы передавая протеинкиназы друг другу, поддерживает их в активированном состоянии длительное время. Такие волны активации CDK возникают на протяжении G1- и S-фаз клеточного цикла.
В настоящее время идентифицировано восемь индивидуальных CDK (CDK1–CDK8), часть которых не участвует непосредственно в регуляции клеточного цикла. Для полипептидных цепей всех CDK характерна высокая (до 75%) структурная гомология. Специфичность же их функционирования обеспечивают уникальные сайты связывания соответствующих активирующих циклинов.
В семействе циклинов (циклин A – циклин J) известны, по крайней мере, 14 индивидуальных белков. Некоторые члены семейства составляют подсемейства. Например, подсемейство циклинов D-типа состоит из трех членов: D1, D2 и D3. Общей структурной особенностью всех циклинов является наличие в их полипептидной цепи последовательности из ~100 аминокислотных остатков, получившей название циклинового бокса. Циклины относятся к быстро обменивающимся белкам с коротким временем полужизни, которое составляет у циклинов D-типа 15–20 мин. Это обеспечивает динамизм их комплексов с циклинзависимыми киназами. За внутриклеточную деградацию циклинов отвечает N-концевая последовательность аминокислотных остатков, названная боксом деструкции (destruction box). При прохождении клеток через клеточный цикл вслед за активацией отдельных CDK по мере необходимости происходит их инактивация. В последнем случае имеет место протеолитическая деградация циклина, находящегося в комплексе с CDK, которая начинающается с бокса деструкции.
Сами по себе циклины не могут полностью активировать соответствующие CDK. Для завершения процесса активации должно произойти специфическое фосфорилирование и дефосфорилирование определенных остатков аминокислот в полипептидных цепях этих протеинкиназ. Большую часть таких реакций осуществляет киназа, активирующая CDK (CAK – CDK activating kinase), которая представляет собой комплекс CDK7 с циклином H. Таким образом, CDK становятся способными выполнять свои функции в клеточном цикле лишь после их взаимодействия с соответствующими циклинами и осуществления посттрансляционных модификаций под действием CAK и других аналогичных белков-регуляторов клеточного цикла.
Начало деления эукариотической клетки. В ответ на митогенный стимул клетка, находящаяся в фазе G0 или ранней G1, начинает свое прохождение через клеточный цикл. В результате индукции экспрессии генов циклинов D и E, которые обычно объединяют в группу циклинов G1, происходит увеличение их внутриклеточной концентрации. Циклины D1, D2 и D3 образуют комплекс с киназами CDK4 и CDK6. В отличие от циклина D1 два последних циклина, кроме того, объединяются с CDK2. Функциональные различия между этими тремя циклинами в настоящее время неизвестны, однако имеющиеся данные указывают на достижение ими критических концентраций при разных стадиях развития фазы G1. Эти различия специфичны в отношении типа пролиферирующих клеток.
Активация CDK2/4/6 приводит к фосфорилированию белкового продукта гена ретинобластомы pRb и ассоциированных с ним белков p107 и p130. В начале фазы G1 белок pRb фосфорилирован слабо, что позволяет ему находиться в комплексе с фактором транскрипции E2F, играющим ключевую роль в индукции синтеза ДНК, и блокировать его активность. Полностью фосфорилированная форма pRb освобождает E2F из комплекса, что приводит к активации транскрипции генов, контролирующих репликацию ДНК. (Подробнее о взаимодействии E2F с pRb см. в разделе 3.2.3.) Концентрация D-циклинов возрастает на протяжении фазы G1 клеточного цикла и достигает максимума значений непосредственно перед началом S-фазы, после чего начинает уменьшаться. Однако в это время pRb еще фосфорилирован не полностью, и фактор E2F остается в комплексе в неактивном состоянии. Фосфорилирование pRb завершается под действием CDK2, активированной циклином E. Внутриклеточная концентрация последнего становится максимальной в момент перехода клеточного цикла от фазы G1 к S-фазе. Таким образом, комплекс циклин E-CDK2 как бы принимает эстафету от комплексов циклина D с CDK4 и CDK6 и завершает фосфорилирование pRb, сопровождающееся освобождением активного фактора транскрипции E2F. В результате начинается синтез ДНК, то есть клетка вступает в S-фазу клеточного цикла.
Синтез ДНК в S-фазе клеточного цикла. После вступления клетки в S-фазу происходит быстрая деградация циклина E и активация CDK2 циклином A. Циклин E начинает синтезироваться в конце фазы G1 и его взаимодействие с CDK2 является необходимым условием для вступления клетки в S-фазу и продолжения синтеза ДНК. Этот комплекс активирует синтез ДНК через фосфорилирование белков в областях начала репликации. Сигналом к завершению S-фазы и переходу клетки к фазе G2 является активация циклином A другой киназы CDK1 с одновременным прекращением активации CDK2. Задержка между окончанием синтеза ДНК и началом митоза (фаза G2) используется клеткой для контроля полноты и точности произошедшей репликации хромосом. Последовательность событий в этот период точно не известна.
Митоз. Сигнал к началу деления клетки (митоза) исходит от фактора MPF (M phase promoting factor), стимулирующего M-фазу клеточного цикла. MPF представляет собой комплекс киназы CDK1 с активирующими ее циклинами A или B. Складывается впечатление, что комплекс CDK1–циклин A играет более важную роль в завершении S-фазы и подготовке клетки к делению, тогда как комплекс CDK1–циклин B преимущественно осуществляет контроль последовательности событий, связанных с митозом. В настоящее время идентифицировано два циклина B-типа: B1 и B2. Хотя оба циклина, по-видимому, выполняют одинаковые функции, они действуют в разных частях клетки. Так, циклин B1 ассоциирован преимущественно с микротрубочками, тогда как циклин B2 обнаруживают в районе аппарата Гольджи.
Циклины B1 и B2 присутствуют в очень малых концентрациях в фазе G1. Их концентрация начинает увеличиваться в конце S- и на протяжении G2-фаз, достигая своего максимума во время митоза, что приводит к замещению ими циклина A в комплексе с CDK1. Однако этого оказывается недостаточным для полной активации протеинкиназы. Функциональная компетентность CDK1 достигается после серии ее фосфорилирований и дефосфорилирований по специфическим остаткам аминокислот. Такой тонкий контроль необходим для предотвращения вступления клеток в митоз до полного завершения синтеза ДНК.
Деление клетки начинается только после того, как CDK1, находящаяся в комплексе с циклином B, фосфорилируется по остаткам Thr-14 и Tyr-16 протеинкиназой WEE1, а также по остатку Thr-161 протеинкиназой CAK и затем дефосфорилируется по остаткам Thr-14 и Tyr-15 фосфатазой CDC25. Активированная таким образом CDK1 фосфорилирует в ядре структурные белки, в том числе нуклеолин, ядерные ламины и виментин. После этого ядро начинает проходить через цитологически хорошо различимые, но пока недостаточно изученные на молекулярном уровне стадии митоза. Первая стадия митоза – профаза – начинается после того, как CDK1 полностью фосфорилируется, за ней следуют метафаза, анафаза и телофаза, завершающиеся делением клетки – цитокинезом. Следствием этих процессов является правильное распределение реплицированных хромосом, ядерных и цитоплазматических белков, а также других высокомолекулярных и низкомолекулярных соединений в дочерние клетки. После завершения цитокинеза происходит разрушение циклина B, сопровождаемое инактивацией CDK1, что приводит к вступлению клетки в фазу G1 или G0 клеточного цикла.
Фаза G0 клеточного цикла. Клетки некоторых типов на определенных стадиях дифференцировки могут прекращать свое деление, полностью сохраняя свою жизнеспособность. Такое состояние клеток получило название фазы G0. Клетки, достигшие состояния терминальной дифференцировки, уже не могут выйти из этой фазы. В то же время клетки, для которых характерна чрезвычайно низкая способность к делению, например гепатоциты, могут снова вступать в клеточный цикл после удаления части печени.
Переход клеток в состояние покоя становится возможным благодаря функционированию высокоспецифических ингибиторов клеточного цикла. При участии этих белков клетки могут прекращать пролиферацию в неблагоприятных условиях окружающей среды, при повреждении ДНК или появлении грубых ошибок ее репликации. Такие паузы используются клетками для репарации возникших повреждений.
Ингибиторы клеточного цикла. В клеточном цикле имеются две основные стадии (точки перехода, контрольные точки R – restriction points), на которых могут быть реализованы негативные регуляторные воздействия, останавливающие продвижение клеток через клеточный цикл. Одна из этих стадий контролирует переход клетки к синтезу ДНК, а другая – начало митоза. Имеются и другие регулируемые этапы клеточного цикла.
Переход клеток от одной фазы клеточного цикла к другой контролируется на уровне активации CDK их циклинами с участием ингибиторов циклинзависимых киназ CKI. По мере необходимости эти ингибиторы могут активироваться и блокировать взаимодействие CDK со своими циклинами, а следовательно, и клеточный цикл как таковой. После изменения внешних или внутренних условий клетка может продолжить пролиферацию или вступить на путь апоптоза.
Имеется две группы CKI: белки семейств p21 и INK4 (inhibitor of CDK4), члены которых внутри семейств обладают похожими структурными свойствами. Семейство ингибиторов p21 включает в себя три белка: сам p21, p27 и p57. Поскольку эти белки были описаны независимо несколькими группами, до сих пор используются их альтернативные названия. Так, белок p21 известен также под именами WAF1 (wild-type p53 activated fragment 1), CIP1 (CDK2 interacting protein 1), SDI1 (senescent derived inhibitor 1) и mda-6 (melanoma differentiation associated gene). Синонимами p27 и p57 являются соответственно KIP1 и KIP2 (kinase inhibiting proteins 1 and 2). Все эти белки обладают широкой специфичностью действия и могут ингибировать различные CDK. В отличие от этого группа ингибиторов INK4 более специфична. В нее входят четыре белка: p15INK4B, p16INK4A, p18INK4C и p19INK4D. До недавнего времени предполагалось, что все ингибиторы семейства INK4 функционируют во время фазы G1 клеточного цикла, подавляя активность киназы CDK4. Однако обнаруженный недавно второй белковый продукт гена INK4A – p19ARF, взаимодействует с регуляторным фактором MDM2 белка p53 и инактивирует фактор. Это сопровождается увеличением стабильности белка p53 и остановкой клеточного цикла.
Механизмы контроля перехода от G1- к S-фазе клеточного цикла. До начала активного клеточного цикла белок p27, находясь в высокой концентрации, предотвращает активацию протеинкиназ CDK4 или CDK6 циклинами D1, D2 или D3. В таких условиях клетка остается в фазе G0 или ранней фазе G1 до получения митогенного стимула. После адекватной стимуляции происходит уменьшение концентрации ингибитора p27 на фоне возрастания внутриклеточного содержания циклинов D. Это сопровождается активацией CDK и, в конечном счете, фосфорилированием белка pRb, освобождением связанного с ним фактора транскрипции E2F и активацией транскрипции соответствующих генов.
На этих ранних стадиях фазы G1 клеточного цикла концентрация белка p27 все еще остается довольно высокой. Поэтому после прекращения митогенной стимуляции клеток содержание этого белка быстро восстанавливается до критического уровня и дальнейшее прохождение клеток через клеточный цикл блокируется на соответствующем этапе G1. Эта обратимость возможна до тех пор, пока фаза G1 в своем развитии не достигает определенной стадии, называемой точкой перехода, после прохождения которой клетка становится коммитированной к делению, и удаление факторов роста из окружающей среды не сопровождается ингибированием клеточного цикла. Хотя с этого момента клетки становятся независимыми от внешних сигналов к делению, они сохраняют способность к самоконтролю клеточного цикла.
Ингибиторы CDK семейства INK4 (p15, p16, p18 и p19) специфически взаимодействуют с киназами CDK4 и CDK6. Белки p15 и p16 идентифицированы как супрессоры опухолевого роста, и их синтез регулируется белком pRb. Все четыре белка блокируют активацию CDK4 и CDK6, либо ослабляя их взаимодействие с циклинами, либо вытесняя их из комплекса. Хотя оба белка p16 и p27 обладают способностью ингибировать активность CDK4 и CDK6, первый имеет большее сродство к этим протеинкиназам. Считается, что если концентрация p16 повышается до уровня, при котором он полностью подавляет активность киназ CDK4/6, белок p27 становится основным ингибитором киназы CDK2.
На ранних стадиях клеточного цикла здоровые клетки могут распознавать повреждения ДНК и реагировать на них задержкой прохождения клеточного цикла в фазе G1 до репарации повреждений. Например, в ответ на повреждения ДНК, вызванные ультрафиолетовым светом или ионизирующей радиацией, белок p53 индуцирует транскрипцию гена белка p21. Повышение его внутриклеточной концентрации блокирует активацию CDK2 циклинами E или A. Это останавливает клетки в поздней фазе G1 или ранней S-фазе клеточного цикла. В это время клетка сама определяет свою дальнейшую судьбу – если повреждения не могут быть устранены, она вступает в апоптоз, т.е. совершает самоубийство.
Регуляция перехода клеточного цикла от фазы G2 к фазе M. Ответ клетки на повреждения ДНК может наступить и позднее – перед началом митоза. И в этом случае белок p53 индуцирует синтез ингибитора p21, который предотвращает активацию киназы CDK1 циклином B и задерживает дальнейшее развитие клеточного цикла. Само прохождение клетки через митоз также жестко контролируется – последующие стадии не начинаются без полного завершения предыдущих. Некоторые из этих ингибиторов были идентифицированы у дрожжей, но их гомологи у животных пока остаются неизвестными. Например, недавно описаны два белка дрожжей BUB1 (budding uninhibited by benomyl) и MAD2 (mitotic arrest deficient), которые контролируют присоединение конденсированных хромосом к митотическому веретену в метафазе митоза. До завершения правильной сборки этих комплексов белок MAD2 образует комплекс с протеинкиназой CDC20 и инактивирует ее. CDC20 после активации фосфорилирует белки и в результате блокирует те их функции, которые препятствуют расхождению каждой из двух гомологичных хроматид во время цитокинеза.