Под атомно-кристаллической структурой понимают взаимное расположение атомов (ионов), существующее в реальном кристалле.
В твердом состоянии металл представляет собой постройку, состоящую из положительно заряженных ионов, омываемых «газом» из свободных коллективизированных электронов. Связь в металле осуществляется электростатическими силами. Между ионами и коллективизированными электронами проводимости возникают электростатические силы притяжения, которые стягивают ионы. Такая связь называется металлической.
Силы связи в металлах определяются силами отталкивания и силами притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстоянии один от другого, при котором энергия взаимодействия минимальна.

Рис1. Схема энергии взаимодействия двух атомов в зависимости от межатомного расстояния
Поэтому в металле атомы располагаются закономерно, образуя правильную кристаллическую решетку, что соответствует минимальной энергии взаимодействия атомов.
Кристаллическая решетка состоит из воображаемых линий и плоскостей, проходящих через точки расположения ионов в пространстве. Жирными линиями выведен наименьший параллелепипед, последовательным перемещением которого вдоль трех своих осей может быть построен весь кристалл.
Этот наименьший объем кристалла, дающий представление об атомной структуре металла в любом объеме, получил название элементарной кристаллической ячейки.
Для однозначной ее характеристики необходимо знать следующие величины: три ребра (а, в и с) и три угла между осями a, b, g.
Большинство металлов образует одну из следующих высокосимметричных решеток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
Как видно в кубической объемно центрированной решетке (ОЦК) атомы расположены в вершинах куба и один атом в центре объема куба. Кубическую объемно центрированную решетку имеют металлы: РЬ, К, Na, Li, Tig, Zrp, Та, W, V, Fea, Cr, Nb, Ba и др.
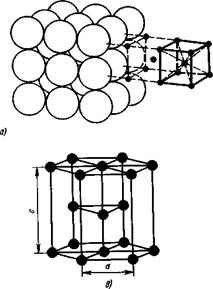


А б
Рис 2. Кристаллические решетки металлов:
а — объемно центрированная кубическая (ОЦК), б — гранецентрированная кубическая (ГЦК); в- гексагональная плотноупакованная (ГПУ)
В кубической гранецентрированной решетке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани (рис. 6, б). Решетку такого типа имеют металлы: Саа, Се, Sra, Tn, Pb, N1, Ag, Au, Pd, Pt, Rh, Jr, FeT, Си, Соа и др.
В гексагональной решетке (рис. 6, в) атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, Tia, Cd, Re, Os, Ru, Zn, Cop, Be, Cap и др.
Расстояния a, b, с между центрами ближайших атомов в элементарной ячейке называются периодами решетки. Период решетки выражается в нанометрах (1 нм = 10-9 см).
Периоды решетки для большинства металлов находятся в пределах 0,1—0,7 нм.
Плотность кристаллической решетки — объема, занятого атомами, которые условно можно рассматривать как жесткие шары (см. рис.2), характеризуется координационным числом, под которым понимают число атомов, находящихся на равном и наименьшем расстоянии от данного атома. Чем выше координационное число, тем больше плотность упаковки атомов.
В элементарной ячейке объемно центрированной кубической решетки наименьшее расстояние между атомами находятся 8 соседей. Следовательно, координационное число для ОЦК решетки соответствует 8 и обозначается К8. Коэффициент компактности ячейки, определяемый как отношение объема, занятого атомами, к объему ячейки составляет для ОЦК решетки 68 %.
Для гранецентрированной кубической решетки координационное число равно 12 (К12); каждый_атом имеет 12 ближайших соседей на расстоянии рис.2, что соответствует наибольшей плотности упаковки или укладки в виде шаров. Гексагональная плотноупакованная решетка, для которой с/а = = 1,633, имеет координационное число 12 (Г12), что также соответствует наибольшей плотности упаковки шаров (атомов).
Половину наименьшего расстояния между атомами в их кристаллической решетке называют атомным радиусом. Атомный радиус возрастает при уменьшении координационного числа, так как при этом увеличивается пространство между атомами. Поэтому атомные радиусы разных металлов обычно приводятся к К12.
Кристаллографические обозначения атомных плоскостей. Для определения положения атомных плоскостей (проходящих через атомы) в кристаллических пространственных решетках пользуются индексами h, k, l, представляющими собой три целых рациональных числа, являющихся величинами, обратными отрезкам осей, отсекаемым данной плоскостью на осях координат. Единицы длины вдоль осей выбирают равными длине ребер элементарной ячейки. Эти числа заключают в круглые скобки.
Приведем примеры обозначения плоскостей. Установим первоначально индексы для плоскости куба.
Вследствие неодинаковой плотности атомов в различных плоскостях и направлениях решетки свойства (химические, физические, механические) каждого монокристалла зависят от направления вырезки образца по отношению к направлениям в решетке. Подобная неодинаковость свойств монокристалла в разных кристаллографических направлениях называется анизотропией.
Кристалл — тело анизотропное в отличие от аморфны к тел (стекло, пластмассы и др.), свойства которых не зависят от направления.
Технические металлы являются поликристаллами, т. e. состоят из большого числа анизотропных кристаллитов. В большинстве случаев кристаллиты статистически неупорядоченно ориентированы по отношению друг к другу; поэтому во всех направлениях свойства более или менее одинаковы, т. е. поликристаллическое тело является псевдоизотропным. Такая мнимая изотропность металла не будет наблюдаться, если кристаллиты имеют одинаковую преимущественную ориентацию в каких-то направлениях. Эта ориентированность, или текстура, создается в известной степени, но не полностью (например, в результате значительной холодной деформации); в этом случае поликристаллический металл приобретает анизотропию свойств.
ДЕФЕКТЫКРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ МЕТАЛЛОВ
В любом реальном кристалле всегда имеются дефекты строения. Дефекты кристаллического строения подразделяют по геометрическим признакам на:
 1- точечные (нульмерные), 2- линейные (одномерные), 3- поверхностные (двумерные).
1- точечные (нульмерные), 2- линейные (одномерные), 3- поверхностные (двумерные).


Точечные дефекты. Малы во всех трех измерениях, и размеры их не превышают нескольких атомных радиусов.
вакансии, межузельные атомы, точечные несовершенства (присутствие атомов примесей)
Линейные дефекты – Малы в двух измерениях и большая протяженность в третьем.
Краевая дислокация - наличие «лишней» атомной полуплоскости.
Винтовая дислокация – прямая линия вокруг которой атомные плоскости изогнуты по винтовой поверхности.
Поверхностные дефекты. Эти дефекты малы только в одном измерении. Они представляют собой поверхности раздела между отдельными зернами или субзернами в поликристаллическом металле; к ним относятся также дефекты упаковки.
Поликристалл состоит из большого числа зерен, при этом в соседних зернах кристаллические решетки ориентированы различно. Границы между зернами называют больше у еловыми, так как кристаллографические направления в соседних зернах образуют углы, достигающие десятков градусов.
Каждое зерно металла состоит из отдельных субзерен, образующих так называемую субструктуру. Субзерна разориентированы относительно друг друга от нескольких долей до единиц градусов — малоугловые границы.

Границы между отдельными кристаллами (зернами) обычно представляют переходную область шириной до 3—4 межатомных расстояний, в которой решетка одного кристалла, имеющего определенную кристаллографическую ориентацию, переходит в решетку другого кристалла, имеющего иную кристаллографическую ориентацию. Поэтому на границе зерна в переходной области атомы расположены иначе, чем в объеме зерна. Кроме того, по границам зерен в технических металлах концентрируются примеси, что еще больше нарушает правильный порядок расположения атомов. Несколько меньшие нарушения наблюдаются на границах субзерен.