Почти во всех жидкостях может содержаться некоторое количество физически растворенных газов. Содержание растворенного газа в жидкости зависит от его парциального давления.
Хотя содержание в крови O2 и СО2 в физически растворенном состоянии относительно невелико, это состояние играет существенную роль в жизнедеятельности организма. Для того, чтобы связаться с теми или иными веществами, дыхательные газы сначала должны быть доставлены к ним в физически растворенном виде. Таким образом, при диффузии в ткани или кровь каждая молекула O2 или СО2 определенное время пребывает в состоянии физического растворения.
Большая часть кислорода переносится кровью в виде химического соединения с гемоглобином. 1 моль гемоглобина может связать до 4 молей кислорода, а 1 грамм гемоглобина – 1,39 мл кислорода. При анализе газового состава крови получают несколько меньшую величину (1,34 – 1,36 мл O2 на 1 г. Hb). Это обусловлено тем, что небольшая часть гемоглобина находится в неактивном виде. Таким образом, ориентировочно можно считать, что in vivo 1г Hb связывает 1,34 мл O2(число Хюфнера).
Исходя из числа Хюфнера, можно, зная содержание гемоглобина, вычислить кислородную емкость крови: [O2] макс = 1,34 мл O2 на 1 г Hb; 150 г Hb на 1 л крови = 0,20 л O2 на 1л крови. Однако, такое содержание кислорода в крови может достигаться лишь в том случае, если кровь контактирует с газовой смесью с высоким содержанием кислорода (PO2 = 300 мм рт.ст.), поэтому в естественных условиях гемоглобин оксигенируется не полностью.
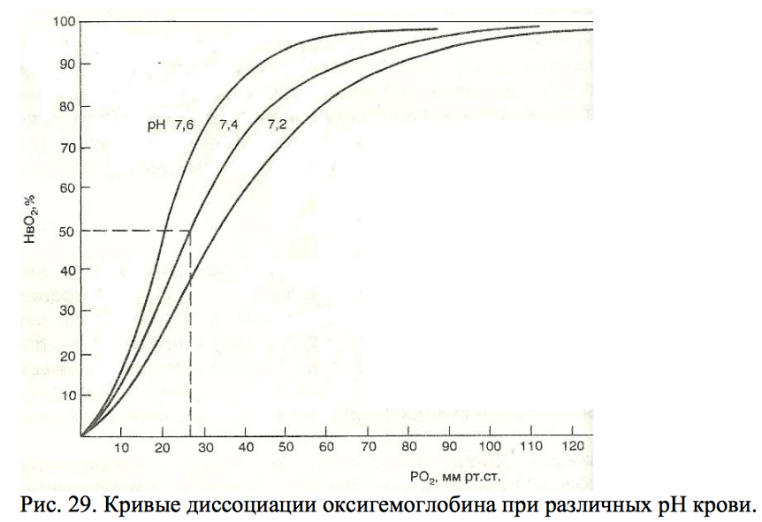 Реакция, отражающая соединения кислорода с гемоглобином подчиняется закону действующих масс. Это означает, что отношение между количеством гемоглобина и оксигемоглобина зависит от содержания физически растворенного О2 в крови; последнее же пропорционально напряжению О2. Процентное отношение оксигемоглобина к общему содержанию гемоглобина называется насыщением гемоглобина кислородом. В соответствии с законом действующих масс насыщение гемоглобина кислородом зависит от напряжения О2. Графически эту зависимость отражает так называемая кривая диссоциации оксигемоглобина. Эта кривая имеет S – образную форму. Наиболее простым показателем, характеризующим расположение этой кривой, служит так называемое напряжение полунасыщения РО2, т.е. такое напряжение О2, при котором насыщение гемоглобина кислородом составляет 50 %. В норме РО2 артериальной крови составляет около 26 мм рт.ст. (среднюю линию главное запомните)
Реакция, отражающая соединения кислорода с гемоглобином подчиняется закону действующих масс. Это означает, что отношение между количеством гемоглобина и оксигемоглобина зависит от содержания физически растворенного О2 в крови; последнее же пропорционально напряжению О2. Процентное отношение оксигемоглобина к общему содержанию гемоглобина называется насыщением гемоглобина кислородом. В соответствии с законом действующих масс насыщение гемоглобина кислородом зависит от напряжения О2. Графически эту зависимость отражает так называемая кривая диссоциации оксигемоглобина. Эта кривая имеет S – образную форму. Наиболее простым показателем, характеризующим расположение этой кривой, служит так называемое напряжение полунасыщения РО2, т.е. такое напряжение О2, при котором насыщение гемоглобина кислородом составляет 50 %. В норме РО2 артериальной крови составляет около 26 мм рт.ст. (среднюю линию главное запомните)
Несмотря на то, что конфигурация кривой диссоциации оксигемоглобина обусловлена главным образом химическими свойствами гемоглобина, существует и ряд других факторов, влияющих на сродство крови к кислороду. Как правило, все эти факторы смещают кривую, увеличивая или уменьшая ее наклон, но не изменяя при этом ее S- образную форму. К таким факторам относятся температура, рН, напряжение СО2 и некоторые другие факторы, роль которых возрастает в патологических условиях.
Равновесие реакции оксигенации гемоглобина зависит от температуры. При понижении температуры наклон кривой диссоциации оксигемоглобина увеличивается, а при ее повышении – снижается. У теплокровных животных этот эффект проявляется только при гипотермии или лихорадочном состоянии.
Форма кривой диссоциации оксигемоглобина в значительной степени зависит от содержания в крови ионов Н+. При снижении рН, т.е. закислении крови, сродство гемоглобина к кислороду уменьшается, и кривая диссоциации оксигемоглобина называется эффектом Бора.
РН крови тесно связано с напряжением СО2: чем pCO2 выше, тем рН ниже. Увеличение напряжения в крови СО2 сопровождается снижением сродства гемоглобина к кислороду и уплощение кривой диссоциации НbО2. Эту зависимость также называют эффектом Бора, хотя при подобном количественном анализе было показано, что влияние CO2 на форму кривой диссоциации оксигемоглобина нельзя объяснить только изменением рН. Очевидно, сам углекислый газ оказывает на диссоциацию оксигемоглобина «специфический эффект».
При ряде патологических состояний наблюдаются изменения процесса транспорта кислорода кровью. Так, есть заболевания (например, некоторые вида анемий), которые сопровождаются сдвигами кривой диссоциации оксигемоглобина вправо (реже – влево). Причины таких сдвигов окончательно не раскрыты. Известно, что на форму и расположение кривой диссоциации оксигемоглобина оказывают выраженное влияние некоторые фосфорорганические соединения, содержание которых в эритроцитах при патологии может изменяться. Главным таким соединением является 2,3-дифосфоглицерат – (2,3 – ДФГ). Сродство гемоглобина к кислороду зависит также от содержания в эритроцитах катионов. Необходимо отметить также влияние патологических сдвигов рН: при алкалозе поглощение кислорода в легких в результате эффекта Бора увеличивается, но отдача его тканям затрудняется; а при ацидозе наблюдается обратная картина. Наконец, значительный сдвиг кривой влево имеет место при отравлении угарным газом.
Гемоглобин - белок с четвертичной структурой, образованной четырьмя субъединицами. Железо в геме находится в двухвалентной форме. Существуют такие физиологические формы гемоглобина:
• оксигемоглобин (НbО2) - соединение гемоглобина с кислородом, образуется преимущественно в артериальной крови и придаёт ей алый цвет (кислород связывается с атомом железа посредством координационной связи);
• восстановленный гемоглобин, или дезоксигемоглобин (НbН), - гемоглобин, отдавший кислород тканям;
• карбоксигемоглобин (НbCО2) - соединение гемоглобина с углекислым газом, образуется преимущественно в венозной крови, вследствие этого кровь приобретает тёмно-вишнёвый цвет.
Патологические формы гемоглобина:
• карбгемоглобин (НbCО) образуется при отравлении угарным газом (СО), при этом гемоглобин теряет способность при соединять кислород;
• метгемоглобин образуется под действием нитритов, нитратов и некоторых лекарственных препаратов (происходит переход двухвалентного железа в трёхвалентное с образованием метгемоглобина - HbMet).
Стандартным цианметгемоглобиновым методом определяют все формы гемоглобина без их дифференцировки.
Содержание гемоглобина в крови у мужчин несколько выше, чем у женщин.
Снижение содержания гемоглобина в крови (анемия) бывает следствием потерь гемоглобина при разного рода кровотечениях или повышенного разрушения (гемолиза) эритроцитов. Причиной анемии может быть нехватка железа, необходимого для синтеза гемоглобина, или витаминов, участвующих в образовании эритроцитов (преимущественно В12 и фолиевая кислота), а также нарушение образования клеток крови при специфических гематологических заболеваниях. Анемия может возникать вторично при хронических соматических заболеваниях.
Гемоглобин выполняет дыхательную и буферную функции. 1 моль гемоглобина способен связать 4 моля кислорода, а 1 г – 1,345 мл газа. Кислородная емкость крови – максимальное количество кислорода, которое может находиться в 100 мл крови. При выполнении дыхательной функции молекула гемоглобина изменяется в размерах. Соотношение между гемоглобином и оксигемоглобином зависит от степени парциального давления в крови. Буферная функция связана с регуляцией pH крови.
В норме содержание гемоглобина 120-165 г/л (120-150 г/л для женщин, 130-160 г/л для мужчин). У беременных содержание гемоглобина низкое до 110 г/л – это для них норма.