Лабораторные работы выполняем на белом листе формата А4, по всем правилам как делали на лабораторных работах.
Пишем тему. Цель. Оборудование и реактивы. Результаты оформляем в виде таблицы, в таблице необходимо заполнить все пустые графы, дописать реакции в каждой графе. В конце пишем вывод. Всю работу делаем теоретически, опираясь на теоретически занятия.
Для контроля за выполнением заданий присылаете мне фотографии своих работ
· Работа на фотографии должна быть пописана (фамилия имя и группа) на каждом листе.
· Работа на фотографии должна быть читаема, если ее прочесть не удается, она не может быть зачтена
· Фотографии должны быть в jpg формате
· Работу положить в файл, ее потом необходимо будет сдать мне
Работы присылать на почту tani0019@mail.ru
В письме в заголовке в ТЕМЕ пишется четко Фамилия Имя группа и дата за которую сделано задание.
Лабораторная работа №8
Тема: Влияние условий на скорость химических реакций
Цели. Повторить понятия о скорости химических реакций и влияющих на нее факторах.
Оборудование и реактивы. Держатель для пробирок, спиртовка, спички, водяная баня, штатив с химическими пробирками, санитарная склянка; цинк (гранулы), железо (пористое восстановленное), HCl (разб., 1:2), железо (стружки), СН3СООН (разб., 1:2), H2SO4 (разб., 1:5), H2SO4 (разб., 1:10).
Теоретическое обоснование
Скорость гомогенной реакции 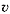 можно определить как изменение количества вещества исходного реагента за единицу времени (
можно определить как изменение количества вещества исходного реагента за единицу времени (  ) в единице объема (V):
) в единице объема (V):
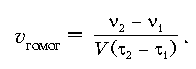
Учитывая, что 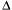
 / V = –
/ V = – 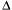 с, где
с, где 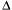 с = c 2 – c 1 (c 2 < c 1) — изменение концентрации реагирующего вещества, получаем новое выражение:
с = c 2 – c 1 (c 2 < c 1) — изменение концентрации реагирующего вещества, получаем новое выражение:
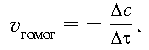
Скорость гомогенной реакции определяется изменением концентрации одного из реагирующих веществ в единицу времени.
Скорость реакции измеряется в моль/(см3•мин) или в моль/(л•с).
Скорость гетерогенной реакции определяется изменением количества вещества исходного реагента в единицу времени на единице поверхности S:
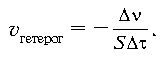
Факторы, влияющие на скорость химических реакций
| Особенности реакций | Примеры | Теоретическое обоснование | Запишите примеры реакций |
| Природа реагирующих веществ | Металлы (K, Na) с водой реагируют с различной скоростью | Атомы металлов K и Na отдают электроны (окисляются) с разной скоростью, т. к. R K > R Na (R – радиус атома) | |
| Для гомогенных процессов скорость химической реакции зависит от концентрации реагирующих веществ | Горение вещества в чистом кислороде активнее, чем в воздухе | Частота столкновений молекул реагирующих веществ зависит от их числа в единице объема, т. е. от концентрации | |
| Для веществ в твердом состоянии скорость реакции прямо пропорциональна поверхности соприкосновения реагентов | Вещества железо и сера в твердом состоянии реагируют достаточно быстро лишь в измельченном виде и при перемешивании | При измельчении и перемешивании увеличивается поверхность соприкосновения реагирующих веществ | |
При повышении температуры на каждые 10° скорость большинства реакций увеличивается в 2–4 раза правило Вант-Гоффа):
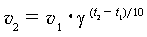
| Со многими веществами кислород начинает реагировать с заметной скоростью уже при обычной температуре (медленное окисление), а при повышении температуры скорость окисления резко увеличивается | Для химической реакции взаимодействующие молекулы должны быть активны (обладать достаточной кинетической энергией). При повышении температуры доля активных молекул возрастает | |
Скорость химической реакции зависит от присутствия катализатора (или ингибитора): A + K 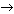 АK, AK + В АK, AK + В 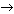 АВ + K, АВ + K, 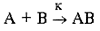
| Разложение бертолетовой соли (KClO3) и пероксида водорода (H2O2) ускоряется в присутствии МnО2. В присутствии ингибиторов соляная кислота становится инертной к металлам | В присутствии катализаторов молекулы, как правило, становятся реакционноспособными при более низкой температуре. Реакционная способность KClО3 проявляется при 400 °С, а в присутствии МnO2 – при 200 °C | |
| В две пробирки положить по грануле цинка и прилить: в первую – 2 мл разбавленной соляной кислоты (1:2), а во вторую – 2 мл разбавленной уксусной кислоты (1:2) | Учитывая силу кислот и, следовательно, разную концентрацию ионов гидроксония (Н3О+) в их растворах, объяснить различную скорость выделения свободного водорода (Н2  ). Kак можно изменить условия обеих реакций, чтобы их скорости увеличились? ). Kак можно изменить условия обеих реакций, чтобы их скорости увеличились?
| ….. | |
| В одну пробирку насыпать немного порошка железа, в другую – столько же железных стружек и в обе пробирки прилить по 2 мл разбавленной соляной кислоты (1:2) | Объяснить причину большей скорости выделения пузырьков газа при взаимодействии кислоты с восстановленным железом (порошком) | ..... | |
| В две пробирки положить по 2 гранулы цинка:в первую – прилить 2 мл разбавленной серной кислоты (1:5), а во вторую – раствор H2SO4 (l:10) | Что наблюдается? Объяснить большую скорость взаимодействия в одном из опытов | ..... | |
| В две пробирки положить по 2 гранулы цинка и в обе прилить по 2 мл разбавленной серной кислоты (1:10). Одну из пробирок слегка подогреть | Сравнить результаты наблюдений, объяснить причину различной скорости химической реакции. Kаким образом можно увеличить скорость реакции без нагревания? | ….. |
вывод