Аналитическая химия
Методические указания по изучению дисциплины
и задание для контрольной работы
для студентов заочной формы обучения
Института сельского хозяйства и природных ресурсов НовГУ
Составитель:
Анисимова Г.И.,
к.с.-х.н., доцент каф. ХЭ
Великий Новгород
ВВЕДЕНИЕ
Аналитическая химия, являясь одной из общеобразовательных дисциплин, закладывает теоретические основы изучения специальных дисциплин, важнейших в системе образования специалиста естественно-научного и сельскохозяйственного профиля.
Курс аналитической химии дает теоретическую и практическую подготовку студента, предполагает получение им знаний и навыков, необходимых для решения задач по установке качественного, количественного состава веществ. Аналитическая химия как наука в последнее время претерпела существенные изменения. Значительно расширился круг объектов исследования, среди которых особая роль принадлежит многочисленным органическим соединениям. Развитие биологии, биохимии, химии природных и синтетических биологически активных веществ потребовало совершенствования методов разделения и анализа сложных смесей. Все более актуальным становится исследование структуры и межмолекулярной взаимосвязи веществ. В связи с этим преподавание аналитической химии изменяется в сторону теоретизации, повышения удельного веса инструментальных методов анализа и анализа органических соединений.
Цель преподавания дисциплины заключается в обучении студентов теоретическим основам аналитической химии и приобретению ими навыков практического применения методов качественного и количественного анализа для определения соединений неорганической и органической природы, правильной оценке полученных результатов. Изучение курса "Аналитическая химия" основывается на базе курса "Общая и неорганическая химия". Предполагается, что студент умеет выполнять частные реакции открытия катионов и анионов, может рассчитать концентрации Н+, ОН--ионов имеет представление о гидролизе солей различного типа, о комплексных соединениях, о малорастворимых соединениях и может на основании ПР вычислить концентрации ионов в растворе (и наоборот); умеет уравнивать окислительно-восстановительные реакции и т. д.
В процессе изучения аналитической химии должны быть поставлены и успешно решены конкретные задачи по усвоению студентами дисциплины.
Студент должен знать:
1. Теоретические основы аналитической химии.
2. Принципы и методы химического качественного анализа (дробный и систематический)
3. Принципы и методы химического количественного анализа (гравиметрия и титриметрия).
4. Теоретические основы физико-химических (инструментальных) методов анализа, их применение для определения качественного и количественного состава анализируемых объектов.
Студент должен уметь:
1. Самостоятельно работать с учебной, справочной и методической литературой по аналитической химии.
2. Правильно выбирать метод анализа в соответствии с поставленной аналитической задачей и заданной точностью определения.
3. Владеть техникой и осуществлять различные гравиметрические и титриметрические определения.
4. Правильно выполнять расчеты результатов анализа и оценивать их с помощью методов математической обработки.
5. Работать с приборами - аналитическими весами, рН-метрами, иономерами, установками для электрохимических методов анализа, фотоэлектроколориметрами и спектрофотометрами.
6. Применять полученные знания для анализа соединений неорганической и органической природы.
В лекционный курс включены три основные раздела - введение и теоретические основы аналитической химии, качественный химический анализ и количественный анализ, включая физико-химические (инструментальные) методы анализа. Лабораторный практикум включает работы по качественному анализу смесей ионов, количественному определению веществ химическими титриметрическими и физико-химическими методами анализа. Лабораторные работы выполняются студентами индивидуально и самостоятельно под контролем преподавателя.
Основной вид работы студента заочного отделения - самостоятельное изучение курса аналитической химии по указанной литературе. Помощь в изучении курса могут оказать методические указания к темам курса, где отражены основные вопросы и даны примеры решения задач.
Студент делает одну контрольную работу. Работа должна быть представлена в установленный срок.
ЛИТЕРАТУРА
1 Цитович И.К. Курс аналит. химии: Учебник. - 7-е изд. СПб.: Лань, 2004. - 496с.
2 Цитович И.К. Курс аналит. химии: Учебник для с.-х. вузов. - 6-е изд. испр. и доп. М.: Высшая школа, 1994. - 495с.
3 Цитович И.К. Курс аналит. химии: Учебник для с.-х. вузов. - 5-е изд. испр. и доп. М.: Высшая школа, 1985. - 400с.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
И КАЧЕСТВЕННЫЙ АНАЛИЗ
Основные понятия и термины
А н а л и т и ч е с к а я х и м и я – наука, развивающая теоретические основы химического анализа и разрабатывающая методы определения химического состава веществ и химического строения соединений.
Х и м и ч е с к и й а н а л и з – совокупность готовых приемов анализа, в результате применения которых устанавливается химический состав.
О б н а р у ж е н и е – установление факта присутствия или отсутствия вещества или его компонента в образце.
О п р е д е л е н и е – установление содержания (количества, концентрации) какого-либо компонента в изучаемом образце.
Х и м и ч е с к и е м е т о д ы о б н а р у ж е н и я – методы, основанные на использовании аналитических реакций; аналитический сигнал наблюдают главным образом визуально.
Ф и з и ч е с к и е и ф и з и к о – х и м и ч е с к и е м е т о д ы о б н а- р у ж е н и я – методы, основанные на изучении физических свойств исследуемых веществ (оптические, электрохимические, магнитные и др.); аналитический сигнал получают и регистрируют с помощью специальной аппаратуры.
Р е а г е н т с п е ц и ф и ч е с к и й – реагент для обнаружения искомых ионов в присутствии других ионов. Применяется при проведении дробного метода анализа.
Р е а г е н т и з б и р а т е л ь н ы й (с е л е к т и в н ы й) – реагент, который реагирует с ограниченным числом ионов. Используют как в дробном, так и в систематическом анализе.
Р е а г е н т г р у п п о в о й – реагент на группу ионов с образованием одного и того же аналитического сигнала (чаще всего осадка). Используется в систематическом анализе.
Д р о б н ы й а н а л и з – анализ, при котором искомые ионы можно обнаружить в отдельной порции исследуемого раствора, не прибегая к определенной схеме обнаружения ионов.
С и с т е м а т и ч е с к и й а н а л и з – определенная последовательность обнаружения ионов – после того, как мешающие обнаружению ионы удалены или замаскированы.
М а с к и р о в а н и е – подавление мешающего влияния посторонних ионов путем действия на них окислителей, восстановителей или комплексообразующих веществ.
М и к р о а н а л и з – количество исследуемого вещества составляет 1 г или 10 мл раствора.
П о л у м и к р о а н а л и з – количество исследуемого вещества составляет 0,1 – 0,01 г или 1,0 – 0,1 мл раствора.
У л ь т р а м и к р о а н а л и з – количество исследуемого вещества < 10‑4 г или 10-3 – 10-6 мл раствора.
А н а л и т и ч е с к и й с и г н а л – среднее значение результатов измерения физической величины в заключительной стадии анализа, функционально связанное с содержанием определяемых компонентов.
Г р а д у и р о в о ч н а я х а р а к т е р и с т и к а – зависимость аналитического сигнала от содержания определяемого компонента, устанавливаемая опытным или расчетным путем и выраженная в виде формул (градуировочная функция), таблиц, графиков. Градуировочный график может представлять зависимость между преобразованными величинами аналитического сигнала и определяемого содержания.
К о э ф ф и ц и е н т ч у в с т в и т е л ь н о с т и (S) – значение первой производной градуировочной функции при данном определяемом содержании. Для градуировочных графиков, построенных без преобразования аналитического сигнала и определяемого содержания, коэффициент чувствительности (S) равен угловому коэффициенту градуировочного графика: S = (dy/dc)ci.
Д и а п а з о н о п р е д е л я е м ы х к о н ц е н т р а ц и й – предусмотренная данной методикой область значений определяемых содержаний.
А к т и в н о с т ь (a) – эффективная, кажущаяся концентрация вещества (иона), соответственно которой оно действует в химической реакции. Выражается в тех же единицах, что и концентрация раствора (моль/л).
К о э ф ф и ц и е н т а к т и в н о с т и (f) – отношение активности к действительной концентрации иона (c): f = a/c.
И о н н а я с и л а р а с т в о р а (м) – полусумма произведений концентраций всех присутствующих в растворе ионов на квадрат заряда данного иона: м =  .
.
П р е д е л о б н а р у ж е н и я (Cmin, p, мкг/мл) – минимальная концентрация или минимальное количество вещества, которое может быть обнаружено или идентифицировано данным методом с какой-то допустимой погрешностью (р – доверительная вероятность).
П р е д е л ь н о е р а з б а в л е н и е (Vпред., мл/г) – величина, обратная предельной концентрации, которая показывает, в какой массе растворителя содержится 1 г определяемого иона: Vпред. = 1:V·106/Cmin, p.
Тема 1 Качественный анализ – дробный и систематический
При выполнении задания по этой теме необходимо знать сероводородную (сульфидную) и кислотно-основную классификации катионов на аналитические группы и групповые реагенты, уметь писать уравнения реакций в ионном виде катионов металлов соответствующих групп с этими реагентами. При написании реакций обнаружения катионов обратить особое внимание на условия их выполнения и мешающее действие других ионов.
В данных методических указаниях и методических указаниях кафедры " Качественный анализ катионов", изучение свойств катионов основано на сульфидной классификации катионов, согласно которой необходимо выполнять задание по составлению хода анализа.
Таблица 1 – Сульфидная классификация катионов
| Группа | Катионы | Групповой реагент | Растворимость соединений |
| I | K+, Na+, NH4+, Mg2+ | нет | Сульфиды, карбонаты, хлориды растворимы в воде |
| II | Ba2+, Sr2+, Ca2+ | (NH4)2CO3, рH = 9,2 | Карбонаты не растворимы в воде |
Пример: Смесь сухих солей: карбонат натрия (избыток), хлорид бария, хлорид хрома(III), нитрат никеля, нитрат серебра, арсенат натрия, нитрат меди, хлорид калия растворили в воде. Какие соединения будут в осадке, какие ионы будут в растворе? Составьте схему анализа.
Решение.
Рассмотрим, какие ионы находятся в растворе при диссоциации взятых солей:

Рассмотрим возможные взаимодействия между ионами, приводящие к образованию осадков:

Выпадение в осадок Ag2CO3 маловероятно, так как растворимость AgCl меньше (см. пример к теме 3).
В осадке могут быть также NiCO3 и (CuOH)2CO3 После составления схемы анализа необходимо написать реакции разделения, реакции перевода осадков в раствор и реакции обнаружения в ионном виде присутствующих в смеси катионов. Окислительно-восстановительные реакции необходимо составлять электронно-ионным методом.
Тема 2 Гомогенные равновесия. Теория электролитической диссоциации. Расчет рН в растворах сильных и слабых кислот и оснований. Химическое равновесие Закон действующих масс. Буферные растворы, расчет рН в буферных растворах
При выполнении задания по этой теме важно правильно применять основные положения теории электролитической диссоциации для написания уравнений диссоциации сильных и слабых электролитов. Используя константы кислотности (Ка) и основности (Кв) необходимо уметь выводить формулы для расчета [H+], [OH-] и рН, рОН в растворах слабых кислот и оснований, а также в присутствии их солей. Следует изучить механизм действия буферных растворов и использование их в систематическом ходе анализа.
Пример 1. Рассчитать рН в 0,025 М растворе хлороводородной кислоты.
Решение:

Пример 2. Рассчитать рН 0,015 М раствора муравьиной кислоты. Как изменится рН, если к 20 мл этого раствора прибавить 25 мл 0,01 М раствора формиата натрия?
Решение: HCOOH- > НСОО- + Н+

Рассчитаем концентрации муравьиной кислоты и формиата натрия после смешивания растворов

При добавлении формиата натрия диссоциация муравьиной кислоты подавлена, следовательно [HCOO-] = c(HCOONa) = 0,0055 моль/л

рН = 3,67
При добавлении формиата натрия рН раствора повышается за счет подавления диссоциации муравьиной кислоты в присутствии одноименного иона.
Тема 3 Протолитические равновесия в растворах солей. Степень и константа гидролиза. Расчет рН в растворах гидролизующихся солей.
В водных растворах соли, содержащие катионы слабых оснований, и анионы слабых кислот подвергаются гидролизу, то есть взаимодействуют с протонами или гидроксильными группами нейтральных молекул воды. В растворах устанавливается гидролитическое равновесие, которое характеризуется константой гидролиза (Кh). При изучении этой темы необходимо обратить внимание на правильное написание уравнений реакций гидролиза в ионном виде и выражение константы гидролиза. Уметь выводить расчетные формулы степени гидролиза (h) и рН растворов гидролизующихся солей, знать факторы, влияющие на гидролиз. Особое внимание обратить на реакции гидролиза карбоната аммония и сульфида аммония, которые являются групповыми реагентами и используются для отделения катионов II и III аналитических групп.
Пример 1.
Рассчитать константу гидролиза, степень гидролиза и рН 0,05 М раствора цианида калия ( ).
).
Решение:

Если степень гидролиза соли меньше 10%, то можно принять, что
[CN-]=c(KCN). Подставим значения равновесных концентраций в уравнение константы гидролиза:

Степень гидролиза меньше 10%, следовательно, наше допущение справедливо.
Тема 4 Гетерогенные равновесия в аналитической химии. Произведение растворимости (константа растворимости). Условия образования осадков. Влияние на полноту осаждения одноименного иона, рН раствора, постороннего электролита ("солевой эффект")
Гетерогенные равновесия устанавливаются на границе раздела фаз (осадок - насыщенный раствор над осадком). Данное равновесие характеризует константа растворимости (Ks) или произведение растворимости (ПР). Используя значения ПР (Ks) необходимо уметь рассчитывать молярные (моль/л) и массовые (г/л) концентрации ионов в растворе малорастворимого соединения в воде и в присутствии одноименных ионов. Следует знать условие образования осадков и уметь решать вопрос о возможности их образования при смешивании растворов.
Пример 1.
Рассчитать молярную (моль/л) и массовую (г/л) растворимость сульфата кальция, если ПР(CaSO4)=2,5∙10-5.
Решение:
Запишем равновесие в рассматриваемой системе
CaSO4 -> Ca2+ + SO42-
Обозначим молярную концентрацию соли в насыщенном растворе (растворимость) - s (моль/л), тогда [Ca2+] = [SO42-] = s
Запишем выражение ПР

Массовая растворимость сульфата кальция будет равна:
S(г/л)=s(моль/л)∙М(СаSO4)=5∙10-3∙136 = 0,68 г/л
Пример 2.
Смешали 500 мл 0,002 М раствора хлорида бария и 500 мл 0,001 М раствора сульфата калия. Выпадет ли в этих условиях осадок сульфата бария?
ПР(ВаSO4)=1,1∙10-10.
Решение:
Условие образования осадков: произведение концентрации ионов должно быть больше произведения растворимости
ПКИ > ПР
ПКИ = с(Ва2+)∙с(SO42-)
При смешивании равных объемов растворов, концентрации ионов уменьшаются в 2 раза, следовательно:
[Ba2+] = c(BaCl2) = 0.001 моль/л
[SO42-] = c(K2SO4) = 0.0005 моль/л
ПКИ = 0,001∙0,0005 = 5∙10-5
ПКИ > ПР, осадок выпадает.
Пример 3.
Рассчитать растворимость фосфата серебра в 0,02 М растворе фосфата натрия.
ПР(Ag3PO4)=1,3∙10-20.
Решение:
Запишем уравнения равновесий для данной системы

Обозначим растворимость фосфата серебра в насыщенном растворе через s, тогда [Ag+]=3s, в присутствии одноименного иона растворимость фосфата серебра понижается, поэтому равновесная концентрация фосфат-иона будет определяться концентрацией фосфата натрия [PO43-]=c(Na3PO4)=0,02 моль/л. Подставим эти обозначения в выражение ПР

Тема 5 Равновесия в растворах комплексных соединений. Константы устойчивости и нестойкости. Влияние избытка лиганда, разрушение комплексных соединений
В водных растворах комплексных соединений устанавливается равновесие, которое характеризуется константой устойчивости (Куст) или величиной обратной ей, константой нестойкости (Kн). Пользуясь величиной соответствующей константы необходимо уметь рассчитывать равновесные концентрации ионов в растворе комплексных соединений в присутствии избытка лиганда и без избытка лиганда. Следует знать способы разрушения комплексов и уметь проводить расчеты, связанные с разрушением комплексов за счет образования малорастворимых соединений.
Пример 1.
Рассчитать равновесную концентрацию ионов Zn2+ в 1 М растворе [Zn(NH3)4]Cl2. lg Kуст = 8,7.
Решение:
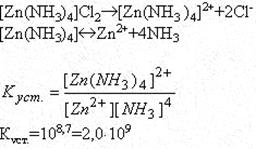
Обозначим [Zn2+]=x моль/л, тогда [NH3]=4x моль/л Величина х<<1, ею можно пренебречь, поэтому равновесная концентрация [Zn(NH3)4]2+=c([Zn(NH3)4]2+)=1 моль/л Подставим равновесные концентрации ионов в выражение константы устойчивости

Пример 2.
Будет ли выпадать осадок оксалата цинка при добавлении к 0,001 М раствору [Zn(NH3)4]2+ 0,1 моль/л оксалата натрия, если равновесная концентрация аммиака в растворе составляет 0,1 моль/л? 
Решение:
Осадок будет образовываться, если выполняется условие: ПКИ > ПР

Равновесную концентрацию ионов цинка рассчитаем из константы устойчивости аммиакатного комплекса цинка
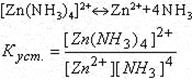
В растворе присутствует избыток аммиака, следовательно, равновесие сдвинуто в сторону образования комплекса, диссоциация комплекса подавлена [NH3]=0,1 моль/л.

ПКИ < ПР, осадок в данных условиях не образуется.
Тема 6 Окислительно-восстановительные системы. Стандартный и реальный окислительно-восстановительные потенциалы. Уравнение Нернста. Влияние рН. Комплексообразования и осаждения на величину окислительно-восстановительного потенциала. Направление, последовательность протекания и константа равновесия окислительно-восстановительных реакций
Количественной характеристикой окислительно-восстановительной способности редокс-пары являются значения стандартного и реального окислительно-восстановительного потенциала. Реальный окислительно-восстановительный потенциал рассчитывается по уравнению Нернста. При изучении этой темы следует обратить внимание на правильное написание уравнения Нернста для различных случаев окислительно-восстановительных систем: с участием твердых веществ, с участием ионов водорода и гидроксид-ионов и т. д., а также на расчет потенциала с учетом равновесных концентраций. Уравнения окислительно-восстановительных реакций необходимо составлять электронно-ионным методом. Молекулярные уравнения составлять не следует. На основании стандартных окислительно-восстановительных потенциалов уметь определять направление протекания реакций. Обратить особое внимание как меняется величина потенциала системы при образовании комплексного и малорастворимого соединения.
Пример 1.
Составить уравнение реакции между перманганат-ионом и пероксидом водорода в кислой среде электронно-ионным методом и записать уравнения Нернста для окислительно-восстановительных систем.
Решение:

Составляем уравнения Нернста для окислительно-восстановительных систем:

Пример 2.
Можно ли в кислой среде действием дихромата калия окислить: а) Fe2+ до Fe3+; б) Mn2+ до MnO4-?
Решение:
Для решения вопроса необходимо сравнить стандартные окислительно-восстановительные потенциалы окислительно-восстановительных систем. Более сильным окислителем будет окисленная форма той системы стандартный окислительно-восстановительный потенциал, которой больше.

Потенциал системы Cr2O72-/Cr3+, больше, чем потенциал системы Fe3+/Fe2+ и меньше, чем потенциал системы MnO4-/Mn2+, следовательно, Fe2+ можно окислить до Fe3+ действием дихромата калия, а Mn2+ до MnO4- не окисляется.
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Основные понятия и термины
Титриметрический анализ
Т и т р о в а н и е – процесс определения содержания вещества по количеству израсходованного стандартного реагента. При титровании расходуется количество реагента, эквивалентное количеству титруемого вещества, в соответствии со стехиометрией реакции между ними при условии, что эта реакция практически необратима. Конечную точку титрования фиксируют по изменению окраски титруемого раствора или индикатора, который добавляют в ходе реакции, или устанавливают по излому или скачку на кривой титрования. По типу реакции, используемой при титровании, различают кислотно-основное, окислительно-восстановительное, осадительное и комплексонометрическое титрование; по способу индикации конечной точки титрования – визуальное, потенциометрическое, фотометрическое, кондуктометрическое, амперометрическое титрование. Титрование проводят двумя способами: пипетирования и отдельных навесок.
С т а н д а р т н ы й р а с т в о р (т и т р а н т) – раствор с точно известной концентрацией.
И с х о д н о е в е щ е с т в о – химическое соединение, используемое для приготовления раствора с точно известной концентрацией (первичный стандарт), удовлетворяющее ряду требований: 1) вещество должно быть химически чистым; 2) состав вещества должен точно соответствовать формуле; 3) вещество должно быть устойчивым при хранении; 4) должно иметь возможно большую молярную массу эквивалента. Лишь немногие вещества удовлетворяют этим требованиям.
П е р в и ч н ы й с т а н д а р т – раствор, концентрация которого точно известна, приготовленный из исходного вещества. Первичные стандарты используют как для обычных титриметрических определений, так и для установления точной концентрации растворов вторичных стандартов.
Ф и к с а н а л – запаянная ампула, в которой находится определенное количество соответствующего вещества. Фиксаналы используют для приготовления растворов первичных стандартов.
В т о р и ч н ы е с т а н д а р т ы – растворы, приготовленные с примерно известной концентрацией, а затем их точную концентрацию устанавливают (стандартизируют) по раствору первичного стандарта.
Т и т р (Т) стандартного (рабочего) раствора – масса вещества (в граммах), содержащаяся в одном миллилитре данного раствора, г/мл.
Т и т р п о о п р е д е л я е м о м у в е щ е с т в у (ТА/В) – масса определяемого вещества (А), с которой реагирует один миллилитр данного раствора (В).
Э к в и в а л е н т – реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна одному иону водорода или (в окислительно-восстановительной реакции) одному электрону.
Ф а к т о р э к в и в а л е н т н о с т и [fэквив.(А)] – число, обозначающее, какая доля реальной частицы вещества А эквивалентна одному иону водорода или одному электрону.
М о л я р н а я м а с с а э к в и в а л е н т а [М(А)Чfэквив.(А)] – масса моля эквивалента, численно равная произведению фактора эквивалентности на молярную массу вещества.
П р а в и л о э к в и в а л е н т о в – вещества реагируют в объемах, обратно пропорциональных молярным концентрациям их эквивалентов:
C1 Ч V1 = C2 ЧV2.
М о л я р н а я к о н ц е н т р а ц и я э к в и в а л е н т а [С(А)Чfэквив.] – число молей эквивалентов в 1 л раствора, моль/л.
П р я м о е т и т р о в а н и е – определяемое вещество в процессе титрования непосредственно реагирует с раствором титранта:
А + В ® продукты реакции,
где А – раствор определяемого вещества; В – раствор титранта.
О б р а т н о е т и т р о в а н и е – к раствору определяемого вещества добавляют точно известное количество другого вещества в избытке (титрант 1); не вступившее в реакцию количество титранта 1 оттитровывают титрантом 2:
А + В1 ® продукты реакции + остаток В1,
В1 + В2 ® продукты реакции.
Т и т р о в а н и е з а м е с т и т е л я (косвенное титрование) – к раствору определяемого вещества добавляют вспомогательный раствор реагента (заведомо в избытке, для смещения равновесия реакции вправо). Продукт реакции (заместитель), количество эквивалентов которого в точности равно количеству эквивалентов определяемого вещества, оттитровывают раствором титранта:
А + Д ® продукты реакции + С,
С + В ® продукты реакции,
где Д – раствор вспомогательного реагента; С – заместитель; В – раствор титранта.
Т о ч к а э к в и в а л е н т н о с т и (т. эк.) – момент, когда определяемое вещество полностью прореагировало с раствором титранта. Т. эк. – понятие теоретическое.
Т о ч к а к о н ц а т и т р о в а н и я (т. к. т.) – момент изменения физического свойства (изменение окраски) титруемого раствора, связанный с эквивалентностью. Чаще всего это изменение фиксируется индикаторным или инструментальным способом. Следовательно, т. к. т. – понятие практическое. Разность объемов титранта в т. эк. и т. к. т. мала, но она существует из-за неадекватности изменения физического свойства и нашей способности наблюдать его. V (т. эк.) № V(т. к. т.). Этим обусловливается наличие индикаторной ошибки титрования.
И н д и к а т о р ы – химические вещества, изменяющие окраску, люминесценцию или образующие осадок при изменении концентрации того или иного компонента в растворе. Существуют кислотно-основные, окислительно-восстановительные, адсорбционные и комплексонометрические (металл индикаторы) индикаторы.
Вычисления в титриметрическом анализе
Количество определяемого вещества в титриметрическом анализе рассчитывают несколькими способами:
1. По нормальности раствора титранта [ Н(В)].
2. По титру раствора титранта [Т(В)] или по титру, выраженному по определяемому веществу [Т(В/А) ].
3. С помощью поправочного коэффициента [К].
При вычислениях в титриметрическом анализе приняты следующие обозначения:
m(нав) – масса навески образца анализируемого вещества, г;
ЭМ – эквивалентная масса, г/моль;
Н(А) – нормальность раствора определяемого вещества, моль/л;
Т(А) – титр раствора определяемого вещества, г/мл;
V(А) – аликвотная часть раствора определяемого вещества, мл;
m(А) – содержание определяемого вещества в анализируемом образце, г;
V(К) – общий объем анализируемого раствора, мл;
Н(В) – нормальность раствора титранта, моль/л;
Т(В) – титр раствора титранта, г/мл;
Т(В/А) – титр раствора титранта по определяемому веществу, выраженный в граммах определяемого вещества А, эквивалентного количеству вещества В, содержащегося в 1 мл раствора титранта В, г/мл;
К(В) – поправочный коэффициент раствора титранта;
m(В) – масса вещества в растворе титранта, г;
V(В) – объем раствора титранта, мл.