П р и м е р 1. Вычислить pH раствора серной кислоты с молярной концентрацией вещества эквивалента 0,05 моль/дм3 (считая кислоту сильной по обеим ступеням диссоциации).
Р е ш е н и е. Сильные кислоты и сильные основания в разбавленных водных растворах диссоциируют полностью. Следовательно, для сильных кислот
[H+] = скисл, откуда (по определению рН):
рН = - lg[H+] = - lg cкисл. (1)
рН = - lg 0,05 = 1,3
О т в е т: рН = 1,3.
Пример 2. Рассчитать молярную концентрацию ионов OH- в растворе с pH = 12,5.
Р е ш е н и е. Расчёт проводят с учетом ионного произведения воды:
pH + pOH = 14 (2)
pOH = 14 - pH = 14 - 12,5 = 1,5
pOH = - lg[OH-] (по определению pOH);
[OH-] = 10-1.5 = 10-2+0.5 = 3,2.10-2.
О т в е т: c(OH-) = 3,2.10-2 моль/дм3.
Пример 3. Вычислить pH раствора, содержащего в 1 дм3 0,2г гидроксида натрия.
Р е ш е н и е. Молярная масса гидроксида натрия M(NaOH) =40г/моль; количество вещества, содержащего в 1 дм3 раствора, равно m/M(NaOH) = 0,05 моль, следовательно, молярная концентрация раствора с(NaOH) = 0,05 моль/дм3.
Для растворов сильных оснований pOH = - lg c(осн.) (3)
pOH = -lg c(NaOH) = -lg 0,05 = 1,3; откуда,
исходя из формулы (2) pH = 14 - 1,3 = 12,7.
О т в е т: pH = 12,7.
Пример 4. Рассчитать pH 0,1 моль/дм3 раствора уксусной кислоты.
Р е ш е н и е. Применяем формулу для расчёта pH раствора слабой кислоты
pH = 1/2pKкисл. - 1/2.lg cкисл (4)
По справочнику находим Ккисл = 1,86.10,pKкисл. = 4,76.
Подставив числовые значения в формулу (4),находим
pH =1/2.4,76 - 1/2.lg 0,1 = 2,38 + 0,50 = 2,88.
О т в е т: pH = 2,88
Пример 5. Рассчитать равновесные концентрации ионов HCOO- и H+ в растворе с общей концентрацией муравьиной кислоты 4,6г/дм3.
Р е ш е н и е. В справочнике K(HCOOH) = 1,84.10-4.
Согласно стехиометрии ионизации кислоты
HCOOH = HCOO- + H+, [H+] = [HCOO-].
Вкладом равновесия ионизации воды пренебрегаем и применяем уравнение (4)
в форме 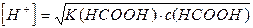
Вычислив молярную концентрацию кислоты с(НСООН)=m(HCOOH)/M(HCOOH)=4,6/46=0,1 моль/дм3, рассчитывают:
[H+] = [HCOO-] =  = 4,2.10 моль/дм3
= 4,2.10 моль/дм3
О т в е т: [H+] = [HCOO-] = 4,2.10 моль/дм3
Пример 6. Вычислить рН 0,01 моль/дм3 раствора гидроксида аммония.
Р е ш е н и е. Для расчёта рН раствора слабого основания применяют формулу
рН = 14 - 1/2рКосн. + 1/2.lg cосн (5)
По справочнику рК(NH4OH) = 4,75;
рН = 14 - 1/2.4,75 + 1/2.lg0,01 = 14 - 2,37 - 1 = 10,63
О т в е т: рН = 10,63.
Пример 7. Вычислить рН 0,1 моль/дм3 раствора СН3COONH4.
Р е ш е н и е. Расчет производится по формуле для вычисления рН растворов солей, гидролизующихся по катиону и аниону:
pH = 1/2pK(H2O) + 1/2pKкисл. - 1/2pKосн (6)
Константы ионизации кислоты и основания, образующих соль, находят по справочнику: K(CH3COOH) = 1,74.10-5;
K(NH4OH) = 1,76.10-5
Следовательно, pH = 1/2.14 + 1/2.4,76 - 1/2.4,75 = 7,005
О т в е т: рН = 7,005
Пример 8.Рассчитать константу гидролиза (Кгидр),степень гидролиза
(h) и pH 0,1 моль/дм3, раствора роданида аммония.
Р е ш е н и е. NH4SCN -соль, образованная сильной кислотой и слабым основанием. К(NH4OH) = 1,76.10-5.
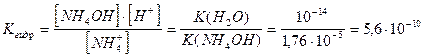
Степень гидролиза
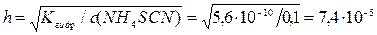
pH раствора соли, гидролизующейся по катиону, рассчитывается по формуле:
pH = 1/2pK(H2O) - 1/2pKосн - 1/2lg cосн (7)
Следовательно, pH = 1/2.14 - 1/2.4,75 - 1/2lg 0,1 = 5,12.
О т в е т: Kгидр.= 5,6.10-10;h = 7,4.10-5 или 0,0074 %; pH = 5,12.
Пример 9. Вычислить рН ацетатной буферной смеси, содержащей по
0,1 моль/дм3 СH3COOH и CH3COONa.
Р е ш е н и е. В общем виде уравнение для расчёта рН буферной смеси, состоящей из слабой кислоты и её соли, имеет вид:
pH = pKкисл. - lg(cкисл/ссоли). (8)
Для уксусной кислоты рКкисл = 4.76; следовательно,
рН = 4,76 - lg(0,1/0,1) = 4,76.
О т в е т: pH = 4,76.
Пример 10. Как изменится рН аммонийной буферной смеси, содержащей по 0,1 моль в 1 дм3 NH4OH и NH4Cl, при добавлении к 1 дм3 смеси 0,01 моль HCl.
Р е ш е н и е. Применяется формула для расчёта рН основной буферной смеси:
pH = 14 - pKосн + lg(cосн/ссоли) (9)
До прибавления соляной кислоты рН раствора
рН = 14 - 4,75 + lg(0,1/0,1) = 9,25
При добавлении 0,01 моль HCl c(NH4OH) уменьшается эквивалентно добавленной HCl до 0,09 моль/дм3, с(NH4Cl) увеличивается до 0,11моль/дм3.
рН = 14 - 4,75 + lg(0,09/0,11) = 9,15; ‑pH = 9,25 - 9,15.
О т в е т: pH уменьшится на 0,1.
Пример 11. Какова буферная ёмкость ацетатного буферного раствора по NaOH, содержащего по 0,1 моль/дм3 компонентов.
Р е ш е н и е. pH ацетатного буферного раствора указанного состава равен 4,76 (cм. пример 9). По определению буферной ёмкости рН раствора при добавлении NaOH должен увеличиться на 1. Это происходит за счёт изменения соотношения концентрации компонентов буферной смеси, которые увеличиваются или уменьшаются эквивалентно количеству добавленного NaOH (моль). Это количество, являющееся буферной ёмкостью, обозначим за Х. Тогда, в соответствии с формулой (8):
lg(c(CH3COOH) - X)/(c(CH3COONa) + X) = -1
Отсюда (с(СH3COOH) - X)/(c(CH3COONa + X) = 10-1 = 0,1. Решая уравнение относительно Х, находим Х = 0,082 моль.
О т в е т: буферная ёмкость раствора по NaOH равна 0,082 моль.