В Х г ¾¾¾¾¾¾¾¾¾¾ 37,8 г
4) Рассчитывают объём раствора с массовой долей HNO3- 30 % масс.
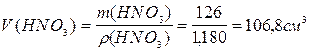
О т в е т: Необходимый объём раствора HNO3равен 106,8 см3.
З а д а ч а 4. Сколько граммов H2SO4содержится в 500 см3 раствора, если на титрование 25,00 см3 этого раствора расходуется 20,25 см3 раствора NaOH c молярной концентрацией эквивалента 0,1150 моль/дм3?
Р е ш е н и е. 1) Выясняют метод анализа и записывают реакцию. Эта задача относится к методу кислотно-основного титрования:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
f(H2SO4) = 1/2, M(1/2 H2SO4) = 1/2M(H2SO4) = 49,04 г/моль.
2) Рассчитывают молярную концентрацию эквивалента H2SO4, применяя закон эквивалентов (количество моль эквивалента серной кислоты должно равняться количеству моль эквивалента гидроксида натрия):
n(1/2 H2SO4) = n(1/1NaOH);
c(1/2 H2SO4) . V(H2SO4) = c(1/1NaOH) . V(NaOH)
откуда с(1/2 H2SO4) = 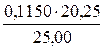 = 0,09315 моль/дм3
= 0,09315 моль/дм3
3) Находят титр раствора серной кислоты:
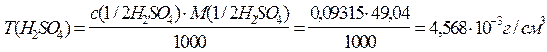
4) Вычисляют массу H2SO4 в 500 см3 раствора:
m(H2SO4) = T(H2SO4) . V = 4,568.10-3. 500 = 2,2840 г.
О т в е т: в 500 см3 раствора содежится 2,2840 г H2SO4.
З а д а ч а 5. Рассчитать массу перманганата калия в растворе, если после его замещения на I действием избытка KI и H2SO4 на титрование затрачено 24,50 см3 раствора тиосульфата натрия, титр которого равен 3,971.10-2г/см3.
Р е ш е н и е. Выясняют метод анализа и составляют реакции. Эта задача относится к редоксиметрическому титрованию (йодометрия), которое проводят по методу замещения. При взаимодействии KMnO4c раствором, содержащим избыток КI и H2SO4,происходит замещение KMnO4эквивалентным количеством I:
 2 MnO4- + 8H+ + 5е = Mn2+ + 4H2O
2 MnO4- + 8H+ + 5е = Mn2+ + 4H2O
5 2I- - 2е = I2
2MnO4- + 10I- + 16H+ = 2Mn2+ + 5I2 + 8H2O
n(1/5KMnO4) = n(1/2I2)
Затем выделившийся йод оттитровывают раствором Na2S2O3:
1 I2 + 2е = 2I-

1 2S2O32- - 2е = S4O62-
n(1/2I2) = n(1/1Na2S2O3)
Количество моль эквивалента KMnO4равно количеству моль эквивалента I, а последнее - количеству моль эквивалента Na2S2O3:
n(1/5KМnO4) = n(1/2I2) = n(1/1Na2S2O3)
При данном определении перманганат калия и тиосульфат натрия непосредственно друг с другом не реагируют, однако их количества эквивалентны, откуда
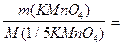 c(1/1 Na2S2O3).V(Na2S2O3)
c(1/1 Na2S2O3).V(Na2S2O3)
f(KMnO4) = 1/5, M(1/5KMnO4) = 1/5M(KMnO4) = 1/5.158 = 31,6г/моль
2) Вычисляют молярную концентрацию эквивалента раствора тиосульфата натрия по формуле:
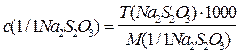
f(Na2S2O3) = 1, M(1/1 Na2S2O3) = M(Na2S2O3).
Поскольку в аналитической практике, как правило, применяют пентагидрат тиосульфата натрия, M(Na2S2O3.5H O) = 248,19 г/моль.
с(1/1 Na2S2O3) = 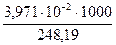 = 0,1600 моль/дм3.
= 0,1600 моль/дм3.
3) Рассчитывают массу перманганата калия по формуле:
m(KMnO4) = c(1/1 Na2S2O3).V(Na2S2O3).M(1/5KMnO4)
m(KMnO4) = 0,1600.0,245.31,60 = 0,1238 г.
О т в е т: масса перманганата калия равна 0,1238 г.
З а д а ч а 6. Вычислить массовую долю кальция в навеске массой 0,3959 г, если на её титрирование после растворения израсходовано 15,00 см3 раствора ЭДТА с молярной концентрацией эквивалента 0,1000 моль/дм3.
Р е ш е н и е. 1) Эта задача относится к методу комплексонометрического титрования, которое проводят по методу отдельно взятых навесок:
Ca2+ + H2Y2- = CaY2- + 2H+
f(Ca2+) = 1, M(1/1Ca2+) = M(Ca2+)
n(Ca2+) = n(Na2H2Y)
2) Вычисляют массу кальция, содержащуюся в навеске:
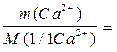 c(1/1Na H Y).V(Na H Y)
c(1/1Na H Y).V(Na H Y)
m(Ca2+) = 0,1000.0,0150.40,08 = 0,0600 г.
3) Рассчитывают массовую долю кальция в навеске:
0,3959 г ¾¾¾¾¾ 100 %
0,0600 г ¾¾¾¾¾ X %
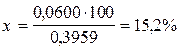
О т в е т: массовая доля кальция в навеске составляет 15,2 %.