Процесс превращения веществ в активном центре лакказы, можно условно разбить на два этапа. К первому этапу можно отнести реакции, связанные с восстановлением ионов двухвалентной меди в активном центре фермента, за счет переноса электронов от субстрата. Классическими субстратами лакказы являются двухатомные фенолы с орто- и пара- расположением гидроксильных групп. Однако она с высокой скоростью катализирует окисление и других фенолов, ароматических аминов, аскорбиновой кислоты, целого ряда сложных гетероциклических соединений. Общую схему этого процесса на примере пирокатехина можно представить реакциями (3.1) или (3.2).
| (3.1) | |
| (3.2) |
Согласно реакции (3.1) на первом этапе четыре электрона, необходимые для дальнейшего восстановления кислорода до воды, переносятся от 4 молекул многоатомного фенола к ионам меди (II). В этом случае первичными продуктами лакказного окисления будут соответствующие арилоксильные или в отдельных случаях семихинонные радикалы.
В водной среде нейтральные формы этих радикалов диссоциируют по реакции (3.3) и равновесные концентрации их нейтральных и анионных форм определяются значениями pKa и величиной pH. Например, pKa для семихинонного радикала пирокатехина составляет 5.0 [54] и, следовательно, при pH 4.6  »2.5. Существенным является то, что восстанавливающая способность анион-радикалов значительно выше, чем их нейтральных форм.
»2.5. Существенным является то, что восстанавливающая способность анион-радикалов значительно выше, чем их нейтральных форм.
| (3.3) |
Если арилоксильные радикалы выходят из сферы активного центра фермента, то возможны дополнительные неферментативные реакции с их участием. Тогда роль лакказы сводится к инициированию радикального окисления субстрата и восстановлению молекулярного кислорода непосредственно в активном центре фермента, возможно и без образования его токсичных форм. В частности, подтверждением реализации такого механизма является возможность использования этого энзима в синтезе полимеров из фенолов и ароматических аминов [60].
По реакции (3.2) каждая молекула двухатомного фенола отдает два электрона, превращаясь в хинон. В этом случае высокой аффинностью к активному центру фермента обладает и двухатомный фенол, и его семихинонный радикал. То есть, если имеется возможность в реакционной смеси генерировать химическими или физическими методами семихинонные радикалы, то они также будут субстратами лакказы, превращаясь в активном центре по реакции (3.4).
| (3.4) |
Второй этап – четырехэлектронное восстановление молекулярного кислорода, которое за пределами активного центра лакказы можно представить в следующем виде:
То есть, в общем виде получаем:
Происходит этот процесс в активном центре через указанные интермедиаты или нет, может ли происходить утечка активных форм кислорода и семихинонных радикалов – до конца не ясно.
Автоокисление многоатомных фенолов в водно-щелочных средах с pH выше 7.4 при 308 К сопровождается хемилюминесценцией, которая отсутствует для большинства фенолов при pH <7.0 [56, 57]. Механизм этого процесса радикальный, а эмиттером ХЛ-свечения является соответствующий хинон, который как показано при окислении гидрохинона, образуется в электронно-возбужденном состоянии по реакции (3.5) [58, 59].
| (3.5) |
Наиболее высокая интенсивность ХЛ в ряду двух- и трехатомных фенолов наблюдается при автоокислении пирогаллола. Поэтому это соединение было испытано с целью обнаружения свечения в реакции ферментативного окисления. Хемилюминесцентное свечение было обнаружено при лакказном окислении пирогаллола в фосфатном буфере при pH 5.8 и 4.6 (рис. 3.1 и рис. 3.2). Вид ХЛ кривых при лакказном и неинициированном окислении пирогаллола кислородом похожий (рис. 3.3). Слабое ХЛ-свечение возникает сразу после смешения лакказы и пирогаллола в реакционной системе и остается постоянным в периоде индукции. По завершению периода индукции оно резко возрастает и затем, минуя экстремум, медленно снижается (рис. 3.2).
Интенсивность ХЛ-свечения повышается, а период индукции снижается с увеличением количества лакказы в реакционной смеси (рис. 3.4).
Рис. 3.1 Кинетические кривые хемилюминесценции в реакции лакказного окисления пирогаллола молекулярным кислородом.
Фосфатный буфер pH 5.8, 308 K, [Пирогаллол]0=0.5 мМ.
[E]0: 1. – 10 мг/л; 2. – 20 мг/л.

Рис. 3.2 Кинетические кривые хемилюминесценции в реакции лакказного окисления пирогаллола молекулярным кислородом.
Фосфатный буфер pH 4.6, 308 K, [Пирогаллол]0=0.5 мМ.
[E]0: 1. – 10 мг/л; 2. – 40 мг/л.
Рис. 3.3 Кинетические кривые хемилюминесценции в реакции ферментативного (1) и автоокисления (2) пирогаллола.
1. – [S]0=0.5 мМ, фосфатный буфер pH 5.8, [E]0=20 мг/л;
2. - [S]0=0.5 мМ, карбонатный буфер pH 9.2, без лакказы.


Рис. 3.4 Зависимость максимальной интенсивности хемилюминесценции (1) и периода индукции (2) от концентрации фермента в реакции лакказного окисления пирогаллола кислородом.
Фосфатный буфер pH 5.8, 308 K, [Пирогаллол]0=0.5 мМ.
Также была проведена серия опытов в которых варьировали концентрацией пирогаллола при постоянной концентрации фермента. В этом случае интенсивность ХЛ-свечения и период индукции повышаются с увеличением количества пирогаллола в реакционной смеси (рис. 3.5).


Рис. 3.5 Зависимость максимальной интенсивности хемилюминесценции (а) и периода индукции (б) от концентрации пирогаллола в реакции его лакказного окисления кислородом.
Фосфатный буфер pH 5.8, 308 K, [Е]0=10 мг/л.
Кинетические закономерности реакции лакказного окисления пирогаллола сохраняются при переходе от pH 5.8 к 4.6. Так, величины периодов индукции при варьировании концентрации лакказы изменяются симбатно при переходе от pH 5.8 к 4.6 (рис. 3.6). Это может указывать на то, что механизм образования эмиттера ХЛ-свечения при ферментативном окислении пирогаллола не изменяется при переходе от одного значения pH к другому.
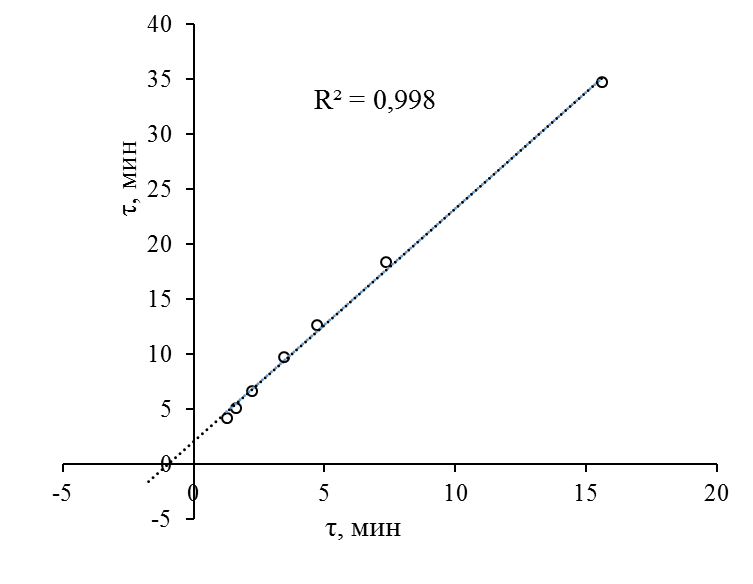
Рис. 3.6 Соотношение периодов индукции в реакции ферментативного окисления пирогаллола кислородом при варьировании концентрации лакказы в фосфатных буферных растворах при pH 5.8 (по оси ординат) и 4.6 (по оси абцисс).
[Пирогаллол]=0,5 мМ, 308 К.
Интенсивность ХЛ будет пропорциональна скорости реакции образования эмиттера и, следовательно, любой фактор, который обуславливает изменение квазистационарных концентраций радикалов-реактантов этой реакции приводит к усилению или уменьшению свечения. Таким образом, повышение Imax и интенсивности ХЛ-свечения в периоде индукции с концентрацией лакказы (рис. 3.2) можно объяснить увеличением скорости генерирования семихинонных радикалов пирогаллола. Введение в реакционную среду ABTS+•-радикала будет приводить к прямому или опосредованному повышению концентраций семихинонных и пероксидных радикалов, также повышая интенсивность ХЛ, что и наблюдается в эксперименте (рис. 3.7). Характер влияния катион-радикала на интенсивность ХЛ, то есть всплеск свечения после его введения, свидетельствует в пользу радикального механизма процесса. Общая длительность свечения после всплеска и до момента достижения начальной величины Imax относительно протяженная (6 мин). Известно, что АБТС является медиатором лакказы, которая катализирует его превращение в АБТС+• [60]. В этом случае может возникать редокс-цикл:
O2 + 4АБТС  2H2O + 4АБТС+•,
2H2O + 4АБТС+•,
АБТС+• + QH3  АБТС + QH∸ + 2H+,
АБТС + QH∸ + 2H+,
наличие которого обуславливает длительное поддержание увеличенной интенсивности ХЛ-свечения после введения АБТС+• (рис 3.7).
Рис. 3.7 Влияние АБТС+•-радикала на хемилюминесцентное свечение в реакции лакказного окисления пирогаллола молекулярным кислородом.
Фосфатный буфер pH 5.8, 308 K, [Пирогаллол]0=0.5 мМ, [E]0=20 мг/л, [ABTS+•]0=0.036 мМ. Время ввода радикала обозначено стрелкой.
Полученные с помощью ХЛ-метода данные указывают на высокую вероятность одноэлектронного окисления пирогаллола на ионах Cu (II) лакказы, с образованием соответствующих семихинонных радикалов и выходом их из сферы активного центра в среду. Дальнейшие неферментативные реакции последних, в том числе и с молекулярным кислородом, приводят к образованию дополнительных активных интермедиатов, обуславливая также протекание реакции, ответственной за хемилюминесценцию. Реакции ферментативного и неферментативного превращения пирогаллола можно представить схемой 3.1.
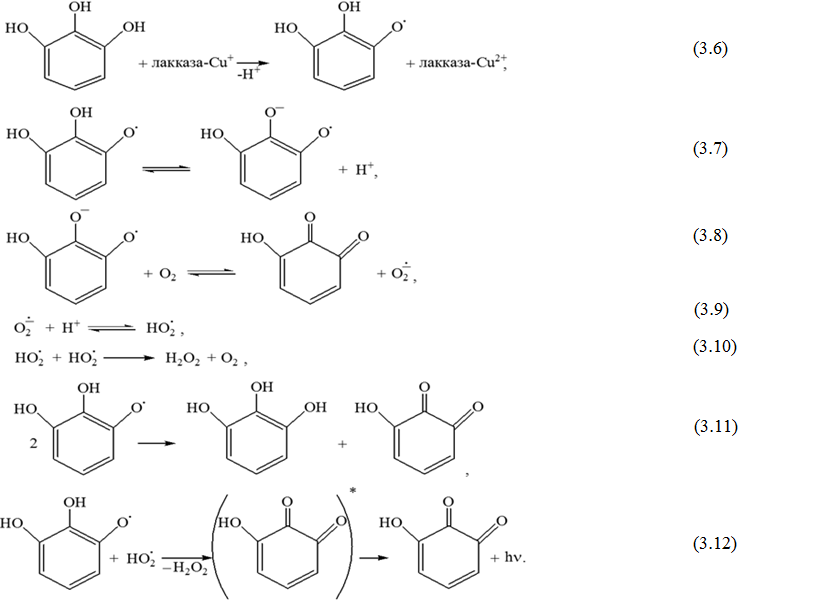
Схема 3.1 Предполагаемый механизм возникновения ХЛ-свечения при лакказном окислении пирогаллола молекулярным кислородом.
Как видно на рис. 3.8, ХЛ-свечение начинает повышаться после завершения периода индукции, когда по времени примерно 50% пирогаллола израсходовалось. Это можно попытаться объяснить следующим образом. По мере увеличения в реакционной смеси 3-гидрокси-1,2-бензохинона повышается скорость реакции (3.13). Протекание этой реакции обуславливает образование семихинонных радикалов пирогаллола неферментативным путем. Закономерное повышение скорости реакции (3.13) будет приводить к увеличению квазистационарных концентраций указанного выше семихинонного радикала. Это обстоятельство способствует смещению равновесия (3.8) и увеличению квазистационарной концентрации супероксиданион-радикала. Временное увеличение концентраций •QH2 и  приводит к закономерному повышению скорости реакции (3.12), а, следовательно, усилению ХЛ-свечения. То есть, по-видимому, представленный на схеме 3.1 механизм объясняет причины возникновения слабого постоянного по интенсивности ХЛ-свечения в периоде индукции. А его повышение по завершению последнего объясняется увеличением скорости реакции (3.13).
приводит к закономерному повышению скорости реакции (3.12), а, следовательно, усилению ХЛ-свечения. То есть, по-видимому, представленный на схеме 3.1 механизм объясняет причины возникновения слабого постоянного по интенсивности ХЛ-свечения в периоде индукции. А его повышение по завершению последнего объясняется увеличением скорости реакции (3.13).

| (3.13) |
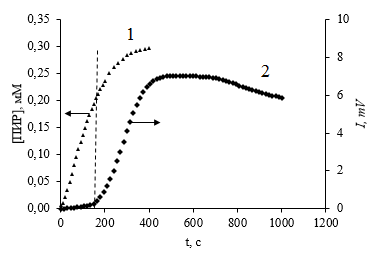
Рис. 3.8 Кинетические кривые накопления 3-гидрокси-1,2-бензохинона (1) и хемилюминесценции (2) в реакции лакказного окисления пирогаллола кислородом. [ПИР]0=0.5 мМ; [Е]0=20 мг/л; 308 К; pH 4.6
1. - Цитратный буфер; 2. - Фосфатный буфер.
ВЫВОДЫ
1. Впервые обнаружена хемилюминесценция в процессе лакказного окисления многоатомных фенолов молекулярным кислородом. Изучено влияние на кинетику ХЛ-свечения концентрации пирогаллола и лакказы, pH буферного раствора.
2. Полученные экспериментальные данные указывают на то, элементарные реакции превращения пирогаллола реализуются как в активном центре фермента, так и за его пределами. Механизм процесса – радикальный.
3. Предложен механизм возникновения ХЛ-свечения при окислении многоатомных фенолов молекулярным кислородом в присутствии лакказы на примере реакции окисления пирогаллола.
4. Получены подтверждения того, что механизм возникновения хемилюминесценции не зависит от pH среды.
5. 2,2'-азинобис-(3-этилбензотиазолин-6-сульфонат) выступает в качестве медиатора процесса лакказного окисления пирогаллола.