Решение типовых задач
Пример 5.1. Найдите массу AlCl3, необходимую для приготов-ления 2 л (2·10-3 м3) раствора с массовой долей хлорида алюминия равной 12 %. Плотность раствора 1090 кг/м3. Вычислите молярную концентрацию эквивалента, молярную концентрацию, моляльность и титр этого раствора.
Р е ш е н и е
1. Определяем молярную массу и молярную массу эквивалента AlCl3
М (AlCl3) = 133,34 г/моль, Э (AlCl3) = 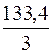 ≈ 44,45 г/моль.
≈ 44,45 г/моль. 
2. Находим массу AlCl3, необходимую для приготовления 2 л его раствора с массовой долей 12 %. Массовая доля ω показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
Масса раствора равна произведению объема раствора (V) на его плотность (ρ)
m = 2·10-3 м3 · 1090 кг/м3 = 2,18 кг.
В 100 кг раствора содержится 12 кг AlCl3.
В2,18 кг раствора содержится х кг AlCl3,
 .
.
3. Находим молярную концентрацию раствора. Молярная концентрация раствора с М показывает количество растворенного вещества, содержащегося в 1 л раствора.
В 2 л раствора содержится 261,6 г AlCl3.
В 1 л раствора содержится х г AlCl3,
х =  г.
г.
Молярная концентрация равна
с (AlCl3) =  моль/л.
моль/л.
4. Находим молярную концентрацию эквивалента. Молярная концентрация эквивалента (нормальная концентрация) раствора показывает число молярных масс эквивалентов растворенного вещества, содержащихся в 1 л раствора.
c экв.(AlCl3) =  .
.
5. Находим моляльность раствора. Моляльность раствора cm (моль/кг) показывает количество растворенного вещества, находя-щееся в 1 кг растворителя.
Масса воды равна 2180 г – 261,6 г = 1918,4 г.
Количество AlCl3 равно  .
.
В 1918,4 г Н2О растворено 1,96 моль AlCl3.
В 1000 г Н2О растворено х моль AlCl3,
x = cm =  = 1,02 моль/кг.
= 1,02 моль/кг.
6. Находим титр раствора. Титр раствора Т показывает массу (г) растворенного вещества, содержащегося в 1 мл раствора. В 1 л раствора содержится 130,8 г AlCl3.
Т =  = 0,1308 г/мл.
= 0,1308 г/мл.
Пример 5.2. Напишите уравнение электролитической диссо-циации муравьиной кислоты и найдите концентрации ионов Н+ и НСОО  в моль/л в растворе, молярность которого равна 0,01, если константа диссоциации К дисс = 1,8·10-4.
в моль/л в растворе, молярность которого равна 0,01, если константа диссоциации К дисс = 1,8·10-4.
Р е ш е н и е
НСООН  Н+ + НСОО
Н+ + НСОО  .
.
С ион = С · α · n, где С – молярная концентрация электролита; α – степень диссоциации; n – число ионов данного вида.
Степень диссоциации приближенно находим из выражения упрощенного закона Оствальда
α = 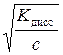

 0,01·1,34· 10-1·1 = 1,34·10-3 моль/л.
0,01·1,34· 10-1·1 = 1,34·10-3 моль/л.
Пример 5.3. Вычислите водородный показатель (рН) раствора соляной кислоты HCl, содержащей 0,0365 г HCl в 100 мл раствора (1) и раствора гидроксида калия КОН, содержащего 0,056 г КОН в 100 мл раствора (2), α = 1 для обоих растворов.
Р е ш е н и е
1. Находим концентрацию раствора НСl в молях. Молярная масса НСl равна 36,5 г/моль.
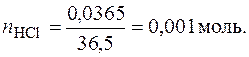
Находим молярную концентрацию раствора НСl.
В 100 мл раствора содержится 0,001 моль НСl,
в 1000 мл раствора содержится х моль НСl,
х = 0,01 моль
Концентрация HCl (с HCl) равна 0,01 моль/л.
Концентрация Н+ – ионов равна 0,01 моль/л.
рН раствора рассчитываем по формуле
рН = –lg c  = –lg 0,01 = –lg 10-2 = 2.
= –lg 0,01 = –lg 10-2 = 2.
2. Находим число молей КОН в 100 мл данного раствора. Молярная масса КОН равна 56 г/моль.

Находим, сколько молей КОН содержится в 1 л раствора.
В 100 мл раствора содержится 0,001 моль КОН.
В 1000 мл раствора содержится х моль КОН,
х = 0,01 моль.
Концентрация КОН (с КОН) равна 0,01 моль/л.
Концентрация ОН  - ионов равна с КОН = 0,01 моль/л.
- ионов равна с КОН = 0,01 моль/л.
Концентрация Н+ - ионов равна 10-14/ с ОН- = 10-14/10-2 = 10-12 моль/л.
рН раствора рассчитываем по формуле
рН = –lg c  = –lg 10-12 = 12.
= –lg 10-12 = 12.
Пример 5.4. Составьте молекулярные и ионные уравнения гидролиза солей: а) нитрата аммония NH4NO3; б) сульфита лития Li2SO3; в) ацетата алюминия Al(CH3COO)3; напишите выражение для константы гидролиза и оцените рН среды.
Р е ш е н и е
а) При растворении в воде соль NH4NO3 диссоциирует
NH4NO3 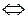 NH
NH  + NO
+ NO  .
.
Ионы воды (Н+ и ОН 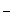 ) в малодиссоциирующее соединение связывает ион NH
) в малодиссоциирующее соединение связывает ион NH  , образуя молекулы слабого основания NH4OH.
, образуя молекулы слабого основания NH4OH.
Ионное уравнение гидролиза NH4NO3
NH  + Н2O
+ Н2O  NH4OH + H+.
NH4OH + H+.

где  – константа диссоциации NH4OH.
– константа диссоциации NH4OH.
Уравнение гидролиза в молекулярной форме
NH4NO3 + Н2О 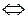 NH4OH + HNO3.
NH4OH + HNO3.
Реакция среды кислая, рН < 7.
б) Сульфит лития при растворении в воде диссоциирует
Li2SO3 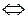 2Li+ + SO
2Li+ + SO 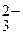 .
.
Ионы SO  связывают Н+ - ионы воды ступенчато, образуя кислые ионы HSO
связывают Н+ - ионы воды ступенчато, образуя кислые ионы HSO  и молекулы слабой кислоты H2SO3. Практически гидролиз соли ограничивается первой ступенью
и молекулы слабой кислоты H2SO3. Практически гидролиз соли ограничивается первой ступенью
SO  + H2O
+ H2O 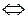 HSO
HSO  + OH
+ OH 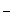 ,
,
Li2SO3 + H2O 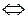 LiHSO3 + LiOH.
LiHSO3 + LiOH.
 .
.
Реакция раствора щелочная, рН > 7.
в) Соль ацетата алюминия диссоциирует, образуя ионы
Al(CH3COO)3 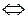 Al3+ + 3CH3COO
Al3+ + 3CH3COO  .
.
Ионы Al3+ и ион СН3СОО  взаимодействуют с ионами воды, образуя малорастворимое соединение Al(OH)3 и малодис-социирующее соединение СН3СООН. Соли, образованные при взаи-модействии слабой кислоты и слабого основания, гидролизуются необратимо и полностью.
взаимодействуют с ионами воды, образуя малорастворимое соединение Al(OH)3 и малодис-социирующее соединение СН3СООН. Соли, образованные при взаи-модействии слабой кислоты и слабого основания, гидролизуются необратимо и полностью.
Al(CH3COO)3 + 3H2O = Al(OH)3  + 3CH3COOH.
+ 3CH3COOH.
 .
.
рН раствора Al(CH3COO)3 зависит от соотношения  и
и  . Из табл.П. 6 следует, что
. Из табл.П. 6 следует, что  <
<  , следовательно, реакция среды кислая.
, следовательно, реакция среды кислая.
Пример 5.5. Образуется ли осадок труднорастворимого соединения CaSO4, если смешать равные объемы растворов Ca(NO3)2 и K2SO4 с молярной концентрацией 0,003 моль/л?
Р е ш е н и е
При смешении равных объемов растворов объем стал в 2 раза больше, а концентрация каждого из растворенных веществ уменьшилась вдвое, т. е.
с (Ca(NO3)2) = 1,5·10-3 моль/л; c (K2SO4) = 1,5·10-3 моль/л.
Концентрации ионов Са2+ и SO  cоответственно равны
cоответственно равны
c (Ca2+) = 1,5·10-3 моль/л; c (SO  ) = 1,5·10-3 моль/л;
) = 1,5·10-3 моль/л;
ПР (CaSO4) = [Ca2+]·[SO  ] = 6,1· 10-5.
] = 6,1· 10-5.
Находим произведение концентраций ионов Са2+ и SO 
c (Ca2+)· c (SO 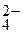 ) = 1,5·10-3 x 1,5·10-3 = 2,25·10-6.
) = 1,5·10-3 x 1,5·10-3 = 2,25·10-6.
2,25·10-6 < ПР(CaSO4) = 6,1· 10-5, т.е. осадок CaSO4 не образуется.
Задачи
5.1. Найдите массу соли, необходимую для приготовления раствора объемом V л с массовой долей ω. Плотность раствора ρ. Вычислите молярную концентрацию эквивалента, молярную концентрацию, моляльность и титр этого раствора.
Т а б л и ц а 5.1
| Вариант | Соль | V, л | ω, % | ρ, кг/м3 |
| AlCl3 | 0,5 | |||
| AgNO3 | 1,5 | |||
| AgNO3 | 0,8 | |||
| Al2(SO4)3 | 0,8 | |||
| Al2(SO4)3 | 1,5 | |||
| BaCl2 | 3,0 | |||
| BaCl2 | 0,3 | |||
| CaCl2 | 0,5 | |||
| CaCl2 | 0,9 | |||
| CuSO4 | 2,5 | |||
| CuSO4 | 0,65 | |||
| FeCl3 | 0,9 | |||
| FeCl3 | 1,7 | |||
| FeSO4 | 1,5 | |||
| FeSO4 | 3,5 | |||
| 1’ | K2CO3 | 2,0 | ||
| 2’ | K2CO3 | 0,6 | ||
| 3’ | CuCl2 | 2,5 | ||
| 4’ | CuCl2 | 0,4 | ||
| 5’ | K2SO4 | 3,0 | ||
| 6’ | K2SO4 | 1,2 | ||
| 7’ | MgSO4 | 4,0 | ||
| 8’ | MgSO4 | 1,6 | ||
| 9’ | Na2CO3 | 0,5 | ||
| 10’ | Na2CO3 | 3,5 | ||
| 11’ | Na2SO4 | 3,5 | ||
| 12’ | Na2SO4 | 1,7 | ||
| 13’ | Pb(NO3)2 | 1,5 | ||
| 14’ | Pb(NO3)2 | 2,5 | ||
| 15’ | Pb(NO3)2 | 0,5 |
5.2. Напишите уравнение электролитической диссоциации раствора слабой кислоты и найдите концентрации ионов Н+ и кислотного остатка в моль/л в растворе нормальной концентрации с, если известна константа диссоциации К дисс.
Т а б л и ц а 5.2
| Вариант | Формула кислоты | Название кислоты | с, моль/л | К дисс |
| НСООН | Муравьиная | 0,005 | 1,8·10-4 | |
| СН3СООН | Уксусная | 0,005 | 1,74·10-5 | |
| HNO2 | Азотистая | 0,05 | 5,1·10-4 | |
| С6Н5СООН | Бензойная | 0,05 | 6,6·10-5 | |
| HIO4 | Йодная | 0,005 | 2,8·10-2 | |
| HIO3 | Йодноватая | 0,001 | 1,6·10-1 | |
| HF | Плавиковая | 0,01 | 6,8·10-4 | |
| HCN | Синильная | 0,1 | 6,2·10-10 | |
| HBrO | Бромноватистая | 0,1 | 2,5·10-9 | |
| С2Н5СООН | Пропионовая | 0,01 | 1,35·10-5 | |
| HCNS | Роданисто-водородная | 0,001 | 1,4·10-1 | |
| C6H4(OH)COOH | Салициловая | 0,001 | 1,1·10-3 | |
| HClO2 | Хлористая | 0,001 | 1,1·10-2 | |
| HClO | Хлорноватистая | 0,05 | 5,0·10-8 | |
| HCNO | Циановая | 0,01 | 3,5·10-4 | |
| 1’ | HCOOH | Муравьиная | 0,02 | 1,8·10-4 |
| 2’ | CH3COOH | Уксусная | 0,01 | 1,74·10-5 |
| 3’ | HNO2 | Азотистая | 0,01 | 5,1·10-4 |
| 4’ | C6H5COOH | Бензойная | 0,01 | 6,6·10-5 |
| 5’ | HIO4 | Йодная | 1,0 | 2,8·10-2 |
| 6’ | HIO3 | Йодноватая | 2,0 | 1,6·10-1 |
| 7’ | HF | Плавиковая | 0,05 | 6,8·10-4 |
| 8’ | HCN | Синильная | 0,5 | 6,2·10-10 |
| 9’ | HBrO | Бромноватистая | 0,5 | 2,5·10-9 |
| 10’ | C2H5COOH | Пропионовая | 0,05 | 1,35·10-5 |
| 11’ | HCNS | Роданистово-дородная | 2,0 | 1,4·10-1 |
| 12’ | C6H4(OH)COOH | Салициловая | 1,0 | 1,1·10-3 |
| 13’ | HClO2 | Хлористая | 1,0 | 1,1·10-2 |
| 14’ | HClO | Хлорноватистая | 0,1 | 5,0·10-5 |
| 15’ | HCNO | Циановая | 0,05 | 3,5·10-4 |
5.3. Рассчитайте рНраствора соединения (кислоты или основания) и концентрации ионов Н+ и ОН  в растворе, содержащем m г соединения в объеме V мл раствора (a = 1).
в растворе, содержащем m г соединения в объеме V мл раствора (a = 1).
Т а б л и ц а 5.3
| Вариант | Соединение | V, мл | m, г |
| HCl | 1,46 | ||
| HCl | 0,365 | ||
| HCl | 0,73 | ||
| HCl | 0,365 | ||
| NaOH | 0,04 | ||
| NaOH | 0,02 | ||
| NaOH | 0,1 | ||
| NaOH | 0,40 | ||
| KOH | 0,56 | ||
| KOH | 0,112 | ||
| KOH | 0,112 | ||
| KOH | 1,12 | ||
| HI | 2,56 | ||
| HI | 0,256 | ||
| HI | 1,28 | ||
| 1’ | HI | 0,0256 | |
| 2’ | HBr | 1,62 | |
| 3’ | HBr | 0,81 | |
| 4’ | HBr | 0,81 | |
| 5’ | HBr | 0,162 | |
| 6’ | NaOH | 0,2 | |
| 7’ | NaOH | 0,4 | |
| 8’ | NaOH | 0,8 | |
| 9’ | NaOH | 6,0 | |
| 10’ | KOH | 8,4 | |
| 11’ | KOH | 2,8 | |
| 12’ | KOH | 1,68 | |
| 13’ | KOH | 0,28 | |
| 14’ | HCl | 1,46 | |
| 15’ | HCl | 0,73 |
5.4. Составьте ионное и молекулярное уравнения реакции гидролиза соли, выражение для константы гидролиза и оцените величину рН раствора.
Т а б л и ц а 5.4
| Вариант | Cоль | Вариант | Соль |
| AgNO3 | K2CO3 | ||
| AlCl3 | K2SO3 | ||
| CdBr2 | Na2CO3 | ||
| Al(NO3)3 | Na2SO3 | ||
| Cd(NO3)2 | Na2S | ||
| CoI2 | NaNO2 | ||
| (NH4)2S | Al2S3 | ||
| Co(NO3)2 | 1’ | CuCl2 | |
| 2’ | Cu(NO3)2 | 3’ | FeCl2 |
| 4’ | FeSO4 | 5’ | Fe(NO3)3 |
| 6’ | FeCl3 | 7’ | MnSO4 |
| 8’ | NH4NO3 | 9’ | K2S |
| 10’ | KNO2 | 11’ | NaCN |
| 12’ | KClO | 13’ | FeCO3 |
| 14’ | HCOOK | 15’ | CH3COONa |
5.5. Образуется ли осадок труднорастворимого соединения, если
смешать равные объемы растворов двух солей концентрацией с моль/л?
Т а б л и ц а 5.5
| Вариант | Соль I | Соль II | с, моль/л | Труднораство-римое соеди-нение | ПР соеди-нения |
| SrCl2 | K2SO4 | 0,002 | SrSO4 | 2,8·10-7 | |
| AgNO3 | NaBr | 0,001 | AgBr | 6,3·10-13 | |
| AgNO3 | K2CO3 | 0,001 | Ag2CO3 | 6,15·10-12 | |
| AgNO3 | KCl | 0,002 | AgCl | 1,56·10-10 | |
| AgNO3 | KI | 0,001 | AgI | 1,5·10-16 | |
| AgNO3 | Na3PO4 | 0,001 | Ag3PO4 | 1,8·10-18 | |
| AgNO3 | Na2S | 0,0001 | Ag2S | 5,7·10-51 | |
| AgNO3 | K2SO4 | 0,002 | Ag2SO4 | 7,7·10-5 | |
| BaCl2 | Na2CO3 | 0,001 | BaCO3 | 7,0·10-9 | |
| Ba(NO3)2 | Na2CrO4 | 0,002 | BaCrO4 | 2,3·10-10 | |
| BaCl2 | K2SO4 | 0,002 | BaSO4 | 1,08·10-10 | |
| CaCl2 | K2CO3 | 0,001 | CaCO3 | 4,8·10-9 | |
| Ca(NO3)2 | Na3PO4 | 0,002 | Ca3(PO4)2 | 1,0·10-25 | |
| CaCl2 | Na2SO4 | 0,001 | CaSO4 | 6,1·10-5 | |
| Cd(NO3)2 | Na2S | 0,001 | CdS | 7,9·10-27 | |
| 1’ | CuCl2 | K2CrO4 | 0,001 | CuCrO4 | 3,6·10-6 |
| 2’ | Cu(NO3)2 | K2S | 0,001 | CuS | 4,0·10-38 |
| 3’ | FeCl2 | Na2S | 0,0001 | FeS | 3,7·10-19 |
| 4’ | MgCl2 | Na2S | 0,001 | MgS | 2,0·10-15 |
| 5’ | MgCl2 | K2CO3 | 0,002 | MgCO3 | 4,0·10-5 |
| 6’ | Pb(NO3)2 | K2CO3 | 0,001 | PbCO3 | 1,5·10-13 |
| 7’ | Pb(NO3)2 | NaCl | 0,002 | PbCl2 | 1,7·10-5 |
| 8’ | Mn(NO3)2 | Na2S | 0,001 | MnS | 2,5·10-13 |
| 9’ | NiCl2 | KIO3 | 0,002 | Ni(IO3)2 | 1,4·10-8 |
| 10’ | Ni(NO3)2 | K2S | 0,001 | NiS | 3,2·10-19 |
| 11’ | Pb(NO3)2 | NaBr | 0,001 | PbBr2 | 9,1·10-6 |
| 12’ | SrCl2 | K2CO3 | 0,002 | SrCO3 | 9,42·10-10 |
| 13’ | Sr(NO3)2 | Na2SO4 | 0,001 | SrSO4 | 3,2·10-7 |
| 14’ | Zn(NO3)2 | K2S | 0,001 | ZnS | 1,6·10-24 |
| 15’ | Sr(NO3)2 | NaF | 0,001 | SrF2 | 2,5·10-9 |
ОСНОВЫЭЛЕКТРОХИМИИ
Решение типовых задач
Пример 6.1. Для данного окислительно-восстановительного процесса: а) составьте реакции окисления и восстановления; б) ука-жите окислитель и восстановитель; в) составьте сокращенное ионное и полное молекулярное уравнения ионно-электронным методом; г) покажите переход электронов; д) рассчитайте E  и D G
и D G  ; е) укажите возможное направление протекания реакции; ж) составьте гальванический элемент на основе данной реакции.
; е) укажите возможное направление протекания реакции; ж) составьте гальванический элемент на основе данной реакции.
Дана схема окислительно-восстановительного процесса
KMnO4 + K2SO3 + KOH  K2MnO4 + K2SO4 + H2O.
K2MnO4 + K2SO4 + H2O.
Р е ш е н и е
По приведенной схеме делаем вывод, что процесс протекает в щелочной среде (присутствует КОН, рН > 7). Находим степени окисления всех элементов данной схемы:

 .
.
Составляем возможные уравнения реакций окисления и восстановления, находим значения их стандартных электродных потенциалов:
SO  + 2OH + 2OH  =
SO =
SO  +H2O+2 +H2O+2 
| окисле-ние | восста- новитель |  φ φ 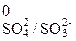 =
= –0,93 В =
= –0,93 В
| |
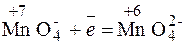
| восста- новление | окисли- тель | φ 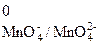 =
= 0,564 В =
= 0,564 В
|
Составляем сокращенное ионное уравнение процесса и показываем переход электронов:


 .
.

2 
Переходим к полному молекулярному уравнению, показываем переход электронов:


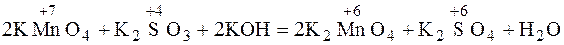 .
.

2 
Рассчитываем  и
и  данной реакции:
данной реакции:
Е  = φ
= φ  - φ
- φ  = φ
= φ 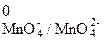 - φ
- φ  =
=
= 0,564 – (–0,93) = 1,494 В.
 = - zF
= - zF  = –2 · 96500 · 1,494 · 10-3 = –288,31
= –2 · 96500 · 1,494 · 10-3 = –288,31 
Поскольку φ  > φ
> φ  , или 0,564 > –0,93, или
, или 0,564 > –0,93, или  то реакция протекает слева направо. Это подтверждает и последующий расчет, по которому
то реакция протекает слева направо. Это подтверждает и последующий расчет, по которому 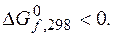 Поэтому схему, приведенную в условии задачи, следует переписать, поменяв между собой правую и левую части, получив уже составленное нами уравнение.
Поэтому схему, приведенную в условии задачи, следует переписать, поменяв между собой правую и левую части, получив уже составленное нами уравнение.
Переход электронов от восстановителя к окислителю можно осуществить как при сливании вместе растворов KMnO4, K2SO3 в щелочной среде (растворе КОН), так и через внешнюю цепь. В данном случае надо составить гальванический элемент с инертными, например, графитовыми электродами:
 (–) С | K2SO3, KOH, H2O || KMnO4, KOH, H2O | C (+).
(–) С | K2SO3, KOH, H2O || KMnO4, KOH, H2O | C (+).
При наличии внешней цепи начнется составленная выше окислительно-восстановительная реакция. Ее отличие от процесса в растворе: переход электронов от восстановителя к окислителю осуществляется через внешнюю цепь, а не непосредственно; окисление и восстановление протекают в разных сосудах, разделенных друг от друга диафрагмой.
Пример 6.2. Составьте схему работы гальванического элемента, образованного двумя данными металлами, погруженными в растворы солей с известными активностями ионов, рассчитайте ЭДС этого элемента и  .
.
Дано: Zn; Pb; растворы ZnSO4 и Pb(NO3)2; 
Р е ш е н и е
Равновесие для первого электрода Zn | ZnSO4 (0,01 M).
Токообразующая реакция Zn2+ + 2  = Zn0.
= Zn0.
φ  = φ
= φ  +
+  lg
lg  = –0,763 +
= –0,763 +  lg0,01 =
lg0,01 =
= – 0,822 B.
Аналогично, для второго электрода Pb | Pb(NO3)2 (0,001 M).
Токообразующая реакция Pb2+ + 2  = Pb0.
= Pb0.
φ 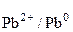 = φ
= φ 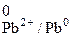 +
+  lg
lg  = –0,126 +
= –0,126 +  lg 0,001 =
lg 0,001 =
= –0,2145 B.
При составлении гальванического элемента более отрицательным электродом будет система Zn | Zn2+, более положи-тельным – Pb | Pb2+. Схема гальванического элемента примет следующий вид
(–) Zn | ZnSO4 (0,01 M) || Pb(NO3)2 (0,001 M) | Pb (+).
При наличии внешней цепи на электродах протекают следующие реакции
Zn0 = Zn+2 + 2 
| окисление | восста- новитель | Анод | |
Pb2+ + 2  = Pb0 = Pb0
| восста- новление | окисли- тель | Катод |

 Реакция в элементе в целом Zn0 + Pb2+ = Zn2+ + Pb0.
Реакция в элементе в целом Zn0 + Pb2+ = Zn2+ + Pb0.

2 
Электродвижущая сила этого элемента может быть рассчитана как по ранее определенным электродным потенциалам, так и непосредственно.
1 вариант E 298 = φкатода – φанода = φ 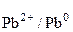 – φ
– φ  =
=
= – 0,2145 – (– 0,822) = 0,6075 В.
2 вариант
E 298 = φ 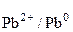 – φ
– φ  = φ
= φ 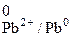 +
+  lg
lg  – φ
– φ  –
–
–  lg
lg 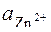 = (φ
= (φ 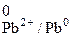 –φ
–φ  ) +
) +  lg
lg  = (– 0,126 –
= (– 0,126 –
– (–0,763)) +  lg
lg  = 0,6075 B.
= 0,6075 B.
Если бы в условии были заданы металлы в разных степенях окисления, то следовало бы использовать величины количеств электронов z 1, z 2.
Пример 6.3. При электролизе раствора данной соли металла током I, A, масса катода возросла на m грамм. Учитывая, что выход по току металла B i, %, рассчитайте, какое количество электричества и в течение какого времени пропущено. Составьте схему электролиза.
Дано: CoSO4; I = 1,25 A; m = 1,0883 г; B i = 72 %.
Р е ш е н и е
Составляем схему электролиза с нерастворимым анодом. Электрохимическая система имеет следующий вид
(–) Fe | CoSO4, H2O | Ti (+).
В качестве покрываемого металла выбрано железо; нерастворимого анода – титан.
В растворе присутствуют следующие ионы и молекулы
CoSO4 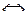 Co2+ + SO
Co2+ + SO  (электролитическая диссоциация);
(электролитическая диссоциация);
CoSO4 + 2H2O = Co(OH)2 + H2SO4 (гидролиз);
Со2+ + 2Н2О = Со(ОН)2  + 2Н+, рН < 7, среда кислая.
+ 2Н+, рН < 7, среда кислая.
Следовательно, при составлении схемы электролиза надо учитывать ионы Со2+, SO 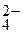 , Н+, молекулы СоSO4, H2O, Co(OH)2.
, Н+, молекулы СоSO4, H2O, Co(OH)2.
Реакции на электродах
А: 2Н2О = О2 + 4Н+ + 4  ;
;
К: Со2+ + 2  = Со0; 2Н+ + 2
= Со0; 2Н+ + 2  = Н2.
= Н2.
Из-за выделения водорода на катоде совместно с восстановлением ионов Со(II) выход по току металла меньше 100 %.
Схема электролиза водного раствора CoSO4 с нерастворимым анодом:
CoSO4
Катод Анод



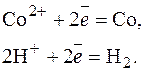
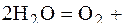 + 4
+ 4  .+ 4
.+ 4  .
.
Далее составляем схему электролиза с растворимым анодом. Электрохимическая система:
(–) Fe | CoSO4, H2O | Co (+).
Реакции на электродах:
А:2Со0 = 2Со2+ + 4  .
.
К:Со2+ + 2  = Со0,
= Со0,
2Н+ + 2  = Н2.
= Н2.
Схема электролиза водного раствора СоSO4 c растворимым анодом:
CoSO4
Катод Анод


 Со2+ + 2
Со2+ + 2  = Со0,
= Со0,
2Н+ + 2  = Н2. 2Со0 = 2
= Н2. 2Со0 = 2  + 4
+ 4  .
.
Количество электричества по закону Фарадея составит

Оно пропущено в течение времени t:
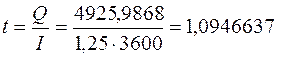 ч ≈ 1,1 ч.
ч ≈ 1,1 ч.
Задачи
6.1. Для данного окислительно-восстановительного процесса:
а) составьте реакции окисления и восстановления; б) укажите окислитель и восстановитель; в) составьте сокращенное ионное и полное молекулярное уравнения ионно-электронным методом; г) покажите переход электронов; д) рассчитайте 
е) укажите возможное направление протекания процесса;
ж) составьте гальванический элемент на основе данной реакции.
Т а б л и ц а 6.1
| Вариант | Реакция | |||
H2O2 + KMnO4 + H2SO4  MnSO4 + K2SO4 + O2 + H2O MnSO4 + K2SO4 + O2 + H2O
| ||||
NaNO2 + NaI + H2SO4  NO + I2 + Na2SO4 + H2O NO + I2 + Na2SO4 + H2O
| ||||
NaI + H2SO4 + MnO2  NaHSO4 + H2O + I2 + MnSO4 NaHSO4 + H2O + I2 + MnSO4
| ||||
MnSO4 + S + K2SO4 + H2O  KMnO4 + H2S + H2SO4 KMnO4 + H2S + H2SO4
| ||||
K2SO4+ Cr2(SO4)3+ Fe2(SO4)3+ H2O  K2Cr2O7+H2SO4+FeSO4 K2Cr2O7+H2SO4+FeSO4
| ||||
KCl + Fe2(SO4)3 + H2O  KClO3 + FeSO4 + H2SO4 KClO3 + FeSO4 + H2SO4
| ||||
FeCl3 + MnCl2 + KCl + H2O  FeCl2 + KMnO4 + HCl FeCl2 + KMnO4 + HCl
| ||||
K2SO4 + Cr2(SO4)3 + H2O  K2Cr2O7 + H2SO4 + SO2 K2Cr2O7 + H2SO4 + SO2
| ||||
K2Cr2O7 + H2S + H2SO4  Cr2(SO4)3 + S + K2SO4 + H2O Cr2(SO4)3 + S + K2SO4 + H2O
| ||||
K2SO4 + I2 + NO2 + H2O  KI + HNO3 + H2SO4 KI + HNO3 + H2SO4
| ||||
Fe2(SO4)3 + NO + H2O  FeSO4 + HNO3 + H2SO4 FeSO4 + HNO3 + H2SO4
| ||||
MnSO4+Br2+Na2SO4+K2SO4 + H2O  KMnO4 + NaBr + H2SO4 KMnO4 + NaBr + H2SO4
| ||||
HMnO4 + Pb(NO3)2 + H2O  PbO2 + Mn(NO3)2 + HNO3 PbO2 + Mn(NO3)2 + HNO3
| ||||
KCl + NaCl + H2O + CO2  KClO3 + Na2C2O4 + HCl KClO3 + Na2C2O4 + HCl
| ||||
Na2C2O4+KMnO4+H2SO4  MnSO4+K2SO4+Na2SO3+H2O+CO2 MnSO4+K2SO4+Na2SO3+H2O+CO2
| ||||
| 1’ | K2MnO4 + O2 + H2O  KMnO4 + H2O2 + KOH KMnO4 + H2O2 + KOH
| |||
| 2’ | MnCl2 + Cl2 + KCl + H2O  KMnO4 + HCl KMnO4 + HCl
| |||
| 3’ | HNO2 + KMnO4 + H2SO4  HNO3 + MnSO4 + K2SO4 + H2O HNO3 + MnSO4 + K2SO4 + H2O
| |||
| 4’ | PbSO4 + ZnSO4 + H2O  PbO2 + H2SO4 + Zn PbO2 + H2SO4 + Zn
| |||
| 5’ | Al2(SO4)3+Cr2(SO4)3+K2SO4+H2O  Al+K2Cr2O7+H2SO4 Al+K2Cr2O7+H2SO4
| |||
| 6’ | K2CrO4 + KBr +H2O + KCl  CrCl3 + Br2 + KOH CrCl3 + Br2 + KOH
| |||
| 7’ | Na2SO4 + I2 + K2SO4 + H2O  Na2SO3 + KIO3 + H2SO4 Na2SO3 + KIO3 + H2SO4
| |||
| 8’ | Na2SO4 + Ag + NaNO3 + H2O  Na2SO3 + AgNO3 + NaOH Na2SO3 + AgNO3 + NaOH
| |||
| 9’ | KI + KNO2 + H2SO4  I2 + NO + K2SO4 + H2O I2 + NO + K2SO4 + H2O
| |||
| 10’ | CO2 + MnSO4 + H2O
Поиск по сайту©2015-2026 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование. Дата создания страницы: 2019-03-02 Нарушение авторских прав и Нарушение персональных данных |
Поиск по сайту: Читайте также: Деталирование сборочного чертежа Когда производственнику особенно важно наличие гибких производственных мощностей? Собственные движения и пространственные скорости звезд |