Решение типовых задач
Пример 3.1. Реакция горения протекает по уравнению
СН4 (г) + 2О2 (г) = СО2 (г) + 2Н2О (ж) + 890,31 кДж
Вычислите, сколько теплоты выделится при сгорании 100 л (н.у.) углеводорода?
Р е ш е н и е
В термохимическом уравнении дано значение стандартной энтальпии сгорания  , то есть тепловой эффект реакции окисления 1 моля (22,4 л) газообразного метана (СН4). 100 л газа в нормальных условиях (н.у.) соответствуют
, то есть тепловой эффект реакции окисления 1 моля (22,4 л) газообразного метана (СН4). 100 л газа в нормальных условиях (н.у.) соответствуют  молям газа, следовательно, при сгорании 100 л газа выделится
молям газа, следовательно, при сгорании 100 л газа выделится  кДж теплоты (зависимостью Δ Н от температуры пренебречь).
кДж теплоты (зависимостью Δ Н от температуры пренебречь).
Пример 3.1*. При соединении 27 г алюминия с кислородом выделилось 836,8 кДж теплоты. Определите энтальпию образования оксида алюминия (Al2O3).
Р е ш е н и е
Энтальпией образования сложного соединения называется тепловой эффект образования 1 моля этого соединения из простых веществ, взятых в устойчивом состоянии при заданных условиях, то есть для получения 1 моля Al2O3 необходимо 2 моля атомов Al, что составляет 54 г.
По условию задачи:
при соединении 27 г алюминия выделится 836,8 кДж,
при соединении 54 г алюминия выделится Q кДж,
 кДж/моль,
кДж/моль,
 = – 1673,6 кДж/моль.
= – 1673,6 кДж/моль.
Пример 3.2. Вычислите  (кДж),
(кДж), 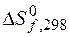 (Дж/К),
(Дж/К),  (кДж) для следующей реакции:
(кДж) для следующей реакции:
2СО (г) + 2Н2 (г) = СН4 (г) + СО2 (г).
Возможна ли реакция при Р = 1 атм и Т = 298 К? Вычислите темпе-ратуру равновесия реакции и константы равновесия при 298 и 1000 К.
Р е ш е н и е
По закону Гесса определяем  и
и  (термодина-мические параметры из табл.П.1).
(термодина-мические параметры из табл.П.1).
 =
=  = -247,35 кДж.
= -247,35 кДж.
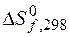 = -256,21 Дж/К.
= -256,21 Дж/К.
 определяем по второму закону термодинамики:
определяем по второму закону термодинамики:
 =
=  - 298·
- 298·  = –247,35 – 298·(–256,21) ·10-3 = = –170,99 кДж, т. е. реакция при 298 К термодинамически вероятна.
= –247,35 – 298·(–256,21) ·10-3 = = –170,99 кДж, т. е. реакция при 298 К термодинамически вероятна.
Температура равновесия реакции – это Т равн, когда 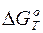 = 0.
= 0.

 Большое значение
Большое значение  свидетельствует о том, что в стандартных условиях идет практически только прямая реакция.
свидетельствует о том, что в стандартных условиях идет практически только прямая реакция.
К равн.при 1000 К определяем по формуле

Следовательно, при Т = 1000 К в равновесной смеси преобладают исходные вещества.
Ответ:  = –247,35 кДж;
= –247,35 кДж;  = –256 Дж/К;
= –256 Дж/К;
 = –170,99 кДж;
= –170,99 кДж;
Т равн. = 965 К;  = 1030;
= 1030;  = 0,34.
= 0,34.
Пример 3.3. Какое количество продуктов необходимо употре-бить в день в определенном массовом соотношении, чтобы удовлетворить суточную энергетическую потребность организма?
Продукты: макаронные изделия, телятина филе, морковь, сырковая масса, бананы; массовое соотношение продуктов 3:1:2:1:4.
Р е ш е н и е
По таблице калорийности пищи (табл. П.2) находим кало-рийность указанных продуктов: макаронные изделия – 330 ккал/100 г, телятина филе – 158 ккал/100 г, морковь – 33 ккал/100 г, сырковая масса – 207 ккал/100 г, бананы – 91 ккал/100 г. Так как массовое соотношение продуктов 3:1:2:1:4, то за единицу употребления пищи принимаем следующие значения: 300 г макаронных изделий, 100 г телятины, 200 г моркови, 100 г сырковой массы, 400 г бананов. При употреблении такого количества пищи вы будете получать следующее количество энергии (Q) (ккал):
Q = 330,3 + 158,1 + 33,2 + 207,1 + 91,4 = 1758 ккал.
Если вы юноша, то в среднем потребляйте Q ср. = 3300 ккал/сут, если девушка, то Q ср. = 2800 ккал/сут. Найдем коэффициент умножения продуктов (n)
n = Q ср./ Q.
Например, вы юноша, тогда n = 3300/1758 = 1,87 раза, значит вам необходимо умножить единицу потребления пищевых продуктов на величину 1,87, т. е. макаронных изделий необходимо употребить 300·1,87 = 561 г, телятины филе 100·1,87 = 187 г, моркови 200·1,87 = = 374 г, сырковой массы 100·1,87 = 187 г, бананов 400·1,87 = 748 г. Это то количество продуктов, которое вы должны употребить для удовлетворения суточной энергетической потребности организма, при определенном массовом соотношении данных продуктов.
Задачи
3.1. Вычислите, сколько тепла выделится при сгорании 100 л (н.у.) углеводорода. Реакция горения протекает по уравнению.
Т а б л и ц а 3.1
| Вариант | Уравнение |
| C2H6(г) + 3,5O2(г) = 2CO2(г) + 2H2O(ж) + 1559,88 кДж | |
| C2H2(г) + 2,5O2(г) = 2CO2(г) + H2O(ж) + 1299,63 кДж | |
| C2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(ж) + 1410,97 кДж | |
| C3H8(г) + 5O2(г) = 3CO2(г) + 4H2O(ж) + 2219,99 кДж | |
| C3H6(г) + 4,5O2(г) = 3CO2(г) + 3H2O(ж) + 2017,64 кДж | |
| C4H10(г) + 6,5O2(г) = 4CO2(г) + 5H2O(ж) + 3127,94 кДж | |
| C4H8(г) + 6O2(г) = 4CO2(г) + 4H2O(ж) + 2718,51 кДж | |
| C4H6(г) + 5,5O2(г) = 4CO2(г) + 3H2O(ж) + 2543,46 кДж | |
| C5H12(г) + 8O2(г) = 5CO2(г) + 6H2O(ж) + 3536,19 кДж | |
| C5H10(г) + 7,5O2(г) = 5CO2(г) + 5H2O(ж) + 3319,51 кДж | |
| C3H4(г) + 4O2(г) = 3CO2(г) + 2H2O(ж) + 1944,31 кДж | |
| C6H6(г) + 7,5O2(г) = 6CO2(г) + 3H2O(ж) + 2120,98 кДж | |
| C6H12(г) + 9O2(г) = 6CO2(г) + 6H2O(ж) + 2772,47 кДж | |
| C6H14(г) + 9,5O2(г) = 6CO2(г) + 7H2O(ж) + 3414,22 кДж | |
| C6H8(г) + 8O2(г) = 6CO2(г) + 4H2O(ж) + 2331,97 кДж |
3.1*.При соединении определенного количества вещества с кислородом выделилась теплота. Определите энтальпию образования оксидов.
Т а б л и ц а 3.1*.
| Вариант | Вещество | Масса, г | Выделенная теплота, кДж |
| 1’ | Al | 836,8 | |
| 2’ | B | 27,5 | 1569,0 |
| 3’ | P | 6192,3 | |
| 4’ | Fe | 4100,3 | |
| 5’ | Si | 2,8 | 87,2 |
| 6’ | Li | 1190,8 | |
| 7’ | Ca | 2538,9 | |
| 8’ | Fe | 539,7 | |
| 9’ | S | 1485,3 | |
| 10’ | Na | 416,3 | |
| 11’ | K | 780,0 | |
| 12’ | Cr | 285,3 | |
| 13’ | Zn | 40,2 | |
| 14’ | Ca | 14,0 | |
| 15’ | Mg | 300,5 |
3.2. Вычислите D Н  (кДж/моль), D S
(кДж/моль), D S  (Дж/моль·К), D G
(Дж/моль·К), D G  (кДж/моль) для нижеуказанных реакций. Возможна ли реакция при Р = 1атм и Т = 298 К?
(кДж/моль) для нижеуказанных реакций. Возможна ли реакция при Р = 1атм и Т = 298 К?
Определите температуру равновесия реакции и константы равновесия при 298 и 1000 К. О чем свидетельствуют значения Т равн. и К равн.?
Т а б л и ц а 3.2
| Вариант | Уравнения реакций |
| 2CН3Cl (г) + 3O2 (г) = 2CO2 (г) + 2H2O (ж)+ 2HCl(г) | |
| CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (г) | |
| COCl2 (г) = CO (г) + Cl2 (г) | |
| CO (г) + H2O (г) = CO2 (г) + H2 (г) | |
| 2H2S (г) + 3O2 = 2H2O (ж) + 2SO2 (г) | |
| 2CH3OH (ж) + 3O2 (г) = 4H2O (ж) + 2CO2 (г) | |
| 4HCl (г) + O2 (г) = 2Cl2 (г) + 2H2O (г) | |
| CaCO3 (к) + HCl (ж) = CaCl2 (ж) + CO2 (г)+ Н2О(ж) | |
| FеО (к) + Н2 (г) = Fе (к) + Н2О (г) | |
| 3Fе2О3 (к) + Н2 (г) = 2Fе3O4 (к) + Н2О (г) | |
| Fе2О3 (к) + 3Н2 (г) = 2Fе (к) + 3Н2О (г) | |
| Fе3О4 (к) + 4Н2 (г) = 3Fе (к) + 4Н2О (г) | |
| Fе3О4 (к) + Н2 (г) = 3FеО (к) + Н2О (г) | |
| СО (г) + 2Н2 (г) = СН3ОН (г) | |
| СО(г) + 3Н2 (г) = СН4 (г) + Н2О (г) | |
| 1’ | 2NH3 (г) = N2H4 (г) + H2 (г) |
| 2’ | MgО (к) + H2 (г) = Mg (к) + H2O (ж) |
| 3’ | C + 2 N2O = CO2 + 2 N2 |
| 4’ | 4NH3 (г) + 3O2 (г) = 2N2 (г) +6H2O (ж) |
| 5’ | SO2 (г) + CO2 (г) = SO3 (г) + CO (г) |
| 6’ | 4NH3 (г) + 5O2 (г) = 4NO (г) + 6H2O (г) |
| 7’ | 2Cl2 (г) + O2 (г) = 2Cl2O (г) |
| 8’ | 2ZnS (к) + 3O2 (г) = 2ZnO (к) + 2SO2 (г) |
| 9’ | CaO (к) + 3C (граф) = CaC2 (к) + CO (г) |
| 10’ | CH4 (г) + Cl2 (г) = CH3Cl (г) + HCl (г) |
| 11’ | H2S (г) + Cl2 (г) = 2HCl (г) + S (к) |
| 12’ | H2S (г) + I2 (г) = 2HI (г) + S (к) |
| 13’ | PCl5 (г) = PCl3 (г) + Cl2 (г) |
| 14’ | Al2O3 (к) + 3SO3 (г) = Al2(SO4)3 (к) |
| 15’ | 2H2S (г) + O2 (г) = 2H2O (г) + 2S (к) |
3.3. Какое количество продуктов необходимо употребить в день при определенном массовом соотношении, чтобы удовлетворить суточную энергетическую потребность организма? (Для расчетов пользуйтесь таблицей калорийности пищевых продуктов, значения которой приведены в ккал/100 г). Суточная норма в ккал студентов: мужчины – 3300 ккал/сут, женщины – 2800 ккал/сут.
Т а б л и ц а 3.3
| Вариант | Продукты | Массовое соотношение продуктов |
| Картофельное пюре: говядина фарш: шпинат: сыр голландский: хлеб белый | 4:1:2:1:2 | |
| Баклажаны: баранина грудинка: салат: сыр рокфор: хлеб ржаной | 5:2:3:2:2 | |
| Макароны: камбала: редис: грецкие орехи: апельсины | 4:1:3:2:3 | |
| Картофель фри: судак: брюссельская капуста: орехи фундук: брусника | 5:2:3:1:4 | |
| Кабачки: телятина грудинка: сельдерей: сгущенное молоко с сахаром: хлеб ржаной | 3:2:2:1:2 | |
| Картофельные клецки: окунь: спаржа: орехи миндаль: йогурт 3,5 % | 3:1:3:1:3 | |
| Овсяная каша: щука: маслята: масло сливочное: булочка | 4:2:2:1:3 | |
| Шлифованный рис: ветчина: салат цикорий: сыр с грибами: бананы | 5:2:2:3:4 | |
| Крупа гречневая: курица: фасоль стручковая: сыр швейцарский: абрикосы | 3:2:3:1:4 | |
| Крупа манная: гусь: кольраби: орехи фисташки: земляника | 2:2:3:1:4 | |
| Фасоль: утка: перец сладкий: сливки 20 % жирности: персики | 2:3:3:2:5 | |
| Горох: свинина шейка: щавель: кефир жирный: чернослив | 3:1:4:2:2 | |
| Кукурузные хлопья: свинина отбивная на косточке: каштаны: овечий сыр: слива свежая | 4:2:2:1:3 | |
| Мюсли: индейка: зеленый горошек: плавленый сыр: клюква | 5:2:3:3:6 | |
| Макаронные изделия: говядина нежирное жаркое: ревень: сыр пармезан: ананас | 3:2:3:2:4 | |
| 1’ | Картофельне клецки: олений окорок: огурцы свежие: cметана 25 % жирности: грейпфрут | 3:2:2:1:2 |
| 2’ | Картофельное пюре: говядина печень: фенхель: сырковая масса: дыня | 3:1:3:1:3 |
| 3’ | Рис шлифованный: телятина спинная часть: красная капуста: йогурт 1,5 %: дыня | 3:2:3:1:4 |
| 4’ | Репа: заяц: брокколи: простокваша обезжиренная: киви | 2:2:3:1:4 |
| 5’ | Перловая каша: окорок кабана: корни сельдерея: орехи грецкие: крыжовник | 2:3:3:2:5 |
| 6’ | Пшенная каша: сардельки: белая фасоль: напиток из какао: смородина красная | 3:1:4:2:2 |
| 7’ | Хлеб ржаной: сосиски: савойская капуста: сыр российский: смородина черная | 3:2:3:2:4 |
| 8’ | Фасоль: вяленое мясо: кольраби: творог 20 % жирности: арбуз | 4:2:2:1:3 |
| 9’ | Картофель фри: сервелат: редька: орехи фундук: урюк | 5:2:3:3:6 |
| 10’ | Макаронные изделия: салями: клюква: сыр рокфор: изюм | 4:2:2:1:3 |
| 11’ | Картофельное пюре: сало: белый гриб: творог нежирный: виноград свежий | 5:2:2:3:4 |
| 12’ | Тыква: языковая колбаса: цуккини: молоко цельное: груша | 4:1:2:1:2 |
| 13’ | Рис: колбаса любительская: томаты: орехи миндаль: абрикосы | 5:2:3:2:2 |
| 14’ | Салат: фазан: брокколи: йогурт 3,5 %: рябина | 4:1:3:2:3 |
| 15’ | Тыква: свинина шницель: фасоль стручковая: сыр честер: черешня | 5:2:3:1:4 |