Решение типовых задач
Пример 8.1. Составьте уравнение реакции, протекающей при химической коррозии данного металла, рассчитайте  по таблицам
по таблицам  выберите металл, которым можно легировать данный металл.
выберите металл, которым можно легировать данный металл.
Дано: Fe, Fe2O3; T = 500 K. Начальное давление кислорода 
Р е ш е н и е
Для расчета используем табличные данные о зависимости упругости паров различных оксидов от температуры (табл.П. 7). Вначале дадим характеристику процесса.
При химической коррозии данного металла протекает следующая реакция
2Fe (т) + 3/2О2 (г) = Fe2O3 (т).

Отсюда следует, что металл стоек, так как значение  находится в пределах, обеспечивающих антикоррозионную защиту (α = 1÷2,5)
находится в пределах, обеспечивающих антикоррозионную защиту (α = 1÷2,5)
Вместе с тем, поскольку эта величина ближе к границам защитных значений, чем к их середине (α = 1,75±0,75) защиту следует считать относительной.
Величину  рассчитаем по формуле изотермы Вант-Гоффа, которая применительно к рассматриваемой реакции примет вид
рассчитаем по формуле изотермы Вант-Гоффа, которая применительно к рассматриваемой реакции примет вид

где  константа равновесия при температуре Т.
константа равновесия при температуре Т.
 .
.
По табл. П. 7 находим упругость диссоциации Fe2O3 при 500 К

Затем рассчитываем  :
:
 = 2,303·8,3144·500·lg[(101325)-3/2 × ×(1,013·10-45)3/2] = –646238,91 Дж/моль
= 2,303·8,3144·500·lg[(101325)-3/2 × ×(1,013·10-45)3/2] = –646238,91 Дж/моль  – 646,3 кДж/моль < 0.
– 646,3 кДж/моль < 0.
Так как  < 0, реакция может протекать слева направо самопроизвольно при Т = 500 К.
< 0, реакция может протекать слева направо самопроизвольно при Т = 500 К.
При выборе металла для легирования железа исходим из условия защиты
 оксида легирующего металла <
оксида легирующего металла <  оксида основы.
оксида основы.
Для железа при 298 К это алюминий


Пример 8.2. Напишите уравнения электрохимических реакций и уравнения реакций побочных процессов при коррозии данного металла с водородной деполяризацией. Укажите термодинамическую возможность коррозионного процесса. Рассчитайте разность потенциалов под током при коррозии с учетом перенапряжений.
Дано: Fe; pH < 7; pH  7.
7.
Р е ш е н и е
Анодная реакция Fe0 – 2 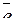 = Fe2+.
= Fe2+.
Полярность анода со стороны внешней цепи ( , со стороны электролита (+), процесс – окисление металла.
, со стороны электролита (+), процесс – окисление металла.
Катодные реакции
при рН < 7 2Н+ + 2  = Н2; при рН
= Н2; при рН  7 2Н2О + 2
7 2Н2О + 2  = 2ОН
= 2ОН  + Н2.
+ Н2.
Полярность катода со стороны внешней цепи (+), со стороны электролита  , процесс – восстановление окислителя.
, процесс – восстановление окислителя.
Побочные реакции
Fe2+ + 2OH  = Fe(OH)2
= Fe(OH)2  ;
;
2Fe(OH)2 + ½ O2 + H2O = 2Fe(OH)3  .
.
При дальнейших превращениях образуются сложные гидратированные оксиды – ржавчина FeO·Fe2O3· n H2O.
Термодинамическая возможность коррозии рассчитывается, исходя из стандартных электродных потенциалов
 (при рН = 7);
(при рН = 7); 
 (при рН < 7);
(при рН < 7);  (при рН > 7, точнее рН = 14).
(при рН > 7, точнее рН = 14).
При рН < 7
 =
=  –
–  = 0 – (–0,44) = 0,44 B > 0.
= 0 – (–0,44) = 0,44 B > 0.

Так как  реакция коррозии в кислой среде термодинамически возможна.
реакция коррозии в кислой среде термодинамически возможна.
Термодинамическая возможность коррозии рассчитывается, исходя из стандартных электродных потенциалов
 (при рН=7);
(при рН=7); 
 (при рН< 7);
(при рН< 7);
 (при рН > 7, точнее рН = 14).
(при рН > 7, точнее рН = 14).
При рН < 7  =
=  –
–  = 0 – (–0,44) = 0,44 B > 0.
= 0 – (–0,44) = 0,44 B > 0.

Так как  реакция коррозии в кислой среде термодинамически возможна.
реакция коррозии в кислой среде термодинамически возможна.
При рН = 7  = –0,414 – (–0,44) = 0,026 B > 0;
= –0,414 – (–0,44) = 0,026 B > 0;

Так как  то процесс возможен и в нейтральной среде.
то процесс возможен и в нейтральной среде.
При рН > 7 (точнее при рН=14)
 =
=  –
–  = –0,83 – (–0,44) = –0,39 B < 0.
= –0,83 – (–0,44) = –0,39 B < 0.
 = –2·96500· (–0,39)·10-3 = 75,3 кДж/моль > 0.
= –2·96500· (–0,39)·10-3 = 75,3 кДж/моль > 0.
Так как  то при рН > 7 процесс термоди-намически невозможен. Однако о его реальной возможности можно судить только с учетом кинетических данных.
то при рН > 7 процесс термоди-намически невозможен. Однако о его реальной возможности можно судить только с учетом кинетических данных.
Расчет разности потенциалов под током при коррозии проводится с учетом кинетики процессов.
При рН < 7 

 ;
;  (на Fe) = 0,2 B.
(на Fe) = 0,2 B.

= (0 – 0,2) – (- 0,44 + 0,01) = 0,23 B > 0.
Так как Е > 0, то процесс при рН < 7 кинетически возможен.
При рН = 7  ;
; 

 (на Fe) = 0,1 B.
(на Fe) = 0,1 B.
 (- 0,414 – 0,01) – (- 0,440 + 0,010) = 0,006 В > 0.
(- 0,414 – 0,01) – (- 0,440 + 0,010) = 0,006 В > 0.
Так как Е > 0, то в нейтральной среде возможно незначи-тельное (из-за малой величины Е) окисление железа.
Пример 8.3. Напишите уравнения электрохимических реакций и реакций побочных процессов при коррозии данного металла с кислородной деполяризацией. Укажите термодинамическую возможность коррозионного процесса. Рассчитайте разность потенциалов под током при рН < 7; рН  7.
7.
Дано: железо (Fe).
Р е ш е н и е
Анодная реакция Fe0 = Fe2+ + 2  ;
;
Катодные реакции при рН < 7 О2 + 4Н+ + 4  = 2Н2О;
= 2Н2О;
при рН  О2 + 2Н2О + 4
О2 + 2Н2О + 4  = 4ОН¯.
= 4ОН¯.
Побочные реакции описаны в предыдущем примере. Находим табличные данные 

рН < 7 (pH = 0); 
 (на Fe) = 0,3 B;
(на Fe) = 0,3 B;
pH = 7 
 (на Fe) = 0,6 B;
(на Fe) = 0,6 B;
pH > 7 (pH=14) 
 (на Fe) = 0,6 B.
(на Fe) = 0,6 B.
Термодинамическая возможность
pН < 7  1,229 – (–0,440) = 1,669 В > 0;
1,229 – (–0,440) = 1,669 В > 0;
4 

реакция 2Fe0 + O2 + 4H+ = 2Fe2+ + 2H2O;
 = –644,234
= –644,234 
При рН < 7 процесс возможен.
рН = 7  0,815 – (- 0,440) = 1,255 В > 0;
0,815 – (- 0,440) = 1,255 В > 0;
4 

реакция 2Fe0 + O2 + 2Н2О = 2Fe2+ + 4ОН¯;
 = - 484,43
= - 484,43 
При рН = 7 процесс возможен.
рН > 7  0,400 – (- 0,440) = 0,84 В > 0;
0,400 – (- 0,440) = 0,84 В > 0;
 = – 324,24
= – 324,24 
При рН > 7 процесс возможен.
Расчет разности потенциалов под током проводим с учетом перенапряжений
рН < 7 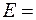 (1,229 – 0,300) – (–0,44 + 0,01) = 1,359 В > 0;
(1,229 – 0,300) – (–0,44 + 0,01) = 1,359 В > 0;
рН = 7 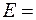 (0,815 – 0,6) – (–0,44 + 0,01) = 0,645 В > 0;
(0,815 – 0,6) – (–0,44 + 0,01) = 0,645 В > 0;
рН > 7 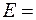 (0,400 – 0,6) – (–0,44 + 0,01) = 0,230 В > 0.
(0,400 – 0,6) – (–0,44 + 0,01) = 0,230 В > 0.
Таким образом, коррозия железа кинетически возможна во всех рассматриваемых средах.
Пример 8.4. Выберите условия для защиты данного металла следующими способами: 1) катодной протекторной защитой; 2) ка-тодной защитой внешним током; 3) анодной защитой внешним током. Для каждого случая составьте уравнения реакций на электродах с указанием вторичных процессов.
Дано: железо (Fe); рН < 7.
Р е ш е н и е
Исходя из стандартных электродных потенциалов 
 выбираем в качестве протектора более отрицательный металл – магний.
выбираем в качестве протектора более отрицательный металл – магний.
1) Для катодной протекторной защиты (или сокращенно «про-текторной защиты») составляем схему

Электролит с рН < 7
Катод: Анод:
Fe0; 2H+ + 2  = H2; Mg0 = Mg2+ + 2
= H2; Mg0 = Mg2+ + 2 
(электрохимическая
реакция);
Mg0 + H2O = MgO + H2
(частичное саморастворение –
– потери металла)
Для обеспечения защиты устанавливаем ток в цепи (I), отвечающий плотности защитного тока: 
 .
.
В случае такого высокоотрицательного протектора как магний реализуется преимущественно процесс с водородной деполяризацией. При сдвиге рН к нейтральным значениям на железе может параллельно незначительно ионизироваться кислород:
О2 + 4Н+ + 4  = 2Н2О.
= 2Н2О.
При близком размещении протектора и защищаемого металла из-за выделения водорода рН может сместиться в щелочную сторону и при рН = 8,5 начаться вторичная реакция:
Mg2+ + 2H2O = Mg(OH)2 + 2H+.
Поскольку магний пассивируется в нейтральной и основной сре-дах, надежная защита от коррозии обеспечивается лишь при рН < 7.
2) Для катодной защиты внешним током (или сокращенно «катодной защиты») составляем схему
|

|





Устанавливаем защитную плотность тока аналогично случаю протекторной защиты.
Возможные вторичные реакции: при рН > 5,5 на вспомогательном аноде возможна частичная пассивация, из-за чего он нуждается в периодическом удалении образующихся веществ, в частности, гидратированных оксидов – ржавчины (реакции приведены в примере 2).
3) Для анодной защиты внешним током (сокращенно «анодной защиты») составляем схему аналогично катодной защите, с тем различием, что защищаемый металл включается анодно (к положительному полюсу источника тока), а вспомогательный электрод – катодно (к отрицательному полюсу источника тока). Механизм защиты – металл пассивируется.
(+) Fe0 = Fe2+ + 2  ;
;
Fe2+ + 2OH¯ = Fe(OH)2 и процесс коррозии замедляется (идет пассивация);
(–) 2Н+ + 2  = Н2.
= Н2.
Вторичные реакции аналогичны описанным в примере 2. Метод более эффективен для нержавеющих сталей с добавками 13–18 % Cr или 18 % Cr, 9 % Ni. Плотность тока коррозии при пассивации невелика, что видно из графика
 lg i
lg i




I II IV

 III
III


На графике цифрами I – IV обозначены участки:
I – активное растворение (коррозия);
II – переходной режим;
III – пассивация (область защиты от коррозии);
IV – перепассивация – растворение в высших степенях окисления, например, Fe0 = Fe3+ + 3  (нет защиты).
(нет защиты).
Пример 8.5. Данный металл рассмотрите в контакте с другим в двух случаях: а) примесь другого металла; б) покрытие. Для случая (а) – примесь: укажите условия, когда коррозия ослабляется и когда усиливается; то же для покрытий (анодные и катодные покрытия). Рассчитайте разность потенциалов под током при коррозии, напишите уравнения реакций коррозионного разрушения, сделайте вывод об эффективности защиты или ее отсутствии.
Дано: Fe (основной металл) + Ni (примесь или покрытие);
вид деполяризации – водородная; рН < 7.
Р е ш е н и е
а) Рассмотрим коррозию железа, содержащего примесь никеля при рН < 7. 
По значениям равновесных потенциалов видно, что при коррозии анод – Fe, катод – Ni.
Уравнения возможных реакций
Анод (Fe): Fe0 = Fe2+ + 2  ;
;
Катод (Ni): 2H+ + 2  = H2.
= H2.
Для расчета Е выпишем дополнительные данные: 
 (на Ni) = 0,2 B;
(на Ni) = 0,2 B; 

 –
–  (на Ni)) – (
(на Ni)) – ( +
+  ) = (0 – – 0,2) – (–0,44 + 0,01) = 0,23 B > 0.
) = (0 – – 0,2) – (–0,44 + 0,01) = 0,23 B > 0.
Так как  процесс коррозии протекает, однако небольшая величина
процесс коррозии протекает, однако небольшая величина 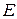 указывает, что его интенсивность невелика и при пассивации поверхности, например, никеля, когда
указывает, что его интенсивность невелика и при пассивации поверхности, например, никеля, когда  (на Ni) растет, коррозия прекращается. Включения никеля ведут к усилению коррозии железа. Поскольку за счет никеля добиваются новых свойств образующегося материала, то для защиты его от коррозии следует изолировать материал от агрессивной среды – нанести покрытия (металлические или лакокрасочные).
(на Ni) растет, коррозия прекращается. Включения никеля ведут к усилению коррозии железа. Поскольку за счет никеля добиваются новых свойств образующегося материала, то для защиты его от коррозии следует изолировать материал от агрессивной среды – нанести покрытия (металлические или лакокрасочные).
б) Рассмотрим второй случай, когда железо покрыто никелем. В покрытиях обычно есть поры или оно может иметь механические повреждения. В этом случае протекают реакции, указанные ранее.
Электролит


































 пора или
пора или






















 дефект Ni (покрытие)
дефект Ni (покрытие)
Fe (основа)
Защита такими покрытиями эффективна лишь при отсутствии пор и повреждений. Никель – катодное покрытие по отношению к железу (стали) и при повреждении покрытия ускоряется коррозия основы.
Для надежной защиты обычно используют двух- или трехслойные покрытия, в которых поры взаимно перекрываются: Fe + Cu – Ni; Fe + Cu – Ni – Cr. Слои меди и хрома небольшой толщины, но это оказывается достаточным как для высокой коррозионной стойкости покрытия, так и для новых свойств, например, износостойкости.
Задачи
8.1. Составьте уравнение реакции, протекающей при химической коррозии данного металла; рассчитайте α,  ; по таблицам
; по таблицам  выберите металл, которым можно легировать данный металл. Начальное давление кислорода
выберите металл, которым можно легировать данный металл. Начальное давление кислорода  101325 Па.
101325 Па.
Т а б л и ц а 8.1
| Вариант | Металл | Оксид | Т, К | Вариант | Металл | Оксид | Т, К |
| Fe | FeO | 1’ | Nb | Nb2O5 | |||
| Ag | Ag2O | 2’ | Cr | Cr2O3 | |||
| Cu | Cu2O | 3’ | Ta | Ta2O5 | |||
| Pb | PbO | 4’ | Ru | RuO2 | |||
| Ni | NiO | 5’ | W | WO3 | |||
| Zn | ZnO | 6’ | Fe | FeO | |||
| Al | Al2O3 | 7’ | Sc | Sc2O3 | |||
| V | V2O3 | 8’ | Tl | Tl2O3 | |||
| Ti | TiO2 | 9’ | Bi | Bi2O3 | |||
| Cu | CuO | 10’ | Co | CoO | |||
| Zr | ZrO2 | 11’ | Sb | Sb2O3 | |||
| Be | BeO | 12’ | Pd | PdO | |||
| Mg | MgO | 13’ | Mo | MoO3 | |||
| Sn | SnO2 | 14’ | Cd | CdO | |||
| In | In2O3 | 15’ | Ge | GeO2 |
8.2. Напишите электрохимические реакции и уравнения реакций побочных процессов при коррозии данного металла с водородной деполяризацией. Укажите термодинамическую возможность коррозионного процесса. Рассчитайте разность потенциалов под током при коррозии с учетом перенапряжений.
Т а б л и ц а 8.2
| Вариант | Металл | Среда | Вариант | Металл | Среда |
| Ni | pH<7 | 1’ | Y | pH<7 | |
| Mn | pH  7 7
| 2’ | Ni | pH  7 7
| |
| Al | pH<7,pH=7 | 3’ | Mn | pH<7 | |
| Zn | pH<7 | 4’ | Al | pH>7 | |
| Cr | pH<7 | 5’ | Zn | pH  7 7
| |
| Co | pH<7 | 6’ | Cr | pH  7 7
| |
| Cd | pH<7 | 7’ | Co | pH  7 7
| |
| In | pH<7 | 8’ | Cd | pH  7 7
| |
| Ga | pH<7,pH=7 | 9’ | In | pH>7 | |
| Hf | pH<7 | 10’ | Ga | pH>7 | |
| Mo | pH<7 | 11’ | Hf | pH  7 7
| |
| Nb | pH  7 7
| 12’ | Mo | pH  7 7
| |
| Ta | pH<7 | 13’ | Nb | pH<7 | |
| V | pH<7 | 14’ | Ta | pH  7 7
| |
| Ti | pH<7 | 15’ | V | pH  7 7
|
8.3. Напишите уравнения электрохимических реакций и реакций побочных процессов при коррозии данного металла с кислородной деполяризацией. Укажите термодинамическую возможность коррозионного процесса. Рассчитайте разность потенциалов под током при рН < 7; pH  7.
7.
Т а б л и ц а 8.3
| Вариант | Металл | Вариант | Металл |
| Ni | 1’ | Bi | |
| Mn | 2’ | Ga | |
| Ag | 3’ | Ge | |
| Al | 4’ | Hf | |
| Zn | 5’ | Ir | |
| Pb | 6’ | Mo | |
| Cr | 7’ | Nb | |
| Co | 8’ | Os | |
| Cd | 9’ | Rh | |
| Cu | 10’ | Ta | |
| Sn | 11’ | Tc | |
| Sb | 12’ | V | |
| Re | 13’ | Tl | |
| Pd | 14’ | Ti | |
| In | 15’ | Y |
8.4. Выберите условия для защиты данного металла следующими способами: 1) катодной протекторной защитой; 2) ка-тодной защитой внешним током; 3) анодной защитой внешним током. Для каждого случая составьте уравнения реакций на электродах с указанием вторичных процессов.
Т а б л и ц а 8.4
| Вариант | Металл | Среда | Вариант | Металл | Среда |
| Ni | рH<7 | 1’ | Ga | pH<7 | |
| Fe | рH  7 7
| 2’ | Ga | pH  7 7
| |
| Zn | рH<7 | 3’ | Ge | pH<7 | |
| Zn | рH  7 7
| 4’ | Ge | pH  7 7
| |
| Cr | рH<7 | 5’ | Tl | pH<7 | |
| Cr | рH  7 7
| 6’ | Tl | pH  7 7
| |
| Co | рH<7 | 7’ | Tc | pH<7 | |
| Co | рH  7 7
| 8’ | Tc | pH  7 7
| |
| Ni | рH  7 7
| 9’ | Rh | pH<7 | |
| Cd | pH<7 | 10’ | Rh | pH  7 7
| |
| Cd | pH  7 7
| 11’ | Os | pH<7 | |
| Sn | pH<7 | 12’ | Os | pH  7 7
| |
| Sn | pH  7 7
| 13’ | Mo | pH<7 | |
| In | pH<7 | 14’ | Mo | pH  7 7
| |
| In | pH  7 7
| 15’ | Bi | pH<7 |
8.5. Данный металл рассмотрите в контакте с другим в двух случаях: а) примесь другого металла; б) покрытие. Для случая (а) – примесь: укажите условия, когда коррозия ослабляется и когда усиливается. То же – для покрытий (катодные и анодные покрытия). Рассчитайте разность потенциалов под током при коррозии, напишите уравнения реакций коррозионного разрушения, сделайте вывод об эффективности защиты или ее отсутствии.
Т а б л и ц а 8.5
| Вариант | Металл | Примесь или покрытие | Деполяризация | Среда |
| Fe | Mn | Водородная | pH<7 | |
| Fe | Ag | Кислородная | рН  7 7
| |
| Ni | Mn | Водородная | pH<7 | |
| Ni | Ag | Кислородная | рН  7 7
| |
| Mn | Ag | Водородная | рН  7 7
| |
| Al | Cr | Водородная | рН  7 7
| |
| Zn | Cr | Водородная | pH<7 | |
| Cr | Co | Водородная | рН  7 7
| |
| Cr | Cd | Водородная | pH<7 | |
| Co | Cd | Водородная | рН  7 7
| |
| Co | Cu | Водородная | pH<7 | |
| Cd | Cu | Водородная | рН  7 7
| |
| Cd | Sn | Водородная | pH<7 | |
| Cd | Sb | Водородная | рН  7 7
| |
| Cu | Fe | Водородная | pH<7 | |
| 1’ | Cu | Mn | Водородная | pH<7 |
| 2’ | Fe | Re | Водородная | рН  7 7
|
| 3’ | Re | Pd | Кислородная | рН  7 7
|
| 4’ | Sn | In | Водородная | pH<7 |
| 5’ | Sn | Bi | Водородная | рН  7 7
|
| 6’ | Re | In | Водородная | pH<7 |
| 7’ | Pd | Ga | Водородная | рН  7 7
|
| 8’ | Bi | Ge | Кислородная | pH<7 |
| 9’ | Hf | Ir | Водородная | рН  7 7
|
| 10’ | Mo | Nb | Водородная | pH<7 |
| 11’ | Os | Rh | Кислородная | рН  7 7
|
| 12’ | Ta | Tl | Водородная | pH<7 |
| 13’ | V | Tl | Водородная | рН  7 7
|
| 14’ | Ti | Y | Водородная | pH<7 |
| 15’ | Mo | Mg | Водородная | рН  7 7
|
.