Ион: NO3¯
Реактив, условия: дифениламин (C6H5)2NH в H2SO4 (конц.)
Наблюдения: темно-синее окрашивание на стенках пробирки.
Ионы: МoO42-, WO42-, VO3¯
Реактив, условия: дифениламин (C6H5)2NH в H2SO4 (конц.)
Наблюдения: темно-синее окрашивание на стенках пробирки.
Ион: VO3¯
1. Реактив, условия: Н2O2, эфир. Уравнение реакции:
VO3¯ + Н2O2 = VO4¯ + Н2O
Наблюдения: окрашивание органической фазы в оранжевый цвет.
2. Реактив, условия: лигнин (газетная бумага)
Наблюдения: лигнин, содержащийся в газетной бумаге, восстанавливает ион VO3¯ до низших степеней окисления, которые окрашивают газетную бумагу в черно-зеленый цвет.
Ион: CH3COО¯
Реактив, условия: H2SO4 (конц.)
Уравнение реакции:
CH3COО¯ + Н+ = CH3COOH
Наблюдения: запах уксуса.
4. Количественный анализ
4.1. Титриметрический (объемный) анализ
Молярная концентрация сэ = nэ/V, где nэ – количество вещества эквивалентов, моль; V – объем раствора, л; единица измерения концентрации – моль/л.
Количество вещества эквивалента (nэ) nэ = m/Mэ = cэ V, где m – масса вещества, г; Mэ – молярная масса эквивалента, г/моль, V – объем раствора, л.
Закон эквивалентов: nэ(А) = nэ(В) или
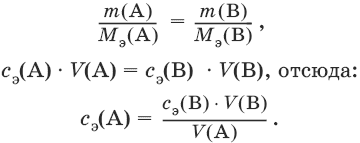
Титр – количество граммов растворенного вещества, содержащегося в 1 мл раствора.
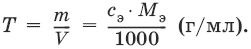
Титр по определяемому веществу – количество граммов определяемого вещества, которое реагирует с 1 мл титранта.
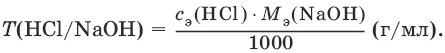
Прямое титрование – простейший прием титрования, заключающийся в том, что к определенному объему раствора определяемого вещества (А) по каплям приливают титрант (рабочий раствор) вещества (В).
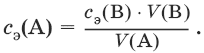
Обратное титрование – процесс титрования, при котором к определенному объему раствора определяемого вещества (А) приливают точно известный объем титранта (В1), взятого в избытке. Избыток не вошедшего в реакцию вещества (В1) оттитровывают раствором другого титранта (В2) точно известной концентрации.
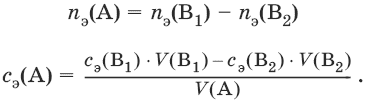
Заместительное титрование. Процесс титрования, при котором к определяемому веществу (А) прибавляют вспомогательное вещество (Р), реагирующее с ним с выделением эквивалентного количества нового вещества (А1), которое оттитровывают соответствующим титрантом (В). Таким образом, вместо непосредственного титрования определяемого вещества (А) титруют его заместитель (А1). Так как количества A и A1 эквивалентны, то количество вещества эквивалента определяемого вещества nэ(А) равно количеству вещества эквивалента титранта nэ(В):

4.2. Метод нейтрализации
Уравнение реакции: Н+ + OH¯ → Н2O или Н3O+ + OH¯ → 2Н2O.
Основные титранты (рабочие растворы): растворы сильных кислот (HCl или H2SO4) и сильных оснований (NaOH или KOH).
Установочные вещества (или первичные стандарты): тетраборат натрия Na2B4O7 × 10 Н2O, карбонат натрия Na2CO3, щавелевая кислота Н2С2O4 • 2Н2O, янтарная кислота Н2С4Н4O4.
Индикаторы: кислотно-основные индикаторы (см. таблицу).
Характеристики некоторых индикаторов приведены в таблице.


Некоторые примеры кислотно-основного титрования
Титрование сильной кислоты сильным основанием
HCl + NaOH → NaCl + Н2O
Н+ + OH¯ → Н2O
В точке эквивалентности образуется соль сильной кислоты и сильного основания, которая не подвергается гидролизу. Реакция среды будет нейтральной (рН = 7). В данном случае индикатором может служить лакмус.
Титрование слабой кислоты сильным основанием
CH3COOH + NaOH → CH3COONa + Н2O
CH3COOH + OH¯ – > CHgCOO¯ + Н2O
Образующаяся соль слабой кислоты и сильного основания в растворе подвергается гидролизу:
CH3COO¯ + HOH → CH3COOH + OH¯
Точка эквивалентности в этом случае будет находиться в щелочной среде, поэтому следует применять индикатор, меняющий окраску при рН < 7, например фенолфталеин.
Титрование слабого основания сильной кислотой
NH4OH + HCl → NH4Cl + Н2O
NH4OH + Н+ → NH4+ + Н2O
Образующаяся соль в растворе подвергается гидролизу:
NH4+ + HOH → NH4OH + Н+
Точка эквивалентности будет находиться в кислой среде, поэтому можно применять индикатор, меняющий свою окраску при рН < 7, например метилоранж.
4.3. Метод комплексонометрии
Комплексонометрия – титриметриче-ский метод анализа, основанный на реакциях комплексообразования определяемых ионов металлов с некоторыми органическими веществами, в частности с комплексонами.
Комплексоны – аминополикарбоновые кислоты и их производные (соли).
В титриметрическом анализе широко используется один из представителей класса комплексонов – динатриевая соль этилендиаминтетрауксусной кислоты (Ма2Н2ЭДТА). Этот комплексон часто называют также трилоном Б или комплексном III:

или [Na2H2ЭДTA]
Трилон Б со многими катионами металлов образует прочные, растворимые в воде внутрикомплексные соединения (хелаты). При образовании хелата катионы металла замещают два атома водорода в карбоксильных группах трилона Б и образуют координационные связи с участием атомов азота аминогрупп.
Уравнение реакции: Ме2+ + Н2ЭДТА2- → [МеЭДТА]2- + 2Н+
Основные титранты (рабочие растворы): трилон Б, MgSO4, CaCl2
Установочные вещества (или первичные стандарты): MgSO4, CaCl2
Индикаторы: металлохромные индикаторы, эриохром черный Т
При рН = 7-11 анион этого индикатора (HInd2-) имеет синюю окраску. С катионами металлов (Са2+, Mg2+, Zn2+ и др.) в слабощелочном растворе в присутствии аммиачного буфера (рН = 8-10) он образует комплексные соединения винно-красного цвета по схеме:
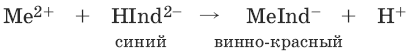
При титровании исследуемого раствора трилоном Б:
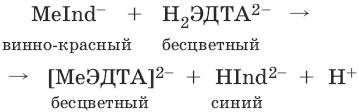
Константы нестойкости комплексов равны соответственно:
K н([CaInd]¯) = 3,9 • 10-6
K н([СаЭДТА]2-) = 2,7 • 10-11
K н([MgInd]¯) = 1,0 •1 0-7
K н([MgЭДTA]2-) = 2,0 • 10-9
4.4. Жесткость воды. Определение жесткости воды
Гидрокарбонатная (временная) жесткость обусловлена присутствием в воде бикарбонатов кальция и магния: Са(HCO3)2 и Mg(HCO3)2. Она почти полностью устраняется при кипячении воды, так как растворимые гидрокарбонаты при этом разлагаются с образованием нерастворимых карбонатов кальция и магния и гидроксо-карбонатов магния:
Са(HCO3)2 = CaCO3↓ + CO2↑ + H2O
Mg(HCO3)2 = MgCO3↓ + CO2↑ + H2O
2Mg(HCO3)2 = (MgOH)2CO3↓ + 3CO2↑ + H2O
Постоянная жесткость воды обусловлена присутствием в ней преимущественно сульфатов и хлоридов кальция и магния и при кипячении не устраняется.
Сумма величин временной и постоянной жесткости составляет общую жесткость воды:
Жобщ. = Жвр. + Жпост.
Существуют различные способы определения жесткости воды: определение временной жесткости с помощью метода нейтрализации; комплексонометрический метод определения общей жесткости.
Гидрокарбонатная жесткость воды определяется титрованием воды раствором соляной кислоты в присутствии метилового оранжевого, так как рН в точке эквивалентности находится в области перехода окраски этого индикатора.
Са(HCO3)2 + 2HCl → CaCl2 + 2Н2CO3
Mg(HCO3)2 + 2HCl → MgCl2 + 2H2CO3
До начала титрования рН раствора гидрокарбонатов кальция и магния больше 7 за счет гидролиза солей с участием аниона слабой кислоты. В точке эквивалентности раствор имеет слабокислую реакцию, обусловленную диссоциацией слабой угольной кислоты:
Н2CO3 ↔ HCO3¯ + Н+
Жвр (Н2O) = с э(солей) • 1000 (ммоль/л).
Общая жесткость воды (общее содержание ионов кальция и магния) определяется с использованием метода комплексонометрии.
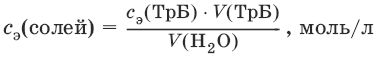
Жпост (Н2O) = с э(солей) • 1000 (ммоль/л).
4.5. Методы редоксиметрии
Методы редоксиметрии, в зависимости от используемых титрантов, подразделяются на:
1) перманганатометрию. Титрант – раствор перманганата калия КMnO4. Индикатор – избыточная капля титранта;
2) иодометрию. Титрант – раствор свободного иода I2 или тиосульфата натрия Na2S2O3. Индикатор – крахмал.
Вычисление молярных масс эквивалентов окислителей и восстановителей
При вычисления молярных масс эквивалентов окислителей и восстановителей исходят из числа электронов, которые присоединяет или отдает в данной реакции молекула вещества. Для нахождения молярной массы эквивалента окислителя (восстановителя) нужно его молярную массу разделить на число принятых (отданных) электронов в данной полуреакции.
Например, в реакции окисления сульфата железа(II) перманганатом калия в кислой среде:
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
1 | MnO4¯ + 8Н+ + 5ē → Mn2+ + 4H2O
5 | Fe2+ – ē → Fe3+
ион MnO4¯ как окислитель принимает пять электронов, а ион Fe2+ как восстановитель отдает один электрон. Поэтому для расчета молярных масс эквивалентов окислителя и восстановителя их молярные массы следует разделить на пять и на один соответственно.
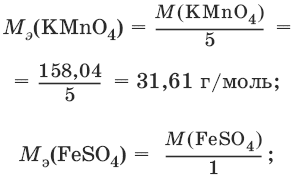
M3(Fe2+) = M(Fe2+) = 55,85 г/моль.
В реакции окисления сульфита натрия перманганатом калия в нейтральной среде:
2KMnO4 + 3Na2SO3 + Н2O → 2MnO2 + 3Na2SO4 + 2KOH
2 | MnO4¯ + 2Н2O + Зē → MnO2 + 4OH¯
3 | SO32- + 2OH¯ + 2ē → SO42- + Н2O
ион MnO4¯ принимает только три электрона, а ион восстановителя SO32- отдает два электрона, следовательно:
Молярные массы эквивалентов окислителей и восстановителей зависят от условий проведения реакций и определяются, исходя из соответствующих полуреакций.
4.6. Фотоколориметрия
Фотоколориметрия – оптический метод анализа, который рассматривает взаимодействие вещества с электромагнитным излучением в видимой области: длина волны (λ) 380–750 нм; волновое число (v) 2,5 104 – 1,5 • 104 см-1; энергия излучения (Е) 1—10 эВ.
Поглощенное световое излучение количественно описывается законом Бугера–Ламберта-Бера:

где А – поглощение вещества, или его оптическая плотность; Т – пропускание образца, т. е. отношение интенсивности света, прошедшего через образец, к интенсивности падающего света, I/I0; с – концентрация вещества (обычно моль/л); l – толщина кюветы (см); ε – молярная поглощательная способность вещества или молярный коэффициент поглощения [л/(моль см)].
Расчет молярного коэффициента поглощения проводят по формуле:
ε = А/(с Ь).
IV. Органическая химия
1. Алканы
Алканы (предельные углеводороды, парафины) – ациклические насыщенные углеводороды общей формулы С n H 2n+2. В соответствии с общей формулой алканы образуют гомологический ряд.
Первые четыре представителя имеют полусистематические названия – метан (CH4), этан (С2Н6), пропан (С3Н8), бутан (С4Н10). Названия последующих членов ряда строятся из корня (греческие числительные) и суффикса - ан: пентан (С5Н12), гексан (С6Н14), гептан (С7Н16) и т. д.
Атомы углерода в алканах находятся в sp3 -гибридном состоянии. Оси четырех sp3- орбиталей направлены к вершинам тетраэдра, валентные углы равны 109°28.
Пространственное строение метана:
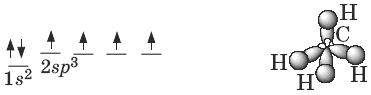
Энергия С—С связи Ес — с = 351 кДж/моль, длина С—С связи 0,154 нм.
Связь С—С в алканах является ковалентной неполярной. Связь С—Н – ковалентная слабополярная.
Для алканов, начиная с бутана, существуют структурные изомеры (изомеры строения), различающиеся порядком связывания между атомами углерода, с одинаковым качественным и количественным составом и молекулярной массой, но различающихся по физическим свойствам.

Способы получения алканов
1. СnH2n+2 → 400–700 °C → СpH2p+2 + СmH2m,
n = m + p.
Крекинг нефти (промышленный способ). Алканы также выделяют из природных источников (природный и попутный газы, нефть, каменный уголь).
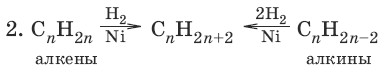
(гидрирование непредельных соединений)
3. nCO + (2n + 1)Н2 → СnH2n+2 + nH2O (получение из синтез-газа (CO + Н2))
4. (реакция Вюрца)
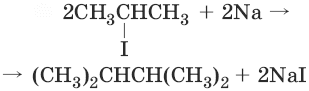
5. (реакция Дюма) CH3COONa + NaOH → t → CH4 + Na2CO3
6. (реакция Кольбе)
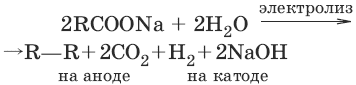
Химические свойства алканов
Алканы не способны к реакциям присоединения, т. к. в их молекулах все связи насыщены, для них характерны реакции радикального замещения, термического разложения, окисления, изомеризации.
1. (реакционная способность убывает в ряду: F2 > Cl2 > Br2 > (I2 не идет), R3C• > R2CH• > RCH2• > RCH3•)

2. (реакция Коновалова)
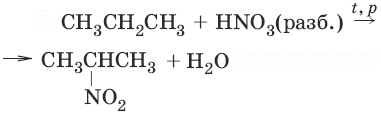
3. CnH2n+2 + SO2 + ½O2 → hν → CnH2n+1SO3H – алкилсульфокислота
(сульфоокисление, условия реакции: облучение УФ)
4. CH4 → 1000 °C → С + 2Н2; 2CH4 → t>1500 °C → С2Н2 + ЗН2 (разложение метана – пиролиз)
5. CH4 + 2Н2O → Ni, 1300 °C → CO2 + 4Н2 (конверсия метана)
6. 2СnH2n+2 + (Зn+1)O2 → 2nCO2 + (2n+2)Н2O (горение алканов)
7. 2 н- С4Н10 + 5O2 → 4CH3COOH + 2Н2O (окисление алканов в промышленности; получение уксусной кислоты)
8. н- С4Н10 → изо- С4Н10 (изомеризация, катализатор AlCl3)
2. Циклоалканы
Циклоалканы (циклопарафины, нафтены, цикланы, полиметилены) – предельные углеводороды с замкнутой (циклической) углеродной цепью. Общая формула С n H 2n.
Атомы углерода в циклоалканах, как и в алканах, находятся в sp3 -гибридизованном состоянии. Гомологический ряд циклоалканов начинает простейший циклоалкан – циклопропан С3Н6, представляющий собой плоский трехчленный карбоцикл. По правилам международной номенклатуры в циклоалканах главной считается цепь углеродных атомов, образующих цикл. Название строится по названию этой замкнутой цепи с добавлением приставки «цикло» (циклопропан, циклобутан, циклопентан, циклогексан и т. д.).
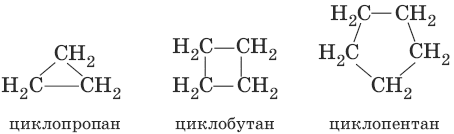

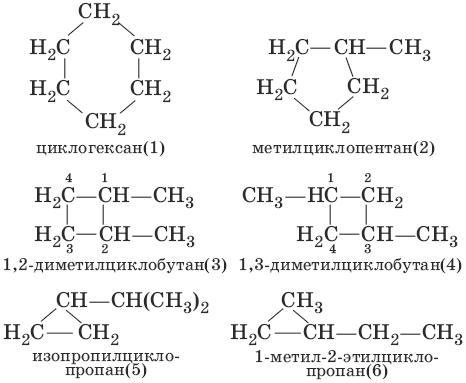
Структурная изомерия циклоалканов связана с различной величиной цикла (структуры 1 и 2), строением и видом заместителей (структуры 5 и 6) и их взаимным расположением (структуры 3 и 4).
Способы получения циклоалканов
1. Получение из дигалогенопроизводных углеводородов

2. Получение из ароматичесих углеводородов
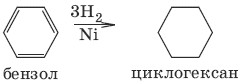
Химические свойства циклоалканов
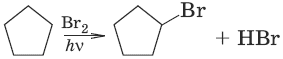
Химические свойства циклоалканов зависят от размера цикла, определяющего его устойчивость. Трех– и четырехчленные циклы (малые циклы), являясь насыщенными, резко отличаются от всех остальных предельных углеводородов. Циклопропан, циклобутан вступают в реакции присоединения. Для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т. е. реакции замещения.
1. Действие галогенов
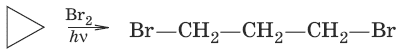

2. Действие галогеноводородов
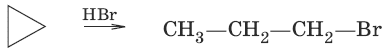
С циклоалканами, содержащими пять и более атомов углерода в цикле, галогеново-дороды не взаимодействуют.
3.
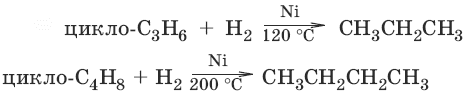
4. Дегидрирование

3. Алкены
Алкены (непредельные углеводороды, этиленовые углеводороды, олефины) – непредельные алифатические углеводороды, молекулы которых содержат двойную связь. Общая формула ряда алкенов СnН2n.
По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса – ан на – ен: этан (CH3—CH3) – этен (CH2=CH2) и т. д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь. Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи.
В молекуле алкена ненасыщенные атомы углерода находятся в sp2 -гибридизации, а двойная связь между ними образована σ– и π-связью. sp2 -Гибридные орбитали направлены друг к другу под углом 120°, и одна негибридизованная 2р -орбиталь, расположена под углом 90° к плоскости гибридных атомных орбиталей.
Пространственное строение этилена:
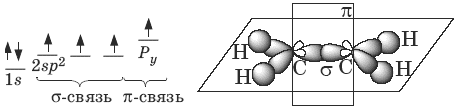
Длина связи С=С 0,134 нм, энергия связи С=С Ес=с = 611 кДж/моль, энергия π-связи Еπ = 260 кДж/моль.
Виды изомерии: а) изомерия цепи; б) изомерия положения двойной связи; в) Z, Е (cis, trans) – изомерия, вид пространственной изомерии.
Способы получения алкенов
1. CH3—CH3 → Ni, t → CH2=CH2 + H2 (дегидрирование алканов)
2. С2Н5OH →H,SO4, 170 °C→ CH2=CH2 + Н2O (дегидратация спиртов)
3. (дегидрогалогенирование алкилгалогенидов по правилу Зайцева)
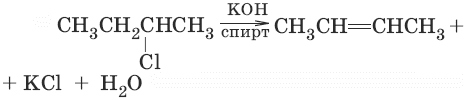
4. CH2Cl—CH2Cl + Zn → ZnCl2 + CH2=CH2 (дегалогенирование дигалогенопроизводных)
5. HC≡CH + Н2 → Ni, t → CH2=CH2 (восстановление алкинов)
Химические свойства алкенов
Для алкенов наиболее характерны реакции присоединения, они легко окисляются и полимеризуются.
1. CH2=CH2 + Br2 → CH2Br—CH2Br
(присоединение галогенов, качественная реакция)
2. (присоединение галогеноводородов по правилу Марковникова)
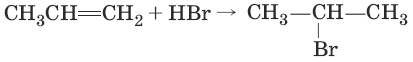
3. CH2=CH2 + Н2 → Ni, t → CH3—CH3 (гидрирование)
4. CH2=CH2 + Н2O → H+ → CH3CH2OH (гидратация)
5. ЗCH2=CH2 + 2КMnO4 + 4Н2O → ЗCH2OH—CH2OH + 2MnO2↓ + 2KOH (мягкое окисление, качественная реакция)
6. CH2=CH—CH2—CH3 + КMnO4 → H+ → CO2 + С2Н5COOH (жесткое окисление)
7. CH2=CH—CH2—CH3 + O3 → Н2С=O + CH3CH2CH=O формальдегид+пропаналь → (озонолиз)
8. С2Н4 + 3O2 → 2CO2 + 2Н2O (реакция горения)
9. (полимеризация)

10. CH3—CH=CH2 + HBr → перекись → CH3—CH2—CH2Br (присоединение бро-моводорода против правила Марковникова)
11. (реакция замещения в α-положение)

4. Алкины
Алкины (ацетиленовые углеводороды) – ненасыщенные углеводороды, имеющие в своем составе тройную С≡С связь. Общая формула алкинов с одной тройной связью СnН2n-2. Простейший представитель ряда алкинов CH≡CH имеет тривиальное название ацетилен. По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса – ан на -ин: этан (CH3—CH3) – этин (CH≡CH) и т. д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь. Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи.
В образовании тройной связи участвуют атомы углерода в sp -гибридизованном состоянии. Каждый из них имеет по две sp- гибридных орбитали, направленных друг к другу под углом 180°, и две негибридных p -орбитали, расположенных под углом 90° по отношению друг к другу и к sp -гибридным орбиталям.
Пространственное строение ацетилена:
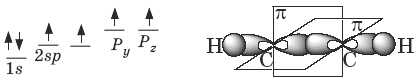
Виды изомерии: 1) изомерия положения тройной связи; 2) изомерия углеродного скелета; 3) межклассовая изомерия с алкадиенами и циклоалкенами.
Способы получения алкинов
1. СаО + ЗС → t → СаС2 + CO;
СаС2 + 2Н2O → Са(OH)2 + CH≡CH (получение ацетилена)
2. 2CH4 → t>1500 °C → HC = CH + ЗН2 (крекинг углеводородов)
3. CH3—CHCl2 + 2KOH → в спирте → HC≡CH + 2KCl + Н2O (дегалогенирова-ние)
CH2Cl—CH2Cl + 2KOH → в спирте → HC≡CH + 2KCl + Н2O
Химические свойства алкинов
Для алкинов характерны реакции присоединения, замещения. Алкины полиме-ризуются, изомеризуются, вступают в реакции конденсации.
1. (гидрирование)
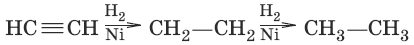
2. HC≡CH + Br2 → CHBr=CHBr;
CHBr=CHBr + Br2 → CHBr2—CHBr2 (присоединение галогенов, качественная реакция)
3. CH3—С≡CH + HBr → CH3—CBr=CH2;
CH3—CBr=CH2 + HBr → CH3—CBr2—CHg (присоединение галогеноводородов по правилу Марковникова)
4. (гидратация алинов, реация Кучерова)
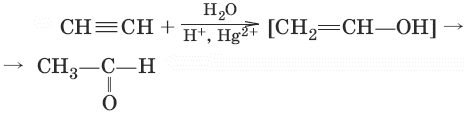
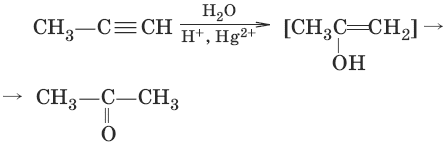
5.(присоединение спиртов)

6.(присоединение карбоновых ислот)
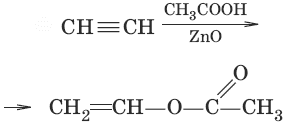
7. CH≡CH + 2Ag2O → NH3 → AgC≡CAg↓ + H2O (образование ацетиленидов, качественная реакция на концевую тройную связь)
8. CH≡CH + [О] → КMnO4 → HOOC—COOH → HCOOH + CO2 (окисление)
9. CH≡CH + CH≡CH → CH2=CH—С≡CH (катализатор – CuCl и NH4Cl, димеризация)
10. 3HC≡CH → C, 600 °C → С6Н6 (бензол) (циклоолигомеризация, реакция Зелинского)
5. Диеновые углеводороды
Алкадиены (диены) – непредельные углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов СnН2n_2. Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах.
Способы получения диенов
1. (метод СВ. Лебедева)
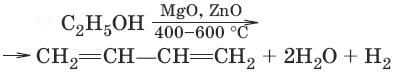
2. (дегидратация)

3. (дегидрирование)
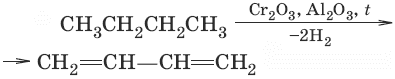
Химические свойства диенов
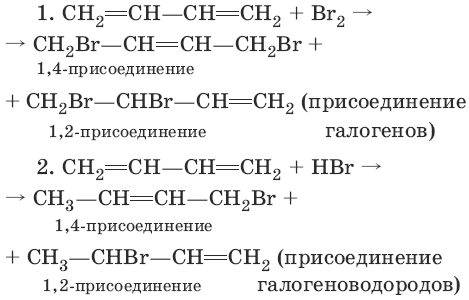
Для сопряженных диенов характерны реакции присоединения. Сопряженные диены способны присоединять не только по двойным связям (к C1 и С2, С3 и С4), но и к концевым (С1 и С4) атомам углерода с образованием двойной связи между С2 и С3.
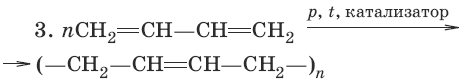
6. Ароматические углеводороды
Арены, или ароматические углеводороды, – циклические соединения, молекулы которых содержат устойчивые циклические группы атомов с замкнутой системой сопряженных связей, объединяемые понятием ароматичности, которая обуславливает общие признаки в строении и химических свойствах.
Все связи С—С в бензоле равноценны, их длина равна 0,140 нм. Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф. Кекуле), а все они выровнены (дел окал изованы).

формула Кекуле
Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R): С6Н5—R, R—С6Н4—R. Общая формула гомологического ряда бензола СnН2n_6 (n > 6). Для названия ароматических углеводородов широко используются тривиальные названия (толуол, ксилол, кумол и т. п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова «бензол» (корень): С6Н5—CH3 (метилбензол), С6Н5—С2Н5 (этилбензол). Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Для дизамещен-ных бензолов R—С6Н4—R используется также и другой способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками: орто– (o -) – заместители соседних атомов углерода кольца (1,2-); мета– (м -) – заместители через один атом углерода (1,3-); пара– (п -) – заместители на противоположных сторонах кольца (1,4-).
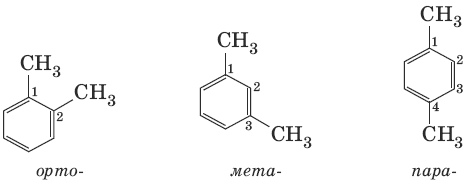
Виды изомерии (структурная): 1) положения заместителей для ди-, три– и тетра-замещенных бензолов (например, о-, м- и п -ксилолы); 2) углеродного скелета в боковой цепи, содержащей не менее 3 атомов углерода; 3) заместителей (R), начиная с R=С2Н5.
Способы получения ароматических углеводородов
1. С6Н12 → Pt, 300 °C → С6Н6 + ЗН2 (дегидрирование циклоалканов)
2. н- С6Н14 → Cr2O3, 300 °C → С6Н6 + 4Н2 (дегидроциклизация алканов)
3. ЗС2Н2 → С, 600 °C → С6Н6 (циклотримеризация ацетилена, реакция Зелинского)
Химические свойства ароматических углеводородов
По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Для аренов наиболее характерны реакции, идущие с сохранением ароматической системы, а именно реакции замещения атомов водорода, связанных с циклом. Другие реакции (присоединение, окисление), в которых участвуют делокали-зованные С-С связи бензольного кольца и нарушается его ароматичность, идут с трудом.
1. C6H6 + Cl2 → AlCl3 → C6H5Cl + HCl (галогенирование)
2. C6H6 + HNO3 → H2SO4 → C6H5—NO2 + H2O (нитрование)

3. С6Н6 → H2SO4 → С6Н5—SO3H + H2O (сульфирование)
4. С6Н6 + RCl → AlCl3 → С6Н5—R + HCl (алкилирование)
5. (ацилирование)

6. С6Н6 + ЗН2 → t, Ni → С6Н12 циклогексан (присоединение водорода)
7. (1,2,3,4,5,6-гексахлороциклогексан, присоединение хлора)
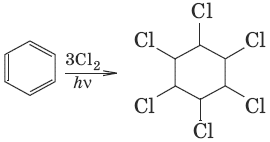
8. С6Н5—CH3 + [О] → С6Н5—COOH кипячение с раствором КMnO4 (окисление алкилбензолов)
7. Галогеноуглеводороды
Галогеноуглеводородами называются производные углеводородов, в которых один или несколько атомов водорода заменены на атомы галогена.
Способы получения галогеноуглеводородов
1. CH2=CH2 + HBr → CH3—CH2Br (гидрогалогенирование ненасыщенных углеводородов)
CH≡CH + HCl → CH2=CHCl
2. CH3CH2OH + РCl5 → CH3CH2Cl + POCl3 + HCl (получение из спиртов)
CH3CH2OH + HCl → CH3CH2Cl + Н2O (в присутствии ZnCl2, t°C)
3. а) CH4+ Cl2 →hv→ CH3Cl + HCl (галогенирование углеводородов)
б)

Химические свойства галогеноуглево-дородов
Наибольшее значение для соединений этого класса имеют реакции замещения и отщепления.
1. CH3CH2Br + NaOH (водн. р-р) → CH3CH2OH + NaBr (образование спиртов)
2. CH3CH2Br + NaCN → CH3CH2CN + NaBr (образование нитрилов)
3. CH3CH2Br + NH3 → [CH3CH2NH3]+Br ↔— HBr ↔ CH3CH2NH2 (образование аминов)
4. CH3CH2Br + NaNO2 → CH3CH2 NO2 + NaBr (образование нитросоединений)
5. CH3Br + 2Na + CH3Br → CH3—CH3 + 2NaBr (реакция Вюрца)
6. CH3Br + Mg → CH3MgBr (образование магнийорганических соединений, реактив Гриньяра)
7. (дегидрогалогенирование)
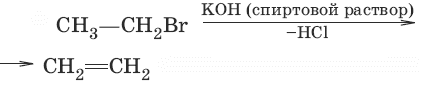
8. Спирты
Спиртами называются производные углеводородов, в молекулах которых содержится одна или несколько гидроксильных групп (—OH), связанных с насыщенными атомами углерода. Группа —OH (гидроксильная, оксигруппа) является в молекуле спирта функциональной группой. Систематические названия даются по названию углеводорода с добавлением суффикса - ол и цифры, указывающей положение гидроксигруппы. Нумерация ведется от ближайшего к OH-группе конца цепи.
По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа —OH), многоатомные (две и более групп —OH). Одноатомные спирты: метанол CH3OH, этанол С2Н5OH; двухатомный спирт: этилен-гликоль (этандиол-1,2) HO—CH2—CH2—OH; трехатомный спирт: глицерин (пропантриол-1,2,3) HO—CH2—CH(OH)—CH2—OH. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты первичные R—CH2—OH, вторичные R2CH—OH, третичные R3C—OH.
По строению радикалов, связанных с атомом кислорода, спирты подразделяются на предельные, или алканолы (CH3CH2—OH), непредельные, или алкенолы (CH2=CH—CH2—OH), ароматические (С6Н5CH2—OH).
Виды изомерии (структурная изомерия): 1) изомерия положения OH-группы (начиная с С3); 2) углеродного скелета (начиная с С4); 3) межклассовая изомерия с простыми эфирами (например, этиловый спирт CH3CH2OH и диметиловый эфир CH3—О—CH3). Следствием полярности связи О—Н и наличия неподеленных пар электронов на атоме кислорода является способность спиртов к образованию водородных связей.
Способы получения спиртов
1. CH2=CH2 + Н2O/Н+ → CH3—CH2OH (гидратация алкенов)
2. CH3—CHO + Н2 → t, Ni → С2Н5OH (восстановление альдегидов и кетонов)
3. C2H5Br + NaOH (водн.) → С2Н5OH + NaBr (гидролиз галогенопроизводных)
ClCH2—CH2Cl + 2NaOH (водн.) → HOCH2—CH2OH + 2NaCl
4. CO + 2Н2 → ZnO, CuO, 250 °C, 7 МПа → CH3OH (получение метанола, промышленность)
5. С6Н12O6 → дрожжи → 2С2Н5OH + 2CO2 (брожение моноз)
6. 3CH2=CH2 + 2KMnO4 + 4Н2O → 3CH2OH—CH2OH - этиленгиликоль + 2KOH + 2MnO2 (окисление в мягких условиях)
7. а) CH2=CH—CH3 + O2 → CH2=CH—CHO + Н2O
б) CH2=CH—CHO + Н2 → CH2=CH—CH2OH
в) CH2=CH—CH2OH + Н2O2 → HOCH2—CH(OH)—CH2OH (получение глицерина)
Химические свойства спиртов
Химические свойства спиртов связаны с наличием в их молекулу группы —OH. Для спиртов характерны два типа реакций: разрыв связи С—О и связи О—Н.
1. 2С2Н5OH + 2Na → Н2 + 2C2H5ONa (образование алкоголятов металлов Na, К, Mg, Al)
2. а) С2Н5OH + NaOH ≠ (в водном растворе не идет)
б) CH2OH—CH2OH + 2NaOH → NaOCH2—CH2ONa + 2Н2O
в) (качественная реакция на многоатомные спирты – образование ярко-синего раствора с гидроксидом меди)

3. а) (образование сложных эфиров)

б) С2Н5OH + H2SO4 → С2Н5—О—SO3H + Н2O (на холоду)
в)
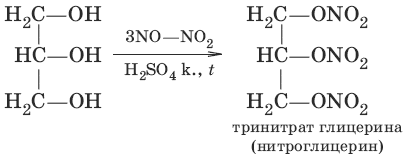
4. а) С2Н5OH + HBr → С2Н5Br + Н2O
б) С2Н5OH + РCl5 → С2Н5Cl + POCl3 + HCl
в) С2Н5OH + SOCl2 → С2Н5Cl + SO2 + HCl (замещение гидроксильной группы на галоген)
5. С2Н5OH + HOC2H5 → H2SO4, <140 °C → C2H5—O—C2H5 + H2O (межмолекулярная гидротация)
6. С2Н5OH → H2SO4, 170 °C → CH2=CH2 + H2O (внутримолекулярная гидротация)
7. а) (дегидрирование, окисление первичных спиртов)
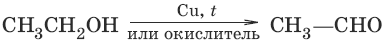
б) (дегидрирование, окисление вторичных спиртов)
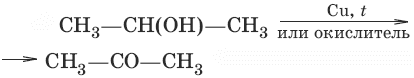
9. Фенолы
Фенолами называются производные аренов, в которых один или несколько атомов водорода ароматического кольца замещены на гидроксильные группы. По числу гидроксильных групп в ароматическом кольце различают одно– и многоатомные (двух– и трехатомные) фенолы. Для большинства фенолов используются тривиальные названия. Структурная изомерия фенолов связана с различным положением гидроксильных групп.

Способы получения фенолов
1. С6Н5Cl + NaOH(p, 340°C) → С6Н5OH + NaCl (щелочной гидролиз галогеноуглеводородов)
2. (кумольный способ получения)

3. C6H5SO3Na + NaOH (300–350°C) → С6Н5OH + Na2SO3 (щелочное плавление солей ароматических сульфоновых кислот)
Химические свойства фенолов
Фенолы в большинстве реакций по связи О—Н активнее спиртов, поскольку эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие непо-деленной электронной пары атома кислорода в системе л-сопряжения). Кислотность фенолов значительно выше, чем спиртов.
Для фенолов реакции разрыва связи С—О не характерны. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра.
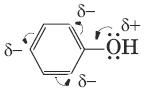
Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно в орто– и пара- положениях (+М-эффект OH-группы). Для обнаружения фенолов используется качественная реакция с хлоридом железа(III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
1. 2С6Н5OH + 2Na → 2C6H5ONa + Н2 (так же, как и этанол)
2. С6Н5OH + NaOH → C6H5ONa + H2O (в отличие от этанола)
C6H5ONa + Н2O + CO2 → С6Н5OH + NaHCO3 (фенол более слабая кислота, чем угольная)
3.
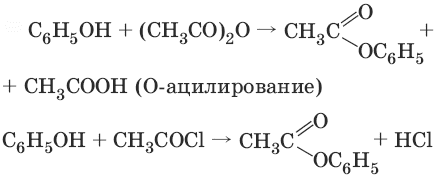
Фенолы не образуют сложные эфиры в реакциях с кислотами. Для этого используются более реакционноспособные производные кислот (ангидриды, хлорангидриды).
4. С6Н5OH + CH3CH2OH → NaOH → С6Н5OCH2CH3 + NaBr (О-алкилирование)
5.
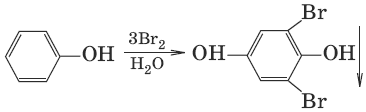
(взаимодействие с бромной водой, качественная реакция)
6.(нитрование разб. HNO3, при нитрировании конц. HNO3 образуется 2,4,6-тринитрофенол)
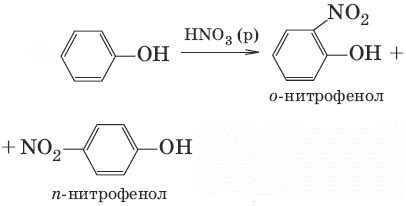
7. n C6H5OH + n CH2O → n H2O + (—C6H3OH—CH2—) n (поликонденсация, получение фенолформальдегидных смол)
10. Альдегиды и кетоны
Альдегидами называются соединения, в которых карбонильная группа
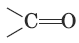
соединена с углеводородным радикалом и атомом водорода, а кетонами – карбонильные соединения с двумя углеводородными радикалами.

Систематические названия альдегидов строят по названию соответствующего углеводорода с добавлением суффикса –аль. Нумерацию цепи начинают с карбонильного атома углерода. Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении: Н2С=O – метаналь (муравьиный альдегид, формальдегид); CH3CH=O – этаналь (уксусный альдегид). Систематические названия кетонов несложного строения производят от названий радикалов с добавлением слова «кетон». В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса –он; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе. Примеры: CH3—CO—CH3 – диметилкетон (пропанон, ацетон). Для альдегидов и кетонов характерна структурная изомерия. Изомерия альдегидов: а) изомерия углеродного скелета, начиная с С4; б) межклассовая изомерия. Изомерия кетонов: а) углеродного скелета (с С5); б) положения карбонильной группы (с С5); в) межклассовая изомерия.
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2- гибридизации. Связь С=O сильно полярна. Электроны кратной связи С=O смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда, а карбонильный атом углерода приобретает частичный положительный заряд.
Способы получения альдегидов и кетонов
1. а) (дегидрирование, окисление первичных спиртов)
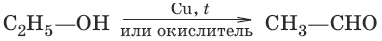
б) (дегидрирование, окисление вторичных спиртов)
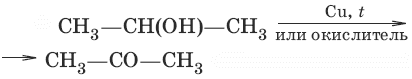
2. а) CH3CH2CHCl2 + 2NaOH → в воде → CH3CH2CHO + 2NaCl + H2O (гидролиз дигалогенопроизводных)
б) CH3СCl2CH3 + 2NaOH → в воде → CH3COCH3 + 2NaCl + H2O
3. (гидратация алкинов, реакция Кучерова)
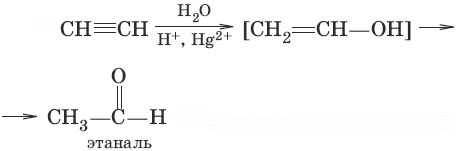
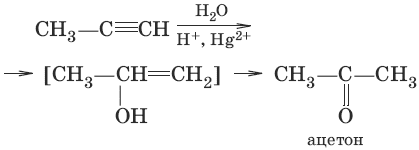
4. (окисле