НЕОРГАНИЧЕСКАЯ ХИМИЯ
Описание макросинтезов. Часть I
Настоящее пособие предназначено для студентов 1 курса
Института Химии Санкт-Петербургского Государственного Университета
Основная образовательная программа: 04.03.01 Химия
Санкт-Петербург
2018
Макросинтезы по галогенам
Бертолетова соль KClO3
Место проведения: тяга.
Реактивы и материалы: KMnO4, HCl техн., КОН, 0,5н р-р KI, лёд, вода дистиллированная, сахарная пудра, H2SO4.
Посуда и оборудование:
1. стакан химический термостойкий на 50 мл и 100 мл;
2. стакан химический на 50 мл (для охлаждённой воды);
3. мерный цилиндр на 25 мл и 100 мл;
4. колба Вюрца на 250 мл + капельная воронка + воронка химическая средняя, газоотводная трубка + короткий кусок шланга + воронка химическая малая (по диаметру стакана);
5. колба Бунзена + фильтр Шотта № 40 + «топталка»;
6. пробирки на штативе;
7. кристаллизатор большой;
8. чашка Петри, бюкс;
9. штатив Бунзена с плоской и 3-хпалой лапками и 2-мя муфтами;
10. песчаная баня, электроплитка, термометр;
11. весы, шпатель, калька для взвешивания;
12. водоструйный насос + предохранительная склянка;
13. сушильный шкаф;
14. кафельная плитка (для сжигания).
Ход работы: приготовьте в стаканчике примерно 20 мл 50%-ного раствора КОН, поместите его на электроплитку, доведите до температуры ≈100 °С и, поддерживая эту температуру, пропустите через нагретый раствор ток Cl2.
Хлор получите взаимодействием перманганата калия с концентрированной соляной кислотой. Для этого поместите в колбу Вюрца примерно 20 г КMnO4 и при помощи капельной воронки по каплям прибавьте рассчитанное с учётом 10% избытка количество 36% НСl.
На песчаной бане нагрейте воду и по мере выкипания раствора КОН смывайте образующуюся соль небольшими порциями воды.
Полученный состав охладите в кристаллизаторе (вода со льдом). Выделившиеся кристаллы хлората калия отфильтруйте на фильтре Шотта и промойте 2-3 раза охлаждённой до 2-3 °С дистиллированной водой (порции примерно по 3 мл) до появления блестящих кристаллов бертолетовой соли.
Высушите полученный препарат в сушильном шкафу при температуре 40-50 °С (при открытой дверце шкафа!)
Проделайте реакции, доказывающие сильные окислительные свойства бертолетовой соли.
Контрольные вопросы:
1. Напишите уравнение реакции получения хлора в этой работе.
2. Напишите уравнения проделанных с участием бертолетовой соли окислительно-восстановительных реакций.
3. Где применяется бертолетова соль?
Примечания:
1. Реакцию проводят до полного прибавления HCl к KMnO4, раствор сначала желтеет, потом постепенно начинает выпадать соль.
Очень чистая соль выпадает из достаточно разбавленного раствора.
Трихлорид йода ICl 3
Место проведения: тяга.
Реактивы и материалы: I2, KBrO3, HCl конц., NaOH, KI, вода дистиллированная, лёд.
Посуда и оборудование:
1. стакан химический термостойкий на 150 мл;
2. мерный цилиндр на 25 мл;
3. капельная воронка, воронка химическая средняя;
4. штатив Бунзена с плоской лапкой и муфтой;
5. колба Бунзена + фильтр Шотта № 40 + «топталка»;
6. фарфоровая ступка c пестиком;
7. кристаллизатор большой;
8. бюкс;
9. набор пробирок в штативе;
10. мешалка магнитная с якорем, магнит;
11. весы, шпатель, калька для взвешивания;
12. водоструйный насос + предохранительная склянка.
Ход работы: В термостойкий стакан на 150 мл поместите 4,2 г бромата калия. Сверху насыпьте слой порошкообразного (предварительно растёртого) йода в количестве 4 г. Затем прилейте примерно 5 мл воды.
Кристаллизатор со льдом поставьте на магнитную мешалку, поместите в него стакан, включите перемешивание и начните осторожно добавлять в него соляную кислоту из капельной воронки. Добавление HCl должно производиться со скоростью 3 - 4 капли в минуту.
Первоначально в воронку налейте 30 мл HCl. После того, как будет израсходована примерно половина объёма кислоты, скорость её прибавления можно увеличить до 25 капель в минуту. При этом необходимо следить за реакционной смесью: после того, как объем жёлтого вещества сильно увеличится, усильте скорость перемешивания и через полминуты прекратите добавление HCl.
Смесь в стакане выдержите несколько минут в кристаллизаторе со льдом, а затем отфильтруйте кристаллы ICl3 на фильтре Шотта. Полученный трихлорид йода поместите для хранения в бюкс, так как он очень летуч уже при комнатной температуре.
Полученный препарат подвергните: а) действию воды; б) действию щелочи; в) нагреванию; г) проверьте его окисляющую способность.
Контрольные вопросы:
1. Напишите уравнения всех проведенных реакций.
2. Какие из галогенов образуют наибольшее число интергалогенидов?
3. Почему Br2 может вытеснить хлор из трифторида хлора?
ClF3 +1/2 Br2 = BrF3 + ½ Cl2
4. Почему при отделении кристаллов ICl3 от маточного раствора нельзя пользоваться бумажным фильтром?
Получение и очистка хлора Cl2 (с мокрой очисткой)
Место проведения: тяга.
Реактивы и материалы: KMnO4, HCl (конц.), H2SO4, CaO, 2н р-р KOH.
Посуда и оборудование:
1. колба Вюрца + капельная воронка + воронка химическая средняя;
2. соединительные шланги + газоотводная трубка;
3. склянка Дрекселя (2 шт.);
4. U-образная трубка;
5. барботёр;
6. штатив Бунзена 2-мя лапками и 2-мя муфтами (2 набора);
7. колба Эрленмеера 250-500 мл;
8. контейнер для сбора газа + кран трёхходовой стеклянный;
9. весы + шпатель, калька для взвешивания;
10. камера + этикетка (для выдачи образца на исследования).
Ход работы: Хлор Cl2 – жёлто-зелёный газ с резким запахом, тяжелее воздуха, чрезвычайно ядовит (удушающее действие). Все работы выполняются в вытяжном шкафу!
Установка для получения хлора состоит из следующих компонентов, соединённых с помощью шлангов в перечисленном ниже порядке:
·колба Вюрца + капельная воронка с противодавлением;
·две соединённые последовательно склянки Дрекселя, заполненные на 2/3 водой;
·U-образная трубка, заполненная твёрдым оксидом кальция;
·барботёр, заполненный на 2/3 чистой серной кислотой;
·трёхходовой газовый кран, к одному из выходных отверстий которого подсоединён пустой контейнер для сбора газа.
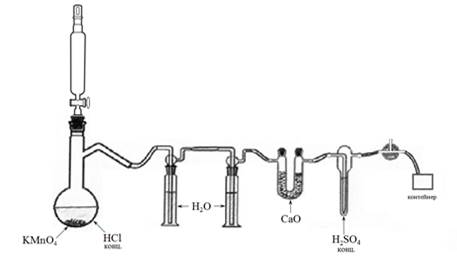
В колбу Вюрца вносят 20-30 г KMnO4 и с помощью капельной воронки добавляют несколько миллилитров концентрированной соляной кислоты, затем устанавливают кран капельной воронки в положение, обеспечивающее добавление в колбу Вюрца соляной кислоты со скоростью 1-2 капли в секунду.
Выделяющаяся смесь газов содержит Cl2, HCl, H2O и остававшийся в колбе воздух. Для очистки от HCl получаемый газообразный продукт последовательно пропускают через 2 склянки Дрекселя, заполненные на 2/3, водой, и U-образную трубку, заполненную твёрдым CaO. Далее очищенную от HCl газовую смесь пропускают через барботёр, заполненный чистой серной кислотой.
Для удаления остатков воздуха из системы газ пропускают через систему в течение 5 минут с газовым краном, установленным на выпуск газообразного продукта реакции через газоотводную трубку в плоскодонную колбу с 2н раствором KOH (нейтрализующий раствор). После удаления остатков воздуха из системы переключают кран в положение, заполняющее контейнер для сбора газообразного продукта реакции. После наполнения контейнера переключают кран в исходное положение и прекращают добавление соляной кислоты.
Качество очистки полученного газообразного продукта реакции от компонентов воздуха и водяного пара можно проконтролировать методом ИК-спектроскопии.
Контрольные во просы:
1. Какие ещё лабораторные способы получения хлора вы знаете?
2. Почему в качестве поглотительного раствора для очистки от примеси HCl используется вода, а не раствор щёлочи?
3. С помощью каких реакций можно обнаружить даже следовые количества хлора в газовой смеси?
Примечания:
1. Перед заполнением хлором кювету откачать на масляном насосе 5 минут.
Хлор из кюветы выпустить в тяге, затем подсоединить к масляному насосу и откачать 5-10 минут.
Синтез дигидроортопериодата натрия Na3H2IO6.
Место проведения: тяга.
1. Дигидроортопериодат натрия — бесцветное кристаллическое вещество, малорастворимое в воде.
2. В качестве окислителя в реакции используется хлор. В ходе работы использутся следующие реактивы: NaOH(безводный), NaIO3(безводный), KMnO4(безводный), HCL(конц.) и оборудование: колба Вюрца, капельная воронка, плоскодонная колба, снабженная пробкой с газоотводной трубкой; электрическая плитка, чашка Петри, весы электронные, сушильный шкаф, воронка Бюхнера, фильтровальная бумага, индикаторная бумага.
3. Для получения хлора используется реакция перманганата калия с соляной кислотой.
Ход синтеза: приготовить растворы 15,61 г иодата натрия в 300 мл теплой дистиллированной воды и 14 г гидроксида натрия в 100 мл дистиллированной воды. Растворы смешать в колбе, снабженной пробкой с газоотводной трубкой. В колбу Вюрца насыпать перманганат калия, в капельную воронку налить концентрированную соляную кислоту. Медленно приливать HCL к KMnO4. Выделяюшийся газ желто-зеленого цвета, пропускать через раствор NaOH и NaIO3. (возможно выделение белого осадка дигидроортопериодата натрия) Реакцию продолжать до полной нейтрализации щелочи, проверяя pH с помощью индикаторной бумаги. После этого, колбу охладить в кристаллизаторе с водно-ледяной смесью. Образовавшийся белый осадок промыть дистиллированной водой и отфильтровать на воронке Бюхнера. Отфильтрованный продукт высушить в сушильном шкафу при температуре 90оС.
Провести реакции, доказывающие, что полученный продукт является именно ортопериодатом натрия, снять ИК спектр.
Контрольные вопросы.
1.Напишите все происходящие реакции и докажите, что в результате должен получиться именно целевой продукт.
2. Какие окислители можно было бы еще использовать для синтеза?
3. Какова растворимость дигидроортопериодата натрия в воде?
Получение иодида аммония NH4I.
Иодид аммония – бесцветные кристаллы, хорошо растворимые в воде (172,3/100 – 20оС), ацетоне, умеренно в этиловом спирте (26,3/100 – 25оС). При длительном хранении и на свету окисляются (желтеют).
Реактивы и материалы: I2 твердый порошкообразный, NH3*H2O аммиак водный 10%, H2O2 раствор перекиси водорода 10%, спирт этиловый.
Посуда и оборудование: ступка с пестиком, колба коническая 150 мл, мерный цилиндр на 50 мл, колба Бунзена, стеклянный фильтр (d 40), фарфоровая чашечка, бюкс с крышкой, плитка электрическая, магнитная мешалка, весы электронные
Ход синтеза.
В ступке растереть 5 г иода, перенести в коническую колбочку на 150 мл и прилить 14 мл 10% раствора аммиака. Затем при перемешивании на магнитной мешалке, добавить небольшими порциями 30 мл 10% перекиси водорода до полного растворения иода. Должен получиться светло-желтый раствор. Если раствор насыщенного желтого цвета, то добавить еще немного 10% раствора перекиси (10 мл). После этого, реакционную смесь кипятить на плитке (200-2200С) в течение 15-20 минут. При необходимости раствор отфильтровать и упаривать в фарфоровой чашечке до появления кристаллов. Выпавшие кристаллы собрать и быстро промыть на фильтре Шотта (D 40) холодным этиловым спиртом. Посушить на фильтре и в сушильном шкафу при 90-1000С. Кристаллы взвесить, поместить в бюкс из темного стекла с притертой крышкой (или в прозрачный бюкс, обернув его бумагой). Рассчитать выход реакции.
С продуктом провести реакции, доказывающие, что получено целевое соединение.
Контрольные вопросы:
1. Напишите реакцию окисления водного раствора иодида аммония на воздухе.
2. Напишите реакцию термического разложения твердого иодида аммония.
3. Почему для промывания осадка используют холодный этиловый спирт?
4. С чем связаны условия хранения кристаллов иодида аммония?
5. Сопоставьте его поведение в растворе и при нагревании с поведением иодидов натрия, калия.
Синтез гидрата бромата бария Ba(BrO3)2*H2O.
Бромат бария представляет собой бесцветные кристаллы, устойчивые на воздухе, растворимые в теплой воде, нерастворимые в ацетоне и этиловом спирте. Образует кристаллогидраты состава Ba(BrO3)2*H2O и Ba(BrO3)2*2H2O.
Реактивы и материалы: KBrO3, BaCl2*2H2O, C2H5OH, лед.
Посуда и оборудование: Стаканчики термостойкие на 50 и 100 мл (2 шт), колба коническая (250 мл), стеклянная палочка, шпатель, колба Бунзена, воронка Бюхнера, бумажные фильтры, кристаллизатор. Весы электронные, электрическая плитка.
Ход работы.
В стаканчик на 50 мл вносят 3,34 г бромата калия и растворяют в 20 мл нагретой до кипения дистиллированной воды. В другом стаканчике растворяют 2,44 г дигидрата хлорида бария в 40 мл горячей воды. Растворы горячими сливают и помещают в кристаллизатор со льдом и водой. Выпавший осадок фильтруют на воронке Бюхнера, несколько раз промывают холодной водой и один раз этиловым спиртом. Сушат в сушильном шкафу при температуре 1000С.
Контрольные вопросы:
Получите бромноватую кислоту. Для этого подействуйте на бромит бария серной кислотой. Осадок отфильтруйте, а с фильтратом проведите следующие реакции:
1. Определите рН полученной кислоты.
2. Несколько миллилитров нагрейте в пробирке до кипения. Что наблюдается? Опишите протекающие реакции.
3. К раствору кислоты прибавьте раствор HBr. Что наблюдается?
4. Сопоставьте в рамках модели Гиллеспи строение ионов NO3- и BrO3-.
Получение гидрата хлората бария Ba(ClO3)2*Н2О.
Хлорат бария моногидрат Ba(ClO3)2*H2O – белый моноклинный кристаллический порошок, хорошо растворимый в воде. При нагревании до 1200С теряет кристаллизационную воду. Сильный окислитель. Взрывоопасен.
Реактивы и материалы. Винная кислота C2H2(OH)2(COOH)2, 22% раствор аммиака NH3*H2О, KClO3 твердый, лед, карбонат бария BaCO3. Раствор 2н H2SO4, раствор KI, CCl4.
Посуда и оборудование. Магнитная мешалка, стеклянный стаканчик (150 мл), стаканчик на 100 мл, кристаллизатор, колба Бунзена, стеклянный фильтр (d 40), фарфоровая чашечка, электрическая плитка, пробирки.
Ход синтеза
Сначала получают аммониевую соль винной кислоты (тартрат аммония). Для этого к 50 мл раствора 22% аммиака при перемешивании на магнитной мешалке добавляют раствор 14г винной кислоты в 30 мл воды. При плохом растворении кислоты можно подогреть смесь, но не выше 45-500С. По окончании реакции, среда раствора должна быть нейтральной.
Затем, при нагревании до 500С, готовят насыщенный раствор хлората калия (10г в 100г воды) и добавляют его в стехиометрическом количестве в реакционную смесь. Стаканчик помещают в кристаллизатор со льдом. Отфильтровывают выпавший осадок тартрата калия.
На последней стадии синтеза к фильтрату добавляют сухой карбонат бария до прекращения выделения аммиака. Раствор упаривают до образования кристаллов. Полученные кристаллы взвесить и определить выход продукта.
Контрольные вопросы.
1. Напишите все происходящие реакции.
2. Докажите химически, что вами получено целевое соединение.
3. Сопоставьте в рамках модели Гиллеспи строение ионов NO3- и ClO3-.