Кафедра органической, физической и коллоидной химии
Дистанционное
Обучение
Хим.орг.-1.22.2701 зчн.плн. Хим.орг.-1.22.2703 зчн.плн. Хим.орг.-1.22.2704 зчн.плн. Хим.орг.-1.22.2705 зчн.плн.
Хим.орг.-1.22.2701 зчн.скр. Хим.орг.-1.22.2703 зчн.скр. Хим.орг.-1.22.2704 зчн.скр. Хим.орг.-1.22.2705 зчн.скр.
Хим.орг.-1.22.2701 очн.плн. Хим.орг.-1.22.2703 очн.плн. Хим.орг.-1.22.2704 очн.плн. Хим.орг.-1.22.2705 очн.плн.
Хим.орг.-1.22.2701 вчр.плн. Хим.орг.-1.22.2703 вчр.плн. Хим.орг.-1.22.2704 вчр.плн. Хим.орг.-1.22.2705 вчр.плн.
Хим.орг.-1.22.2701 вчр.скр. Хим.орг.-1.22.2703 вчр.скр. Хим.орг.-1.22.2704 вчр.скр. Хим.орг.-1.22.2705 вчр.скр.
Хим.орг.-1.22.2707 зчн.плн. Хим.орг.-1.22.2708 зчн.плн. Хим.орг.-1.22.2710 зчн.плн. Хим.орг.-1.22.2712 зчн.плн.
Хим.орг.-1.22.2707 зчн.скр. Хим.орг.-1.22.2708 зчн.скр. Хим.орг.-1.22.2710 зчн.скр. Хим.орг.-1.22.2712 зчн.скр.
Хим.орг.-1.22.2707 очн.плн. Хим.орг.-1.22.2708 очн.плн. Хим.орг.-1.22.2710 очн.плн. Хим.орг.-1.22.2712 очн.плн.
Хим.орг.-1.22.2707 вчр.плн. Хим.орг.-1.22.2708 вчр.плн. Хим.орг.-1.22.2710 вчр.плн. Хим.орг.-1.22.2712 вчр.плн.
Хим.орг.-1.22.2707 вчр.скр. Хим.орг.-1.22.2708 вчр.скр. Хим.орг.-1.22.2710 вчр.скр. Хим.орг.-1.22.2712 вчр.скр.
Домбровский В.А., Шуманский С.М.
ОРГАНИЧЕСКАЯ ХИМИЯ
«Углеводороды»
(Алкены)
Учебно-практическое пособие
Для студентов технологических специальностей
Всех форм обучения

Москва – 2004
УДК 547
Ó Домбровский В.А., Шуманский С.М. Органическая химия (Углеводороды - Алкены). Учебно-практическое пособие. – М., МГУТУ, 2004
Рекомендовано Институтом информатизации образования РАО
Данное учебно-практическое пособие представляет собой материал, где в кратком и систематическом виде изложено содержание одной из тем изучаемых по дисциплине «Органическая химия» - «Углеводороды». В предлагаемой части этого пособия рассмотрен один из разделов этой темы – «Алкены». Здесь обсуждены вопросы, касающиеся номенклатуры, изомерии, способов получения и химических свойств соединений этого класса. Особое внимание уделено рассмотрению, с точки зрения распределения электронной плотности в молекулах, механизмов некоторых реакций.
В конце раздела даны вопросы и тестовые задания позволяющие контролировать степень освоения материала, приведен список рекомендуемой литературы для самостоятельной работы.
Учебно-практическое пособие предназначено для студентов технологических специальностей всех форм обучения.
Авторы: Домбровский В.А., д.х.н., проф.
Шуманский С.М., к.х.н., доц.
Рецензенты: Фонский Д.Ю., к.х.н., доц. кафедры «Органическая химия»
Московского государственного университета
прикладной биотехнологии
Прокопов Н.И., д.х.н., проф. кафедры «Синтез полимеров»
Московской государственной академии
тонкой химической технологии им.М.В.Ломоносова
Редактор: Свешникова Н.И.
ÓМосковский государственный университет технологий и управления, 2004
109004, Москва, Земляной Вал,73
Содержание
Стр
Введение ………………………………………………………………..…….. 4
АЛКЕНЫ(этиленовые углеводороды, олефины) ………………………... -
Номенклатура ………………………………………………………….….….. -
Изомерия ……………………………………………………………….…….. 6
1.Методы получения ……………………………………………..….....….… 7
2.Физические свойства ……………………………………………………… 8
3.Химические свойства ………………………………………………….…… 9
3.1.Реакции присоединения ……………………………………………....…. -
3.2.Реакция окисления ……………………………………………..……..…. 16
3.2.1.Окисление без разрыва С-С связей …………………………...….…… -
3.2.2.Окисление с разрывом С-С связей ……………………………..….…. 17
3.3.Реакции замещения ……………………………………………….…..…. 18
3.4.Полимеризация ……………………………………………………...…… 19
3.4.1.Радикальная полимеризация ……………………………………….…. 21
3.4.2.Ионная полимеризация ……………………………………….……….. 23
Тест по теме «Углеводороды - Алкены» ……………………………….… 25
Вопросы для самоконтроля по теме «Углеводороды - Алкены» ………. 26
Ответы на тестовые задания по теме «Углеводороды - Алкены» …….… -
Список рекомендуемой литературы …………………………………..……. 27
Словарь основных понятий по теме «Углеводороды - Алкены» ……..…. 28
Введение
Как показывает практика, раздел «Алкены» изучаемый по теме «Углеводороды» плохо усваивается студентами, поэтому необходимо усилить требования к методическим приемам и способам обучения по данной тематике.
В настоящем учебном пособии «Углеводороды - Алкены» на современном научном уровне изложен материал по строению и химическим свойствам данного класса, даны тестовые задачи для самостоятельной работы и приведен список рекомендуемой литературы.
Данное учебное пособие предназначено для студентов очной, вечерней и заочной форм обучения технологических специальностей.
АЛКЕНЫ
(ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ, ОЛЕФИНЫ)
Углеводороды, молекулы которых имеют на два атома водорода меньше, чем алканы (углеводороды ряда метана), и характеризуются присутствием в молекулах двойной углерод-углеродной связи С=С (этиленовая связь), называются алкенами, этиленовыми углеводородами, или олефинами. Химический состав этиленовых углеводородов выражается общей формулой СnH2n. Алкены образуют гомологический ряд, который можно записать, исходя из гомологического ряда алканов. Для этого необходимо отнять от двух соседних углеродных атомов алкана два атома водорода (по одному от каждого атома углерода). Строение, номенклатура некоторых алкенов приведены в таблице 1.
Номенклатура
Алкены и большое количество его производных называют олефинами, так как жидкие алкены являются маслянистыми веществами (от латинского oleum – растительное масло). По систематической международной номенклатуре название алкенов образуют из названий аналогично построенных предельных углеводородов (алканов) с тем же количеством углеродных атомов путем замены суффикса –ан на суффикс –ен. При этом в номенклатуре алкена указывается номер углеродного атома, после которого располагается двойная связь (табл.1). За основу выбирают наиболее длинную углеродную цепь, в которую обязательно должна входить двойная связь. Основную цепь нумеруют так, чтобы атом углерода, который указывает положение двойной связи, получил наименьший порядковый номер, например:
6СН3 ¾ 5СН ¾ 4СН2 ¾ 3СН = 2СН ¾ 1СН3
½
СН3 5-метилгексен-2
Таблица № 1
Гомологический ряд, номенклатура алкенов
| Формула | Название по номенклатуре | ||
| Системат. | Тривиал. | Рационал. | |
| Н2С=СН2 Н2С=СН-СН3 Н2С=СН-СН2-СН3 Н ¾ С=С ¾ Н ½ ½ Н3С СН3 Н3С ¾ С=С ¾ Н ½ ½ Н СН3 Н2С=С-СН3 ½ СН3 Н2С=СН-СН2-СН2-СН3 Н3С-СН=СН-СН2-СН3 Н2С=С-СН2-СН3 ½ СН3 Н2С=СН-СН-СН3 ½ СН3 | этен пропен бутен-1 цис-бутен-2 транс-бутен-2 метилпропен пентен-1 пентен-2 2-метилбутен-1 3-метилбутен-1 | этилен пропилен a-бутилен b-бутилен (псевдо-бутилен) ____ изобутилен a-амилен b-амилен g-изоамилен a-изоамилен | этилен метилэтилен этилэтилен сим.-диметилэтилен ____ несим.-диметилэтилен пропилэтилен метилэтилэтилен несим.-метилэтилэтилен изопропилэтилен |
Для алкенов часто используют также названия, которые сложились для них исторически (тривиальная номенклатура). Тривиальные названия алкенов образуются из названий соответствующих предельных углеводородов, при замене в них суффикса –ан на суффикс –илен (этан – этилен).
Кроме того, наиболее простые алкены называют по рациональной номенклатуре («этиленовая система» в названии), по которой эти углеводороды рассматривают как производные этилена, образованные замещением атомов водорода в его молекуле соответствующими радикалами, например (см. табл.1):
Н2С = СН ¾ СН3
метилэтилен
Если от этиленового углеводорода отнять один атом водорода, то получают одновалентные радикалы, которые содержат двойные связи. Радикал этилена (Н2С=СН¾) называют винилом или этенилом. У пропилена существует три радикала:
пропенил Н3С ¾ СН = СН ¾
изопропенил Н3С ¾С = СН2
½
аллил СН2 = СН ¾ СН2 ¾
Двухвалентный радикал этилена (Н2С = С <) называется винилиденом.
Изомерия
Алкенам свойственна структурная изомерия, обусловленная строением (разветвлением) углеродной цепи и положением двойной связи в цепи. Поэтому количество структурных изомеров в алкенах больше, чем у алканов с тем же количеством углеродных атомов в молекуле. Изомерия в ряду алкенов, как и алканов, начинается с углеводорода, который содержит четыре атома углерода, т.е. с бутена, изомерами которого являются бутен-1, бутен-2 и метилпропен (см. табл.1.). Кроме структурной, в ряду алкенов имеет место еще геометрическая изомерия, предвиденная Я.Вант-Гоффом в 1874г., которая является одним из видов пространственной изомерии (стереоизомерии). Стереоизомеры имеют одинаковый порядок химических связей, но разное расположение атомов или групп атомов (лигандов) в пространстве. Пространственное расположение лигандов в молекулах стереоизомеров называется конфигурацией.
Геометрическая, или цис-транс-изомерия, это такой вид пространственной изомерии, когда лиганды по-разному расположены в пространстве относительно плоскости двойной связи. Данный вид изомерии свойственен этиленовым соединениям, в молекулах которых атомы углерода с двойной связью соединены с лигандами, например веществам типа R ¾ CH = CH ¾ R (R могут быть как одинаковыми, так и различными), и обусловлен отсутствием свободного вращения вокруг связи С=С, которое потребует разрыва p-связи и затраты 125-210 кДж/моль. В случае, когда одинаковые R расположены в пространстве по одну сторону от плоскости связи С=С, образуется цис-конфигурация (от латинского cis – по эту сторону). Если R расположены по разные стороны – образуется транс-изомер (от латинского транс – через, по разные стороны). Например:

цис-бутен-2 транс-бутен-2
В сложных случаях, когда например четыре лиганда разные, цис-транс обозначение является условным. Поэтому для соединений типа abС=Сcd по системе ИЮПАК предложена E-Z номенклатура. Для этого введено старшинство заместителей. Заместитель тем старший, чем больший атомный номер элемента, который непосредственно соединен с атомом углерода связи С=С. Так, старшинство заместителей возрастает в ряду H<C<N<O<F<P<S<Cl<Br<J и т.д. Если атомы, соединенные с атомом углерода связи С=С, одинаковые, то необходимо учитывать старшинство соединенных с ним заместителей. Старшинство заместителей возрастает в ряду Н3С- < СН3-СН2- < (Н3С)2СН-.
Геометрические изомеры отличаются по физическим, химическим и даже физиологическим свойствами. Молекулы цис-изомеров имеют центр и плоскость симметрии, а транс-изомеры – только центр симметрии. Для определения конфигурации геометрических изомеров используют физические параметры. Так, температуры плавления транс-изомеров, как правило, выше чем температуры плавления у соответствующих цис-изомеров. Цис-изомеры имеют большую плотность, выше температуру кипения и выше показатель преломления, чем соответствующие транс-изомеры. У транс-изомеров дипольный момент равен нулю, а цис-изомеры имеют определенный дипольный момент. Имеются определенные отличия также в ИК-спектрах цис- и транс-изомеров.
1.МЕТОДЫПОЛУЧЕНИЯ
Непредельные углеводороды этиленового ряда в свободном состоянии в природе встречаются сравнительно редко, например, в некоторых видах нефти.
Из синтетических методов получения алкенов наибольшее значение имеют следующие:
1. Дегидратация спиртов, т.е. отщепление от них воды в присутствии водоотнимающих средств.
 H2SO4, 160oC
H2SO4, 160oC
CH3-CH2-OH ¾¾¾¾¾¾¾® H2C=CH2 + H2O
этанол этилен
2. Дегидрогалогенирование галогеналканов (реакция элеминирования)
спирт
H3C-CH2-Cl + KOH ¾¾¾¾¾¾¾® H2C=CH2 + KCl + H2O
хлористый
этил
3. Дегидрирование алканов
Cr2O3, 300-400oC
CH3-CH2-CH3 ¾¾¾¾¾¾¾® CH3-CH=CH2 + H2
пропан пропен
4. Дегалогенирование вицинальных дигалогенопроизводных алканов
Вицинальные дигалогеналканы при нагревании с размельченным цинком или магнием в соответствующем растворителе, например в спирте, легко превращаются в этиленовые углеводороды. Так, из 1,2-дибромэтана в этих условиях образуется этилен:
CH2¾CH2 + Zn ¾¾¾® H2C=CH2 + ZnBr2
½ ½
Br Br
2.ФИЗИЧЕСКИЕ СВОЙСТВА
Первые три представителя гомологического ряда этиленовых углеводородов – газы, начиная с С5Н10 – жидкости, а С18Н36 и высшие алкены – твердые вещества. С увеличением молекулярной массы алкена повышается их температуры плавления и кипения. Алкены с углеродной цепью нормального строения кипят при более высокой температуре, чем их изомеры, которые имеют разветвленную структуру. Перемещение двойной связи в центр молекулы вызывает повышение температур кипения и плавления алкена.
Для алкенов характерно избирательное поглощение ИК-света, поэтому ИК-спектры широко используются для установления строения этиленовых соединений. В ИК-спектрах валентным колебаниям отвечает полоса поглощения в области 1680-1640 см-1.
В УФ-области спектра алкены поглощают при 180-200 нм.
Характерными для алкенов являются ПМР-спектры. Протоны алкенов в этих спектрах дают химические сдвиги около 4,5-6,0 млн-1.
3.ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства алкенов обусловлены в первую очередь присутствием в их молекулах двойной углерод-углеродной связи С=С, которая представляет собой комбинацию s- и p-связей. Для описания электронного строения связи С=С по теории МО (молекулярных орбиталей) используют один из приемов – метод гибридизации. Атомы углерода, соединенные двойной связью, находятся в sp2-гибридизованном состоянии. p-связь менее прочная, чем s-связь. Для разрыва s-связи требуется 341,9 кДж/моль, а для разрыва p-связи требуется 269,8 кДж/моль. Поэтому для этиленовых соединений характерны реакции присоединения, реакционным центром в которых является p-связь.
РЕАКЦИИ ПРИСОЕДИНЕНИЯ
Наиболее важным типом химических превращений этиленовых соединений являются реакции присоединения (лат.Aditione – присоединение, А-реакции) по месту двойной связи за счет разрыва энергетически более слабой p-связи. p-Связь является донором электронов (p-оснований), которые легко образуют s-связи с реагентами присоединения. К связям С=С можно присоединить водород, галогены, галогеноводороды, воду, спирты и др. реагенты. В зависимости от природы реагентов, условий реакции (температура, природа растворителя и т.д.) А-реакции могут осуществляться по ионному электрофильному (А Е) и радикальному (А R) механизмам. Реакции замещения для этиленовых соединений мало характерны. В процессе реакции присоединения атомы углерода двойной связи переходят из sp2- в sp3- валентное состояние.
Гидрирование
Гидрированием называют реакции присоединения водорода к непредельным соединениям. При гидрировании двойная связь С=С разрывается и образуется простая связь С-С, а алкены при этом превращаются в алканы. Гидрирование является одним из удобных методов синтеза алканов. Практическое значение имеет гетерогенное гидрирование алкенов молекулярным водородом в присутствии катализаторов, таких как Ni, Pt, Pd. Гидрирование алкенов экзотермическая реакция. Например:
Ni
Н2С=СН2 +Н2 ¾¾¾® Н3С-СН3 +137кДж
этилен этан
Электрофильное присоединение. Для алкенов наиболее характерными являются реакции электрофильного присоединения (АЕ - реакции) к двойной связи полярных (ионных) реагентов X+Z- или реагентов, которые легко поляризуются. Частичка X+ является акцептором электронов (электрофилом) и начинает процесс присоединения к этиленовой связи.
А Е – реакции описываются двустадийным механизмом. На первой, медленной стадии электрофил X+, который имеет вакантную орбиталь, взаимодействует с p-электронами этиленовой связи и образует p-комплекс (I). Далее в p-комплексе вследствие присоединения электрофила за счет p-электронов образуется s-связь с одним из атомов углерода. p-комплекс таким образом превращается в s-комплекс (карбкатион) (II). Равновесное состояние между p-комплексом (I) и s-комплексом (II) завершается быстрой стадией – присоединением противоположно заряженным ионом Z- и образованием конечного продукта реакции – аддукта (III). Присоединение противоиона Z- осуществляется по транс-механизму, т.е. с тыла относительно частички X, которая уже присоединилась:
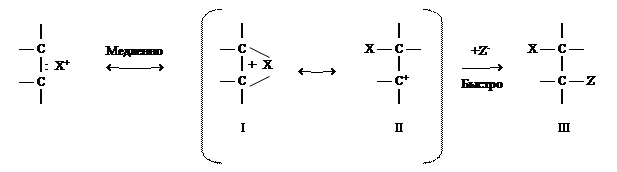 | |||
 |
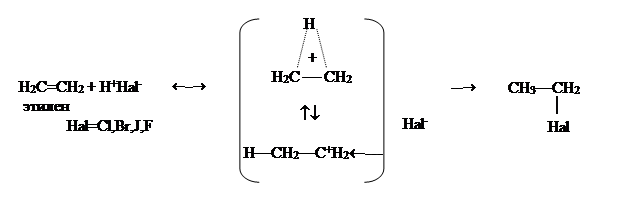
Гидрогалогенирование
Гидрогалогенированием называют реакцию присоединения HHal (Hal = Cl, Br, J, F) к непредельным соединениям.
 | |||||
 | |||||
 |
Присоединение HHal к этиленовой связи, как и присоединение других протонных кислот, описывается вышерассмотренным механизмом. В этом случае электрофилом является протон. Протон сначала образует с алкеном p-комплекс, а потом гетеролитически разрывает p-связь и за счет пары электронов образует s-связь с атомом углерода. Таким образом p-комплекс превращается в s-комплекс. Последний очень быстро присоединяет анион Hal- и образует галогеналкан.
Скорость присоединения галогенводородов к алкенам уменьшается в ряду НJ>НBr>НCl>НF, т.е. легче всего присоединяется иодоводород, а труднее всего – фтороводород.
Правило Марковникова. Особый интерес представляет присоединение протонных кислот к несимметричным этиленовым соединеням. Первые обобщения про порядок присоединения галогеноводородов к алкенам принадлежат В.В.Марковникову. В случае несимметрично построенных олефинов водород предпочтительнее присоединяется к наиболее гидрогенизированному из ненасыщенных атомов углерода, галоген – к другому ненасыщенному углеродному атому (правило Марковникова):
 |
СН3-СН=СН2 + Н-Cl ----® СН3-СН-СН3
 ½
½
Cl
пропилен 2-хлорпропан
Теперь известно, что присоединение галогеноводородов и других протонных кислот осуществляется по правилу Марковникова только в том случае, когда механизм присоединения гетеролитический (ионный).
Электронная интерпретация правила Марковникова базируется на том, что под влиянием электронных эффектов заместителей двойная связь в молекулах несимметричных алкенов поляризуется (статический фактор). Например, в молекуле пропилена под влиянием +I-индукционного эффекта, который проявляет метильная группа, атом углерода метиленовой группы имеет частичный отрицательный заряд d-:
 |
d+ d-
Н3С ® СН = СН2
Гидрогалогенирование пропилена осуществляется по вышеописанному механизму электрофильного присоединения в две стадии.
Такое направление присоединения HHal обусловлено также образованием на промежуточной стадии втор-пропильного катиона, стабилизируется метильными группами и является более устойчивым, чем первичный пропильный катион СН3-СН2-+СН2 (динамический фактор).
d+ d- Hal-
Н3С®СН=СН2 + Н+ «Н3С-СН=СН2 «Н3С-+СН-СН3 ¾® СН3-СН-СН3
½
H+ Hal
Таким образом, правило Марковникова в применении к полярным реакциям присоединения формулируется так: при гетеролитическом присоединении полярных молекул к алкенам положительная частичка реагента присоединяется к атому углерода двойной связи с большей электронной плотностью, а отрицательная частичка присоединяется к атому углерода с меньшей электронной плотностью.
Направление реакции присоединения галогенводородов и др. протоносодержащих кислот к связи –СН=СН– с одинаковой степенью гидрогенизации атомов углерода определяется эмпирическим правилом Зайцева-Вагнера (1875г.), согласно которому “галоген присоединяется к тому из ненасыщенных углеродных атомов, который связан с метилом”. Например, в реакции присоединения HJ к пентену-2 энергетически более устойчивым будет промежуточный карбкатион (I), который стабилизируется пятью a-водородными атомами, а не карбкатион (II), который стабилизируется четырьмя a-водородными атомами. Поэтому главным продуктом присоединения будет 2-иодпентан, а не его изомер – 3-иодпентан:
+Н+ +J-
 Н3С-СН2-СН=СН-СН3 ¾¾® Н3С-СН2-СН2-+СН-СН3 ¾® Н3С-СН2-СН2-СН-СН3
Н3С-СН2-СН=СН-СН3 ¾¾® Н3С-СН2-СН2-+СН-СН3 ¾® Н3С-СН2-СН2-СН-СН3
пентен-2 ½
J
2-иодпентан (I)
+J-
 ® Н3С-СН2-+СН-СН2-СН3 ¾® Н3С-СН2-СН-СН2-СН3
® Н3С-СН2-+СН-СН2-СН3 ¾® Н3С-СН2-СН-СН2-СН3
½
J
3-иодпентан (II)
Против правила Марковникова присоединяется к пропилену и другим несимметричным алкенам бромоводород, если реакцию осуществлять в присутствии кислорода воздуха, перекисей или других источников свободных радикалов (перекисный эффект Караша):
Н2О2
Н3С-СН=СН2 + НBr ¾¾¾® Н3С-СН2-СН2Br
пропилен 1-бромпропан
Перекисный эффект объясняется тем, что реакция присоединения НBr в этих условиях осуществляется не по ионному, а по цепному атомно-радикальному механизму. Сначала радикал R· (например кислород ·О-О·) гомолитически расщепляет молекулу НBr, образуя при этом атомарный бром Br·, который затем присоединяется к наиболее гидрогенизированному атому углерода у двойной связи. Новый более сложный радикал, который возник при этом, взаимодействует со следующей молекулой НBr, присоединяя к вторичному атому углерода атом водорода с одновременным образованием нового атома брома Br·, который продолжает цепь реакции:
 |
R· + H··Br ® R-H + Br·
d+ d- ·
H3C-CH=CH2 + Br· ® CH3-CH-CH2Br
пропилен
·
 H3C-CH-CH2Br + H··Br ® H3C-CH2-CH2Br + Br· и т.д.
H3C-CH-CH2Br + H··Br ® H3C-CH2-CH2Br + Br· и т.д.
1-бромпропан
Перекисный эффект наблюдается только в случае присоединения НBr. Однако, если присоединение НBr проводить в отсутствие кислорода, перекисей и др. источников свободных радикалов, то в этих условиях реакция осуществляется по электрофильному механизму и НBr присоединяется к несимметричным алкенам по правилу Марковникова.
Присоединение к алкенам НF, НCl, НJ всегда осуществляется по правилу Марковникова, потому что перекиси не расщепляют эти галогеноводороды, поскольку гомолитический разрыв связи в молекулах НF, НCl требует большей затраты энергии (для НF – около 618 кДж/моль). НJ обладает сильной восстанавливающей способностью и сам разлагает перекиси, кроме того, атомы иода, которые образуются из НJ, мало реакционноспособные.
Гидратация
Гидратацией называют реакцию присоединения воды. Гидратация этиленовых соединений осуществляется в присутствии таких катализаторов, как H2SO4, H3PO4 и др. Реакция проходит через стадию присоединения минеральных кислот к алкену с образованием сложного эфира минеральной кислоты, который при гидролизе дает спирт и соответствующую минеральную кислоту. Например:
 |
HOH
H2C=CH2 + H-OSO3H ® H3C-CH2-OSO3H ¾® H3C-CH2-OH + H2SO4
 |
этилен этилсерная кислота этанол
Гидратация этиленовых соединений является одним из важнейших способов получения спиртов.
Галогенирование
Алкены легко присоединяют галогены с образованием вицинальных дигалогеналканов:
Н2С=СН2 + Cl2 ¾¾¾® Cl-СН2-СН2-Cl
этен 1,2-дихлорэтан
Алкены с алкильными радикалами, находящимися около атомов углерода с двойной связью, присоединяют галогены быстрее, чем этилен.
Реакционная способность галогенов резко уменьшается в ряду F2>Cl2>Br2>J2. Во время взаимодействия алкенов с фтором выделяется 452,5 кДж/моль. Эта энергия больше энергии С-С связей, для разрыва которой требуется 350 кДж/моль. Поэтому фторирование алкенов сопровождается возгоранием реакционной смеси.
Иод с алкенами взаимодействует на солнечном свету.
Галогенирование алкенов относится к реакциям электрофильного присоединения (А Е -реакции).
Общий механизм полярного присоединения галогенов к алкенам описывается рассмотренным выше двустадийным механизмом: сначала катион галогена образует p-комплекс, который затем превращается в s-комплекс (карбкатион), после этого осуществляется транс-присоединение к карбкатиону аниона галогена:
|

|




|



 ««
««
 |  | ||||
 |

 p-комплекс
p-комплекс
| |||
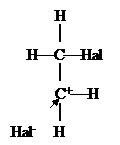 |
««
 |
s-комплекс
Демонстрационный опыт обесцвечивания бромной воды при пропускании через нее газообразного этилена представляет типичную А Е -реакцию. Бромная вода (раствор брома в воде) – смесь растворимых веществ, среди которых под действием полярных молекул воды возникают катионы Br+. При взаимодействии с этиленом катион Br+ сначала притягивается p-электронами двойной связи с образованием p-комплекса. Этот p-комплекс далее превращается в s-комплекс (карбкатион), который быстро присоединяет анион Br- и образует конечный продукт реакции – 1,2-дибромэтан:
·· d+ d-
H2O + Br ·· Br «[H2O: Br]+Br- «H2O + Br+ + Br-
·· ··
 Н2С H2C CH2Br +Br - H2C¾Br
Н2С H2C CH2Br +Br - H2C¾Br
 ½½ + Br+ «½½+ Br «½ -----® ½
½½ + Br+ «½½+ Br «½ -----® ½
Н2С H2C C+H2 Br¾CH2
Алкинирование
Алкилирование алкенов представляет, в принципе, присоединение алканов к этиленовой связи, которое осуществляется в сравнительно мягких условиях в присутствии кислотных протонных и апротонных катализаторов (H2SO4, H3PO4, HF, AlCl3, BF3 и т.д.). Алкилированием алкенов синтезируют углеводороды преимущественно с разветвленной структурой, которые используются как моторное топливо (например, синтез авиационного бензина). Так, 2,2,4-триметилпентан (изооктан), который имеет высокое октановое число, получают алкилированием изобутилена изобутаном:

 CH3 CH3
CH3 CH3
d+ d- d+ d- ½ H2SO4 ½
CH3 –C=CH2 + H-H2C-C-H ---------® CH3-C-CH2-CH-CH3
 ½ ½ 10OC ½ ½
½ ½ 10OC ½ ½
CH3 CH3 CH3 CH3
2,2,4-триметилпентан
Каталитическое алкилирование осуществляется по электрофильному механизму.
Оксосинтез
Оксосинтезом, или гидроформилированием, называют каталитическую реакцию присоединения к алкенам оксида углерода (II) и водорода (СО+Н2, водяной газ), в результате которой образуются преимущественно альдегиды. Реакцию проводят под давлением при нагревании в присутствии карбонилов кобальта или никеля (метод Реппе). Из этилена, например, этим методом получают пропионовый альдегид:
[Co(CO)4]
H2C=CH2 + CO + H2 ----------------------® H3C-CH2-COH
125OС; 20,6МПа
Из гомологов этилена этим методом получают смесь альдегидов с нормальной и разветвленной углеродной цепью:
R-CH=CH2 + CO + H2 ----® R-CH2-CH2-COH + R-CH-COH
½
CH3
РЕАКЦИИ ОКИСЛЕНИЯ
Непредельные соединения легко окисляются по месту этиленовой связи. Окислителями могут быть О2 (воздуха), О3 (озон), Ag2O, KMnO4, CrO3, OsO4, H2O2, надкислоты (например, надуксусная Н3С-СО-О-О-Н) и др. Окисление используют в промышленных и препаративных синтезах, а также для установления месторасположения двойных связей в молекулах непредельных соединений. Целенаправленным окислением алкенов в промышленности получают двухатомные спирты, альдегиды, карбоновые кислоты и др. кислородосодержащие соединения.
ОКИСЛЕНИЕ БЕЗ РАЗРЫВА С-С СВЯЗЕЙ
При каталитическом окислении алкенов кислородом воздуха разрываются только p-связь, и по месту разрыва присоединяется атом кислорода. Продуктом такого окисления являются трехчленные циклические простые эфиры, которые называют оксиранами, эпоксисоединениями, или a-оксидами. Например, при газофазном окислении этилена кислородом воздуха над металлическим серебром получают оксид этилена:
Ag, 250OC

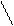
 H2C=CH2 +O2 ----------® CH2 CH2
H2C=CH2 +O2 ----------® CH2 CH2
O
Ряд окислительных реагентов взаимодействуют с алкенами в мягких условиях. В результате такого окисления осуществляется разрыв только p-связи, по месту которой присоединяются две гидроксигруппы, с образованием двухатомных спиртов – гликолей. Особое значение имеет открытая в 1898г. Е.Е.Вагнером реакция окисления алкенов разбавленным раствором KMnO4 на холоде в щелочной среде (реакция Вагнера), которая осуществляется по типу мягкого окисления:
3 CH2=CH2 + 2 KMnO4 + 4 H2O ® H2C ¾ CH2 + 2 MnO2 + 2 KOH
этилен ½ ½
HO OH
этиленгликоль
Окисление алкенов перманганатом калия осуществляется по механизму цис-циклоприсоединения KMnO4 к двойной связи с образованием промежуточного неустойчивого циклического сложного эфира (I), который далее гидролизуется водой и превращается в гликоль:
|
|
|