Более энергичное действие окислителей (нагревание, увеличение концентрации окислителя) приводит к разрыву молекулы алкена по месту двойной связи и образованию карбонильных соединений или карбоновых кислот. Например, при нагревании пентена-2 с KMnO4 молекула алкена расщепляется по месту двойной связи с образованием и уксусной и пропионовой кислот:
KMnO4
H3C-CH=CH-CH2-CH3 ---------® H3C-COOH + H3C-CH2-COOOH
tOC
пентен-2 уксусная пропионовая
кислота кислота
Образование в результате такого окисления кислот, молекулы которых содержат соответственно два и три углеродных атома, свидетельствует, что двойная связь в молекуле пентена находится после второго С-атома.
Окисление такого типа используют для установления местоположения двойной связи в молекуле алкена, а также, строения алкена.
Озонирование (озонолиз)
Для установления строения алкенов используется реакция озонирования. Большинство алкенов (как установил К.Гарриес) даже при низких температурах реагируют с озоном. При этом озон присоединяется к двойной связи с одновременным его разрывом и образованием циклических перекисных соединений, которые называют озонидами. Озониды, как и большинство соединений, которые содержат перекисные связи (-О-О-), могут неожиданно взрываться с большой силой. Поэтому озонирование необходимо проводить с большой осторожностью. Озониды, как правило, не выделяют в чистом виде, а разлагают, гидролизуя водой. При этом образуются карбонильные соединения, по строению которых можно установить положение двойной связи в молекулах алкена. Например:
Н2С=СН-СН2-СН3 + О3 -® CН2-СН-СН2-СН3 --® Н2С-О-СН-СН2-СН3 ---®

 бутен-1 ½ ½
бутен-1 ½ ½
О3 О – О
озонид
+ Н2О
-------® Н-СОН + СН3-СН2-СОН
- Н2О2 муравьиный пропионовый
альдегид альдегид
Н3С-СН=СН-СН3 + О3 ---® Н3С-СН-СН-СН3 ---® Н3С-НС-О-СН-СН3 -®

 бутен-2 ½ ½
бутен-2 ½ ½
О3 О – О
+ Н2О
------® 2 СН3-СОН
- Н2О2 уксусный
альдегид

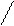 Н3С-С=СН-СН3 + О3 ---® (Н3С)2С-HС-СН3 ---® (Н3С)2С-О-СН-СН3 ---®
Н3С-С=СН-СН3 + О3 ---® (Н3С)2С-HС-СН3 ---® (Н3С)2С-О-СН-СН3 ---®
½ ½ ½
СН3 О3 О - О
2-метилбутен-2
+ Н2О
------® СН3-СО-СН3 + СН3-СОН
- Н2О2 ацетон уксусный
альдегид
РЕАКЦИИ ЗАМЕЩЕНИЯ
Для алкенов возможны реакции замещения атомов водорода, например, на галогены. При этом образуются непредельные галогенпроизводные, которые имеют большое промышленное значение. Так, при термическом хлорировании (450-500оС) пропилена хлор не присоединяется к двойной связи, а замещает атом водорода в метильной группе. В результате образуется хлористый аллил (3-хлорпропен-1, Ткип=45оС). Реакция осуществляется по радикальному механизму замещения (SR-реакция):
 |
Cl··Cl ®2Cl·
·
H2C=CH-CH3 + Cl· ---® H2C=CH-CH2 + HCl
 |
· H2C=CH-CH3
H2C=CH-CH2 + Cl··Cl ---® H2C=CH-CH2Cl + Cl· ------------------® и т.д.
хлористый
аллил
ПОЛИМЕРИЗАЦИЯ
Характерной особенностью многих непредельных соединений является их способность вступать в реакцию полимеризации и образовывать полимеры. Полимеризацией непредельных соединений называют химическую реакцию образования полимера (высокомолекулярного соединения) за счет объединения между собой большого количества молекул непредельных соединений (мономеров) ковалентными связями, которые возникают вследствие разрыва кратных связей (p-связей) в молекулах мономера. При полимеризации не выделяются побочные низкомолекулярные продукты. Полимеризация, например, однозамещенных производных этилена может быть изображено общей схемой:
n H2C=CH ® (-H2C-CH-)n, где
½ ½
R R
мономер полимер
n – степень полимеризации, которая может иметь значения до нескольких сотен тысяч единиц; при значении n=2,3,4…..10 соединения называют олигомерами (от греч. “олигос” – немного);
R – заместители (атомы водорода, хлора или группы CH3-, -CºN, C6H5-, H2C=CH-, -COOAlk и т.д.).
В химии полимеров широко используют также совместную полимеризацию нескольких разных мономеров, которую называют сополимеризацией.
Полимеры, полученные методом полимеризации, называют преимущественно по названию мономеров, которым добавляют приставку поли-, что означает “много”. Например, полимер, синтезированный из этилена, называют полиэтиленом, полимер пропилена – полипропиленом и т.д.
n CH2=CH2 ---® (-CH2-CH2-)n
этилен полиэтилен
n CH3-CH=CH2 ---® (-CH-CH2-)n
½
CH3
пропилен полипропилен
По характеру прохождения реакции полимеризации она может быть двух типов – ступенчатая и цепная (линейная). Инициаторами полимеризации могут быть тепловая энергия, давление, облучение и специальные химические реагенты.
Полимеризация может быть проведена по ионному (катионная и анионная) и радикальному механизмам.
Ступенчатая полимеризация
Этот тип полимеризации был открыт в 1873г. А.М.Бутлеровым на примере изобутилена при нагревании его с 20 %-ным раствором H2SO4.
d+ d- d+ d-
(Н3С)2С=СН2 + Н+ -® (Н3С)3С+ + (Н3С)2С=СН2 -® (Н3С)3С-СН2-+С(СН3)2 -®





 Н3С-С=СН-С(СН3)3 (82%)
Н3С-С=СН-С(СН3)3 (82%)
Н ½
 + ·· СН3 + Н2
+ ·· СН3 + Н2
 -® Н ··СН2-С-СН-С(СН3)3 ----® --------®
-® Н ··СН2-С-СН-С(СН3)3 ----® --------®

 ½ -Н+ Ni
½ -Н+ Ni
СН3
 Н2С=С-СН2-С(СН3)3 (18%)
Н2С=С-СН2-С(СН3)3 (18%)
 ½
½
СН3
CH3 CH3
½ ½
----® CH3-C-CH2-CH-CH3
½
CH3
2,4,6-триметилпентан (изооктан)
Ступенчатая полимеризация изобутилена является типичным примером катионной полимеризации. Инициатором полимеризации в этом случае является протон кислоты, который присоединяется к мономеру изобутилена и образует при этом карбкатион.
В определенных условиях полимеризацию можно остановить на необходимой стадии путем обрыва реакционной цепи. При гидрировании димеров изобутилена образуется 2,4,6-триметилпентан (изооктан) – высооктановое моторное топливо.
Цепная полимеризация
Наиболее распространенным типом полимеризации является цепная, или линейная, которая характеризуется тем, что макромолекула образуется в процессе одной непрерывной реакции вследствие соединения мономеров s-связями за счет разрыва p-связей.
В механизме цепной полимеризации различают три стадии: 1) инициирование и начало роста цепи; 2) рост цепи; 3) обрыв цепи полимеризации.
Полимеризация – экзотермическая реакция. На каждое звено мономера, который присоединился, выделяется »42кДж.