- Массовая доля (ω). Это процентное отношение массы растворенного вещества к общей массе раствора.
 (1).
(1).
Например, ω = 10 %. Это значит, что в 100 г раствора содержится 10 г вещества.
Пример 1.
Рассчитать массовую долю хлорида натрия в растворе, приготовленном из 40 г соли и 160 мл воды.
Дано:
mNaCI = 40 г;VН2О = 160 мл.
ωNaCI -?
Решение:
1. Для решения используем формулу (1)  .
.
2. Найдем массу раствора mр-ра = mNaCI + mH2O
m =V∙r; rH2O = 1г/мл; mH2O = 160мл ∙ 1г/мл = 160 г
mр-ра = 160 г + 40 г = 200 г.
3.  .
.
Ответ: 20%
Пример 2.
Определить массовую долю вещества в растворе, полученном смешением 300 г 25%-ного и 400 г 40%-ного (по массе) растворов этого вещества.
Дано:
m1= 300 г; w1 = 25%;
m2 = 400 г; w2 =40%.
w3 -?
Решение:
1. Найдем массу нового раствора
m3 = m1 + m2 ; m3 =300 г + 400 г = 700 г.
2. Найдем массу вещества в растворе, полученном после смешения. Для этого используем формулу (1)
 .
.
 ;
;
 ;
;
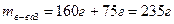 .
.
3.  .
.
Ответ: 33,6%
Молярная концентрация или молярность (См или М) показывает количество растворенного вещества в 1 литре раствора.

Например: 1,5 М раствор или Cм=1,5 моль/л. Это означает, что 1,5 моль какого-либо вещества растворено в 1 литре раствора.
Пример 3.
Найти массу NaNO3, содержащуюся в 300 мл 0,2 М раствора.
Дано:
См=0,2 моль/л; V = 300мл;
m -?
Решение:
1. Находим массу NaNO3; МNaNO3 = 85 г/моль;

Ответ: 5,1 г
Пример 4.
0,6 литра раствора гидроксида калия содержит 16,8 г КОН. Чему равна молярность этого раствора?
Дано:
m = 16,8 г; V =0,6 л;
См -?
Решение:
Для решения этой задачи необходимо в любой последовательности перейти от массы КОН к его количеству (моль) и от данного объема осуществить пересчет на 1 литр.
1. Рассчитаем количество КОН
МКОН = 56 г/моль;
 .
.
Ответ: 0,5 моль/л.
Молярная концентрация эквивалентов (нормальность) СН показывает число эквивалентов растворенного вещества в 1 литре раствора. 
Например, 2н раствор. Это означает, что 2 молярных массы эквивалента вещества растворено в 1 литре раствора.
Пример 5.
Сколько граммов BaCI2 содержится в 0,025 литрах 0,25 н раствора.
Дано:
Сн = 0,25 моль-экв/л; V = 0,025 л;
m -?
Решение:
1. Рассчитаем массу вещества ВаС12, содержащуюся в растворе с концентрацией 0,25 моль-экв/л.
МВаС!2 = 208г/моль,а молярная масса эквивалента ВаС12 =104 г/моль
 .
.
Ответ: 0,65 г
Пример 6.
Вычислить молярную концентрацию эквивалентов сульфата меди, 1 мл которого содержит 0,004 г CuSO4.
Дано:
V = 1 мл; m = 0,004 г;
Сн -?
Решение:
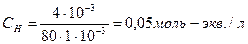
Ответ: Сн=0,05 моль-экв/л
Мольная доля (Ni). Это отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе. В системе, состоящей из растворителя и растворенного вещества, мольная доля последнего (N2) равна
 (2),
(2),
а мольная доля растворителя (N1) равна
 (3),
(3),
где n1 и n2 соответственно количества вещества растворителя и растворенного вещества.
Сумма мольных долей всех компонентов раствора равна 1.
Пример 7.
В 1 кг воды растворено 666 г КОН. Рассчитать мольные доли КОН и воды.
Дано:
mH2O = 1 кг; mКОН = 666 г;
NH2O -?,NKOH -?
Решение:
1. Рассчитаем количества Н2О и КОН.
МН2О=18г/моль.; МКОН=56г/моль. 
 .
.
2. Рассчитаем мольные доли гидроксида калия и воды по формулам (2) и (3)
 ;
;
 .
.
Ответ: NKOH = 0,176; NH2O = 0,824
Моляльная концентрация или моляльность (L) показывает количество растворенного вещества, приходящееся на 1 кг растворителя.

Например: 1,5 моль/кг. Это означает, что в растворе содержится 1,5 моль вещества и 1 кг растворителя.
Пример 8.
Водный раствор серной кислоты содержит 577 г H2SO4 и 1335 г Н2О. Какова его моляльность?
Дано:
mH2O = 1335 г; mH2SO4 = 577 г;
L -?
Решение:
Молярная масса серной кислоты  ;
;

Ответ: L = 4,41 моль/кг
Титр раствора (Т) показывает количество граммов растворенного вещества, содержащееся в 1 мл раствора.
 ;
;
Пример 9.
Имеется 1 литр 0,02 М раствора гидроксида натрия. Рассчитать титр раствора.
Дано:
V = 1л; См = 0,02 моль/л;
Т -?
Решение:
1. Найдем массу NaOH, содержащуюся в растворе.
МNaOH = 40 г/моль; mNaOH = 40 г/моль*0,02 моль =0,8 г.
2. Рассчитаем, сколько граммов гидроксида натрия содержится в 1 мл раствора.
 .
.
Ответ: Т = 0,0008 г/мл
Пример 10.
В 2 литрах раствора серной кислоты содержится 1154 г H2SO4. Плотность раствора r = 1,335 г/мл. Вычислить а) молярность, б) молярную концентрацию эквивалентов, в) массовую долю H2SO4, г) моляльность, д) мольные доли Н2О и H2SO4, е) титр раствора.
Решение:
Дано:
V = 2 л;
mH2SO4 = 1154 г; r = 1,335 г/мл;
См -?,Сн. -?, w -?, L -?, NH2O, NH2SO4 -?,Т -?
а) 1. Найдем количество H2SO4
MH2SO4 = 98 г/моль,  .
.
2. Пересчитаем это количество вещества на 1 литр
 .
.
б) Так как молярная масса эквивалента серной кислоты равна 1/2 МH2SO4, то молярная концентрация эквивалентов равна 11,78 моль-экв/л.
в) 1. Находим массу раствора
m = V∙ρ; m = 1,335 г/мл ∙2000 мл = 2670 г.
2. Находим массовую долю H2SO4 по формуле (1)
 .
.
г) 1. Найдем массу воды

2. В 1156 г Н2О содержится 11,78 моль. Найдем, какое количество серной кислоты содержится в 1000 г воды
 .
.
д) 1. Из предыдущих расчетов известно, что в растворе содержится 11,78 моль H2SO4. Рассчитаем количество воды

 .
.
2. 
 .
.
е) В 2 литрах раствора содержится 1154 г серной кислоты.
 .
.
Ответ: См =5,89 моль/л, Сн=11,78моль-экв/л, w (H2SO4) = 43,22%, L = 7,8 моль/кг, NH2O = 0,88, NH2SO4 = 0,12, Т = 0,577 г/мл.
Пример 11.
На нейтрализацию 50 мл раствора кислоты израсходовано 25 мл 0,5Н раствора щелочи. Чему равна молярная концентрация эквивалентов кислоты.
Решение:
Так как вещества взаимодействуют между собой в эксивалентных соотношениях, то растворы равной молярной концентрации эквивалентов реагируют в равных объёмах. При разных молярных концентрациях эквивалентов объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.

 , откуда
, откуда
 .
.
Ответ:  .
.
Контрольные задания
211. Определить массовую долю NaOH, если молярность этого раствора равна 11,8 моль/л (ρ = 1,18 г/мл).
212. Найти молярность 23%-ного (по массе) раствора КОН, плотность которого 1,2 г/мл.
213. В каком объеме 10 М раствора NaNO3 содержится 5 г этой соли?
214. Чему равна молярная концентрация раствора, который содержит в 3 литрах 175,5 г NaCl?
215. Определить моляльность раствора HCl, массовая доля HCl в котором равна 20%, ρ = 1,10 г/мл.
216. Определить молярность раствора H3PO4, массовая доля H3PO4 в котором равна 40%, ρ = 1,25 г/мл.
217. Вычислить моляльность H3PO4 в ее 5 М растворе. r = 1,25 г/мл.
218. Сколько граммов HCl содержится в 400 мл раствора, массовая доля HCl в котором равна 20%, ρ = 1,05 г/мл?
219. Определить моляльность раствора H3PO4, у которого w H3PO4= 40%, ρ = 1,25 г/мл.
220. Рассчитать массовую долю LiNO3 в 7,5 М растворе нитрата лития, ρ = 1,28 г/мл.
221. Вычислить мольные доли H2SO4 и воды в растворе, массовая доля H2SO4 в котором равна 96%.
222. Массовая доля HCl в растворе равна 18%, ρ = 1,09 г/мл. Вычислить молярную концентрацию раствора.
223. Водный раствор азотной кислоты содержит 200 г HNO3 и 800 г Н2О. Вычислить его моляльность.
224. Сколько граммов HCl содержится в 250 мл раствора, массовая доля HCl в котором равна 10%, ρ = 1,05 г/мл?
225. Чему равна моляльность раствора H2SO4 в ее 5 М растворе, ρ = 1,29 г/мл?
226. В каком объеме 5 М раствора К2SO4 содержится 10 г этой соли?
227. Массовая доля H3PO4 в растворе равна 40%, ρ = 1,25 г/мл. Найти молярность раствора.
228. 10 мл раствора содержит 0,458 г растворенного вещества. Каков титр этого раствора?
229. Определить молярную концентрацию раствора, который содержит в 2 литрах 34,8 г Na2SO4.
230. Чему равна моляльность раствора, содержащего в 0,75 литрах воды 4,41 грамма NaCl? ρн2о = 1,0 г/мл.
231. Титр раствора HNO3 равен 0,002 г/мл. Вычислить молярность этого раствора.
232. Сколько граммов CdSO4 содержится в 20 литрах раствора, массовая доля CdSO4 в котором равна 14%, ρ = 1,15 г/мл.
233. Сколько нужно взять AgNO3 на 500 мл раствора, чтобы его титр стал 0,0025 г/мл?
234. Массовая доля КОН в растворе равна 3,5%, ρ = 1,03 г/мл. Рассчитать титр раствора.
235. Имеется 0,9 М раствор HNO3, ρ = 1,03 г/мл. Определить массовую HNO3 в растворе.
236. Из 400 г 50%-ного (по массе) раствора H2SO4 выпариванием удалили 100 г воды. Чему равна массовая доля H2SO4 в оставшемся растворе?
237. Моляльная концентрация раствора H2SO4 2,7 моль/кг. Определить молярность раствора, ρ = 1,15 г/мл.
238. Рассчитать мольные доли Н2О и H3PO4 в 1,9 М растворе фосфорной кислоты, ρ = 1,1 г/мл.
239. Сколько граммов HNO3 содержится в 200 мл раствора с моляльной концентрацией 2,5 моль/кг, ρ = 1,05 г/мл.
240. Титр раствора HCl равен 0,022 г/мл, ρ = 1,1 г/мл. Определить массовую долю HCl в растворе.
241. Сколько граммов FeSO4 содержится в 1 л 12%-ного (по массе) раствора этой соли? r = 1,1 г/мл.
242. Из 10 кг 20%-ного раствора при охлаждении выделилось 400г соли. Чему равна массовая доля охлажденного раствора?
243. На нейтрализацию 2л раствора, содержащего 1,4г KOH требуется 40 мл раствора кислоты. Вычислите молярную концентрацию эквивалента кислоты.
244. Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор?
245. Найти массовую долю Na2SO4 в растворе, содержащем 250 г воды и 30 г соли.
246. Вычислите молярную концентрацию, молярную концентрацию эквивалента раствора, который содержит в 3 литрах 175,5 г NaCl?
247. Вычислите, молярную концентрацию эквивалента, молярную и моляльную концентрацию 16%-ного раствора хлорила алюминия, плотностью 1.149 г/см3.
248. Какой объем 50%-ного раствора KOH, плотностью 1,538г/см3, требуется для приготовления 2л 6%-ного раствора плотностью 1,048г/см3.
249. Сколько граммов Na2SO4 потребуется для приготовления 5 кг раствора, массовая доля Na2SO4 в котором равна 8%? Вычислите моляльную концентрацию раствора.
250. В каком объеме 5 М раствора К2SO4 содержится 10 г этой соли? Вычислите молярную концентрацию эквивалента, титр раствора.
251. Сколько граммов ZnSO4 можно получить из 150 г раствора с массовой долей ZnSO4 6%? Чему равна моляльная концентрация этого раствора?
252. Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна массовая доля оставшегося раствора.
253. Смешали 250 г 60%-ного и 150 г 15%-ного раствора серной кислоты. Какова массовая доля полученного раствора?
254. Чему равна молярная концентрация эквивалента 30%-ного раствора NaOH плотностью 1,328г/см3? К 1 л этого раствора прибавили 3 л воды. Вычислите массовую долю полученного раствора.
255. Массовая доля КОН в растворе равна 50%, ρ = 1,54 г/мл. Сколько граммов КОН содержится в 300 мл этого раствора?
256. Сколько граммов NaOH необходимо взять для приготовления 125 мл 0,15 М раствора? Вычислите молярную концентрацию эквивалента и тир этого раствора.
Свойства растворов
Пример 1.
Вычислите температуры кристаллизации и кипения 2%-ного раствора глюкозы.
Решение:
По закону Рауля понижение температуры кристаллизации и повышение температуры кипения (∆Т) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением
 , (1)
, (1)
где K - криоскопическая или эбуллиоскопическая константа. Для воды они соответственно равны 1,86 и 0,520С; m и M – масса; m1 – масса растворителя.
Понижение температуры кристаллизации 2%-ного раствора C6H12O6 находим по формуле (1):
 .
.
Вода кристаллизуется при 00С, следовательно, температура кристаллизации этого раствора 0 – 0,21 = –0,210С.
По формуле (1) находим и повышение температуры кипения 2%-ного раствора:
 .
.
Вода кипит при 1000С, следовательно, температура кипения этого раствора 100 + 0,06 = 100,060С.
Пример 2.
Раствор, содержащий 11,4 г бензойной кислоты C6H5COOH в 100 г сероуглерода, кипит при 46,5290С. Вычислите эбуллиоскопическую константу сероуглерода.
Решение: Повышение температуры кипения  . Молярная масса бензойной кислоты 122 г/моль. По формуле (1) находим эбуллиоскопическую константу:
. Молярная масса бензойной кислоты 122 г/моль. По формуле (1) находим эбуллиоскопическую константу:
 .
.
Пример 3.
Раствор, содержащий 11,04 г глицерина в 800г воды, кристаллизуется при –0,2790С. вычислите молярную массу глицерина.
Решение: Температура кристаллизации чистой воды 0оС, следовательно, понижение температуры кристаллизации  . Масса глицерина m (г), приходящаяся на 1000 г воды, равна:
. Масса глицерина m (г), приходящаяся на 1000 г воды, равна:
 г. Подставляя в уравнение
г. Подставляя в уравнение
 (2) числовые значения, вычисляем молярную массу глицерина:
(2) числовые значения, вычисляем молярную массу глицерина: 
Пример 4.
Вычислите массовую долю (%) водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора равна –0,465оС.
Решение:
Температура кристаллизации чистой воды 0оС, следовательно  . Молярная масса мочевины 60г/моль. находим массу m (г) растворенного вещества, приходящуюся на 1000г воды, по формуле (2):
. Молярная масса мочевины 60г/моль. находим массу m (г) растворенного вещества, приходящуюся на 1000г воды, по формуле (2):

Общая масса раствора, содержащего 15г мочевины, составляет 1000 + 15 = 1015 г. Массовая доля раствора равна:

Контрольные задания
257. Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,296оС. Температура кристаллизации бензола 5,5оС. Криоскопическая константа 5,1о. Вычислите молярную массу растворенного вещества.
258. Вычислите массовую долю (%) водного раствора сахара C12H22O11, зная, что температура кристаллизации раствора – 0,93ОС. Криоскопическая константа константа воды 1,86о.
259. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86о.
260. Раствор, содержащий 3,04 г камфары C10H16O в 100 г бензола, кипит при 80,714оС. Температура кипения бензола 80,2оС. Вычислите эбуллиоскопическую константу бензола.
261. Вычислите массовую долю (%) водного раствора глицерина C3H5(OH)3, зная, что этот раствор кипит при 100,39оС. Эбулиоскопическая константа воды 0,52о.
262. Вычислите молярную массу неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при –0,279оС. Криоскопическая константа воды 1,86о.
263. Вычислите температуру кипения 5%-ного раствора нафталина C10H8 в бензоле. Температура кипения бензола 80,2оС. Эбулиоскопическая константа его 2,57о.
264. Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при -0,465оС. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86о.
265. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4,25 г антрацена C14H10 в 100 г уксусной кислоты, кристаллизуется при 15,718оС. Температура кристаллизации уксусной кислоты 16,65оС.
266. При растворении 4,86 г серы в 60 г бензола температура кипения его повысилась на 0,81о. Сколько атомов содержит молекула серы в этом растворе. Эбулиоскопическая константа бензола 2,57о.
267. Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна -0,558оС. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86о.
268. Какую массу анилина C6H5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53о. Эбулиоскопическая константа этилового эфира 2,12о.
269. Вычислите температуру кристаллизации 2%-ного раствора этилового спирта C2H5OH. Криоскопическая констана воды 1,86о.
270. Сколько граммов мочевины (NH2)2CO следует растворить в 75 г воды, чтобы температуры кристаллизации понизилась на 0,465о? Криоскопическая константа воды 1,86о.
271. Вычислите массовую долю (%) водного раствора глюкозы C6H12O6, зная, что этот раствор кипит при 100,26оС. Эбулиоскопическая константа воды 0,52о.
272. Сколько граммов фенола C6H5OH следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7о? Криоскопическая константа бензола 5,1о.
273. Сколько граммов мочевины (NH2)2CO следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,26? Эбулиоскопическая константа воды 0,52о.
274. При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,372о. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86о.
275. Вычислите температуру кипения 15%-ного водного раствора пропилового спирта С3H7OH. Эбулиоскопическая константа воды 0,52о.
276. Вычислите массовую долю (%) водного раствора метанола CH3OH, температура кристаллизации которого -2,79оС. Криоскопическая константа воды 1,86о.
277. На сколько градусов повысится температура кипения воды, если в 100 г воды растворить 9 г глюкозы. Эбуллиоскопическая константа воды 0,52о.
278. При какой температуре будет кристаллизоваться 40%-ный раствор этилового спирта? Криоскопическая константа воды 1,86о.
279. Сколько граммов сахара C12H22O11 надо растворить в 200 г воды, чтобы: а) понизить температуру кристаллизации на 1оС; б) повысить температуру кипения на 1оС? Криоскопическая константа воды 1,86о, эбулиоскопическая константа воды 0,52о.
280. Вычислите температуру кипения раствора, содержащего 100г сахара C12H22O11 в 750 г воды. Эбулиоскопическая константа воды равна 0,52о.
281. В каком количестве воды следует растворить 23 г глицерина C3H8O3, чтобы получить раствор с температурой кипения 100,104оС. Эбулиоскопическая константа воды равна 0,52о.
282. Раствор, содержащий 5,4 г некоторого вещества неэлектролита в 200 г воды, кипит при температуре 100,078оС. вычислите молекулярную массу растворенного вещества. Эбулиоскопическая константа воды равна 0,52о.
283. Температура кипения ацетона 56,1оС, а его эбулиоскопическая константа равна 1,73о. вычислите температуру кипения 8%-ного раствора глицерина C3H8O3 в ацетоне.
284. Вычислите процентное содержание сахара C12H22O11 в водном растворе, температура кристаллизации которого –0,41оС. Криоскопическая константа воды 1,86о.
285. При растворении 0,4 г некоторого вещества в 10 г воды температура кристаллизации раствора понижается на 1,24о. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86о.
286. В каком количестве воды следует растворить 0,5 кг глицерина C3H8O3 для получения раствора с температурой кристаллизации –3оС.
Электрохимия
При электрохимических реакциях происходит превращение химической энергии в электрическую и, наоборот, электрической в химическую.