Надо различать электролиз расплавленных электролитов и их растворов. В последнем случае в процессах могут участвовать молекулы воды. В качестве примера рассмотрим электролиз концентрированного водного раствора хлорида натрия (электроды угольные). В этом случае в растворе находятся гидратированные ионы Na+ и Cl–, а также молекулы воды. При прохождении тока через раствор катионы Na+ движутся к катоду, а хлорид–ионы Cl– – к аноду. Однако реакции, протекающие на электродах, существенно отличаются от реакций, идущих в расплаве соли. Так, на катоде вместо ионов натрия восстанавливаются молекулы воды:
2H2O + 2e– = H2 + 2OH–
а на аноде окисляются хлорид–ионы:
2Cl– – 2e– = Cl2.
В итоге на катоде выделяется водород, на аноде – хлор, а в растворе (вблизи катода) накапливается гидроксид натрия NaOH (отрицательные заряды ионов OH– компенсируются положительными зарядами ионов Na+). Общее уравнение электролиза водного раствора NaCl в ионной форме имеет вид
2H2O + 2e– = H2 + 2OH–
2Cl– – 2e– = Cl2.
––––––––––––––––––––––––––––––
электролиз
 2H2O + 2Cl– H2 + Cl2 + 2OH–
2H2O + 2Cl– H2 + Cl2 + 2OH–
или в молекулярной форме:
электролиз
 2H2O + 2NaCl H2 + Cl2 +2NaOH.
2H2O + 2NaCl H2 + Cl2 +2NaOH.
Катодные и анодные процессы. Как же протекает восстановительный процесс на катоде в водных растворах?
Ответ можно получить с помощью ряда стандартных электродных потенциалов. Здесь возможны три случая:
1) катионы металлов, имеющих больший стандартный электродный потенциал, чем у водорода (от Cu2+ до Au3+), при электролизе практически полностью восстанавливаются на катоде;
2) катионы металлов, имеющих малый стандартный электродный потенциал (от Li+до Al3+ включительно), не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды;
3) катионы металлов, имеющих стандартный электродный потенциал, меньший, чем у водорода, но больший, чем у алюминия (от Al3+ до H+), при электролизе на катоде восстанавливаются одновременно с молекулами воды.
Если же водный раствор содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения алгебраической величины стандартного электродного потенциала  соответствующего металла. Так, из смеси катионов Ag+, Cu2+, Fe2+ сначала будут восстанавливаться катионы серебра (Е0 = + 0,80 В), затем катионы меди (Е0 = + 0,34 В) и последними – катионы железа (Е0 = – 0,44 В).
соответствующего металла. Так, из смеси катионов Ag+, Cu2+, Fe2+ сначала будут восстанавливаться катионы серебра (Е0 = + 0,80 В), затем катионы меди (Е0 = + 0,34 В) и последними – катионы железа (Е0 = – 0,44 В).
Характер реакций, протекающий на аноде, зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод. Обычно аноды подразделяются на нерастворимые и растворимые. Первые изготавливаются из угля, графита, платины, иридия; вторые – из меди, серебра, цинка, кадмия, никеля и других металлов.
На нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды. При этом анионы бескислородных кислот (например S2–, I–, Br–, Cl–) при их достаточной концентрации легко окисляются. Если же раствор содержит анионы кислородных кислот (например, SO42–, NO3–, CO32–, PO43–), то на аноде окисляются не эти ионы, а молекулы воды с выделением кислорода.
Растворимый анод при электролизе сам подвергается окислению, т.е. посылает электроны во внешнюю цепь. При отдаче электронов смещается равновесие между электродом и раствором:
Ме 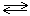 Меn+ + ne–
Меn+ + ne–
металл уходят уходят во
анода в раствор внешнюю
цепь
и анод растворяется.
Законы электролиза
Количественные характеристики электролиза выражаются двумя законами Фарадея:
1) Масса вещества, выделяющегося на электроде, прямо пропорциональна количеству прошедшего через электролит электричества.
2) При электролизе различных химических соединений одинаковые количества электричества выделяют на электродах массы веществ, пропорциональные их электрохимическим эквивалентам.
Эти два закона можно объединить в одном уравнении:
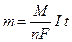 ,
,
где m – масса выделяющегося вещества, г;
n – количество электронов, переносимых в электродном процессе;
F – число Фарадея (F =96485 Кл/моль)
I – сила тока, А;
t – время, с;
M – молярная масса выделяющегося вещества, г/моль.
Величина  называется электрохимическим эквивалентом вещества. Если продолжительность электролиза измерять в часах, то число Фарадея должно быть выражено в ампер-часах. В этом случае F =26,8 А×ч/моль.
называется электрохимическим эквивалентом вещества. Если продолжительность электролиза измерять в часах, то число Фарадея должно быть выражено в ампер-часах. В этом случае F =26,8 А×ч/моль.
Вследствие параллельных побочных процессов масса вещества, получаемого при электролизе, оказывается часто меньше той, которая соответствует количеству прошедшего электричества. Отношение массы вещества, реально выделенного на электроде, к теоретической и умноженное на 100%, называют выходом по току: 
Примеры решения задач
Задача 1.
Какой из следующих процессов протекает при электролизе водного раствора NaI на графитовом аноде?
а) Na – e- = Na+; б) 2I– – 2e- = I2;
в) 4OH– – 4e- = 2H2O + O2; г) 2H2O – 4e- = O2 + 4H+;.
Решение:
При электролизе водных растворов солей на аноде возможны два процесса окисления:
1. процесс окисления анионов соли (кислотного остатка):
2I– – 2e- = I2
2. процесс электрохимического окисления молекул воды:
2H2O – 4e- = O2 + 4H+.
В данном случае на аноде будут окисляться анионы хлора, т.к. для электрохимического окисления воды необходима большая положительная поляризация анода.
Ответ: 2I– – 2e- = I2
Задача 2.
Какое вещество и в каком количестве выделится на катоде при электролизе раствора Hg(NO3)2 (анод графитовый) в течение 10 минут при силе тока 8А?
Решение:
При электролизе водных растворов солей на катоде возможно протекание двух восстановительных процессов. Один из них – восстановление катионов металла:
Hg2+ + 2e- = Hg.
Другой возможный процесс – восстановление водорода из молекул воды:
2H2O + 2e- = H2 + 2OH–.
В данном случае на катоде будут восстанавливаться катионы ртути, т.к. этот металл входит в группу малоактивных металлов, и для его восстановления необходима меньшая отрицательная поляризация электрода, чем для восстановления водорода.
На катоде: Hg2+ + 2e- = Hg;
Количество выделившейся ртути, согласно законам Фарадея, равно:
mHg =  I t (сек)=
I t (сек)=  × 8 × 600 = 5 г.
× 8 × 600 = 5 г.
Контрольные вопросы
317. Составьте схему электролиза раствора сульфата меди (анод медный и графитовый). В ответе укажите вещества, выделившиеся на катоде и аноде.
318. Сколько граммов меди выделится на катоде при электролизе раствора CuCl2 (анод инертный) в течение 40 минут при силе тока 1,2 А. Составьте схему электролиза.
319. Составьте схему электролиза раствора нитрата калия (анод-инертный). В ответе укажите вещества, выделившиеся на катоде и аноде.
320. Сколько граммов cеребра выделится на катоде при электролизе раствора AgNO3 (анод инертный) при силе тока 8 А в течение 15 минут? Составьте схему электролиза.
321. Найдите объем водорода (н.у.), который выделится при пропускании тока силой в 3 А в течение 1 часа через водный раствор H2SO4. Составьте схему электролиза этого раствора.
322. Сколько литров водорода выделится на катоде при электролизе раствора MgCl2 (анод инертный) в течение 30 минут при силе тока 1,5 А. Составьте схему электролиза.
323. Электролиз раствора NaI (анод графитовый) проводили при силе тока 6 А в течение 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах, и вычислите массу веществ, выделившихся на катоде и на аноде.
324. Составьте схему электролиза раствора и расплава хлорида кальция (анод-инертный). В ответе укажите вещества, выделившиеся на катоде и аноде.
325. Сколько литров кислорода выделится на катоде при электролизе раствора NiSO4 (анод угольный) в течение 20 минут при силе тока 2,5 А. Составьте схему электролиза.
326. Составьте схему электролиза раствора и расплава хлорида калия (анод-графитовый). В ответе укажите вещества, выделившиеся на катоде и аноде.
327. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора CuCl2. Вычислите массу меди, выделившейся на катоде, если на аноде выделилось 560 мл газа (н.у.).
328. Составьте схему электролиза раствора хлорида никеля (анод-никелевый и графитовый).
329. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора CdCl2. Вычислите массу кадмия, выделившегося на катоде, если на аноде выделилось 280 мл газа (н.у.).
330. Составьте схему электролиза раствора нитрата свинца (анод графитовый и свинцовый).
331. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе расплава MgCl2. Вычислите массы веществ, выделившихся на катоде и на аноде при пропускании 48250 Кл электричества через этот расплав.
332. Составьте схему электролиза раствора нитрата ртути (анод графитовый).
333. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора KOH. Вычислите объем кислорода (н.у.), который выделится при пропускании через этот раствор тока силой в 3 А в течение 1 часа.
334. Составьте схемы электролиза растворов нитрата свинца и хлорида свинца (анод свинцовый).
335. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора KI. Вычислите массы веществ, выделившихся на катоде и на аноде при пропускании 10 F электричества через этот раствор.
336. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора KI. Вычислите массы веществ, выделившихся на катоде и на аноде при пропускании 10 F электричества через этот раствор.
337. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора АgNO3. Вычислите массы веществ, выделившихся на катоде и на аноде при пропускании 2 F электричества через этот раствор.
338. Составьте схемы электролиза растворов хлорида и сульфата никеля (анод-никелевый и графитовый).
339. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора CdCl2. Вычислите массу кадмия, выделившегося на катоде, если на аноде выделилось 280 мл газа (н.у.).
340. Электролиз раствора сульфата цинка проводили в течение 5 часов, в результате чего выделилось 6 л (н.у.) кислорода. Составьте уравнения электродных процессов и вычислите силу тока.
341. Электролиз сульфата меди проводили с медным анодом в течение 4 часов при силе тока 50 А. При этом выделилось 224 г меди. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной). Составьте уравнения электродных процессов, происходящих на электродах в случае медного и угольного анода.
342. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе расплава и водного растворов КОН. Сколько литров (н.у.) газа выделится на аноде, если электролиз проводить в течение 30 мин. при силе тока 0,5 А?
343. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора КBr. Какая масса вещества выделится на катоде и аноде, если электролиз проводить в течение 1 ч. 30 мин. при силе тока 15 А?
344. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора NaОН. Чему равна сила тока, если в течение 1ч 15 мин 20 с на аноде выделилось 6,4 г газа? Сколько литров газа (н.у.) выделилось при этом на катоде?
345. При электролизе расплава хлорида калия на катоде получили калий массой 7,8 г. Определите объем газа (н.у.), который выделился на аноде. Составьте уравнения электродных процессов, происходящих на электродах.
346. При рафинировании меди ток силой 50 А выделяет за 10 ч 550 г меди. Определите выход меди по току.
Коррозия металлов
Коррозия – это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой. В результате постепенного разрушения металла механические свойства и внешний вид предмета заметно ухудшаются, и он рано или поздно приходит в негодность. Образование ржавчины – частный случай коррозии, то есть разрушение металлов под действием окружающей среды. Во всех случаях металлы при коррозии превращаются в соединения, где они проявляют положительную степень окисления, поэтому любая коррозия – это окисление металла. Различают два основных вида коррозии – химическую и электрохимическую.
Химическая коррозия происходит при взаимодествии металлов с сухими газами или жидкостями-неэлектролитами (бензином, маслом). Большой вред наносит газовая коррозия – окисление металлов кислородом воздуха, сернистым газом, галогенами. От газовой коррозии разрушаются многие детали инженерных конструкций – турбины, корпусы автомобилей и кораблей, сопла ракетных двигателей и т.д. Скорость коррозии заметно увеличивается при нагревании.
Электрохимическая коррозия металлов происходит под действием растворов электролитов, которое сопровождается возникновением электрического тока. Электролитом может служить морская вода, речная вода, конденсированная влага, растворы солей кислот, щелочей. Как правило, металлы и сплавы неоднородны, содержат включения различных примесей. При контакте их с электролитами одни участки поверхности начинают выполнять роль анода (отдают электроны), а другие – роль катода (принимают электроны). На аноде (более активном металле) идет окисление атомов металла.

Рис. 8.1 Основная схема электрохимической коррозии
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
Анодный –окисление металла А: Me0 – ne– =Men+
И катодный – восстановление ионов водорода или молекул кислорода, растворенного в воде, К: 2H+ + 2e– =H2
K: O2 + 2H2O + 4e– =4OH–.
Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами.
Примеры решения задач
Задача 1
Склепаны два металла. Укажите, какой из металлов подвергается коррозии:
а) Mn – Al; б) Sn – Bi.
Решение:
а) Al в ряду напряжений находится перед марганцем и имеет более отрицательное значение стандартного электродного потенциала, поэтому при контакте этих двух металлов Al будет анодом, а Mn - катодом. Окисляться, т.е. подвергаться коррозии, будет алюминий.
б) В этом случае корродировать будет олово, т.к. в ряду напряжении оно расположено впереди висмута и, следовательно, является электрохимически более активным.
Ответ: Al, Sn.
Задача 2
Какие из нижеперечисленных металлов выполняют для свинца роль анодного покрытия: Pt, Al, Cu, Hg?
Решение:
Анодное покрытие – это нанесение на защищаемое изделие электрохимически более активного металла. Из перечисленных металлов электрохимически более активным (по сравнению со свинцом) является алюминий.
Ответ: Al.
Задача 3
Какие из нижеперечисленных металлов выполняют для свинца роль катодного покрытия: Ti, Mn, Ag, Cr?
Решение:
Катодное покрытие – это нанесение на защищаемое изделие электрохимически менее активного металла. Из перечисленных металлов электрохимически менее активным (по сравнению со свинцом) является серебро.
Ответ: Ag.
Задача 4
Укажите продукт коррозии при контакте Zn – Ni в нейтральной среде.
Решение.
При контакте двух металлов различной электрохимической активности возникает гальванический элемент. В нейтральной среде:
А (–) Zn| H2O, O2 | Ni (+) K
Так как цинк электрохимически более активен, он будет окисляться (корродировать). На никеле будет протекать восстановительный процесс (в нейтральной среде – кислородная деполяризация):
А (–): Zn – 2e- = Zn2+
K (+): 2H2O + O2 + 4e- = 4OH–
Продукт коррозии – Zn(OH)2.
Ответ: Zn(OH)2.
Задача 5
Укажите продукт коррозии при контакте Zn – Ni в кислой среде (HCl).
Решение.
При контакте двух металлов различной электрохимической активности возникает гальванический элемент. В кислой среде:
A (–) Zn|HCl| Ni (+) K
Так как цинк электрохимически более активен, он будет окисляться (корродировать). На никеле будет протекать восстановительный процесс (в кислой среде – водородная деполяризация):
А (–): Zn – 2e- = Zn2+
K (+): 2H+ + 2e- = H2.
Продукт коррозии: ZnCl2.
Ответ: ZnCl2.
Контрольные вопросы
347. Железо покрыто марганцем. Какой из металлов будет окисляться при коррозии в атмосферных условиях? Запишите схему коррозии и определите продукт коррозии.
348. Железо покрыто серебром. Какой из металлов будет окисляться при коррозии в атмосферных условиях? Запишите схему коррозии и определите продукт коррозии.
349. Алюминий покрыт марганцем. Какой из металлов будет окисляться при коррозии в атмосферных условиях? Запишите схему коррозии и определите продукт коррозии.
350. Какие металлы могут выполнять для стальных изделий роль катодных покрытий: Ni, Cr, Mn, Sn, Cu? Запишите схему коррозии никелированного железа и определите продукт коррозии во влажном воздухе?
351. Какие металлы могут выполнять для стальных изделий роль анодных покрытий: Аl, Cr, Ni, Mn, Sn, Cu? Запишите схему коррозии хромированного железа и определите продукт коррозии во влажном воздухе?
352. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний-никель. Какие продукты коррозии образуются в первом и во втором случаях?
353. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары медь-никель. Какие продукты коррозии образуются в первом и во втором случаях?
354. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары медь-серебро. Какие продукты коррозии образуются в первом и во втором случаях?
355. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары железо- свинец. Какие продукты коррозии образуются в первом и во втором случаях?
356. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары цинк-марганец. Какие продукты коррозии образуются в первом и во втором случаях?
357. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары медь-алюминий. Какие продукты коррозии образуются в первом и во втором случаях?
358. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары хром-никель. Какие продукты коррозии образуются в первом и во втором случаях?
359. Железное изделие покрыли никелем. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Укажите продукты коррозии.
360. Золотое изделие покрыли серебром. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Укажите продукты коррозии.
361. Железное изделие покрыли алюминием. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Укажите продукты коррозии.
362. Железное изделие покрыли хромом. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Укажите продукты коррозии.
363. Железное изделие покрыли серебром. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Укажите продукты коррозии.
364. Железное изделие покрыли оловом. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Укажите продукты коррозии.
365. Железное изделие покрыли свинцом. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Укажите продукты коррозии.
366. В контакте с какими металлами медь выполняет роль анода: Fe, Au, Pd, Zn, Cr? Запишите схему коррозии меди, покрытой никелем и определите продукт коррозии во влажном воздухе.
367. В контакте с какими металлами олово выполняет роль катода: Fe, Au, Pd, Zn, Cr? Запишите схему коррозии луженого железа и определите продукт коррозии во влажном воздухе.
368.. В контакте с какими металлами железо выполняет роль анода: Al,Cd, Pd, Zn, Cr? Запишите схему коррозии оцинкованного железа в кислой среде.
369. В контакте с какими металлами медь выполняет роль катода: Fe, Au, Сd, Ag, Sn, Cr? Запишите схему коррозии позолоченного железа в нейтральной среде.
370. В контакте с какими металлами медь выполняет роль анода: Fe, Au, Pd, Sn, Cr? Запишите схему коррозии хромированного железа в кислой среде.
371. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
372. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
373. Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде.
374. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
375. Какое покрытие металла назувается анодным и какое – катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и в кислой среде.
376. Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Какой состав продуктов коррозии?