В соответствии с принципом Ле Шателье, нагревание вызывает смещение равновесия в сторону того из двух встречных процессов, протекание которого сопровождается поглощением теплоты. Значит повышение температуры вызывает возрастание константы равновесия эндотермического процесса. Естественно, что понижение температуры приводит к смещению равновесия в сторону того процесса, протекание которого сопровождается выделением теплоты. Охлаждение благоприятствует экзотермическому процессу и вызывает увеличение константы его равновесия.
Изменение давления также влияет на равновесие.
При постоянной температуре константа равновесия не изменяется под действием давления. Однако относительные количества исходных веществ и продуктов под действием давления изменяются в том направлении, которое предсказывается принципом Ле Шателье. Если повысить давление при постоянной температуре, объем смеси газов уменьшается, а концентрация реагентов увеличивается. В этом случае повышение давления будет компенсироваться тем, что реакция пойдет в направлении, соответствующем уменьшению суммарного числа молей присутствующих газов (в направлении уменьшения концентрации). При уменьшении давления смещение равновесия произойдет в сторону реакции с большим числом молей.
На равновесие влияет и изменение концентрации.
В соответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо реагента вызывает сдвиг равновесия в том направлении, при котором его концентрация уменьшается. Поэтому избыток исходного вещества (исходных веществ) вызывает смещение равновесия вправо. Добавление продукта (продуктов) реакции вызывает смещение равновесия влево.
Задача 1.
В какую сторону сместится равновесие реакции 2SO2(г)+O2(г) 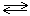 2SO3(г); DH° <0 при повышении температуры?
2SO3(г); DH° <0 при повышении температуры?
Решение.
Поскольку DH°<0, теплота выделяется в ходе прямой реакции, которая является экзотермической. Обратная реакция будет эндотермической. Повышение температуры всегда способствует протеканию реакции с поглощением теплоты, т.е. равновесие сместится в сторону исходных веществ.
Ответ: влево.
Задача 2. Дана система
N2(г) + 3H2(г)  2NH3(г); ΔН<0.
2NH3(г); ΔН<0.
Определить, в каком направлении сместится равновесие, если:
а) в системе повысить давление; б) понизить температуру; в) увеличить концентрацию водорода.
Решение:
Константа равновесия данной реакции запишется следующим образом:

 .
.
Если в системе повысить давление, то объем уменьшится, а концентрация реагентов возрастет. Следовательно смещение равновесия произойдет в сторону реакции, уменьшающей концентрацию. Так как в данной реакции в левой части уравнения 4 моль вещества, а в правой – 2 моль, то смещение равновесия произойдет вправо.
Реакция экзотермическая, то есть идет с выделением тепла. Если понизим температуру, то смещение равновесия произойдет вправо, в сторону экзотермической реакции.
При увеличении концентрации водорода смещение равновесия произойдет в сторону реакции, уменьшающей концентрацию водорода, в данном случае вправо.
Контрольные вопросы
61. В каком направлении произойдет смещение равновесия системы:
H2(г) + 2S(тв)  2H2S(г), ∆Н0<0,
2H2S(г), ∆Н0<0,
если а) повысить температуру системы; б) увеличить концентрацию водорода.
62. В каком направлении сместится равновесие в системах:
а) СО(г) + Cl2(г)  СОCl2(г) б.) H2(г) + I2(г)
СОCl2(г) б.) H2(г) + I2(г)  2Н2I(г),
2Н2I(г),
если при неизменной температуре уменьшить давление путем увеличения объема газовой смеси?
63. В каком направлении произойдет смещение равновесия системы:
С(т) + СO2(г)  2СО(г); ∆H0 > 0,
2СО(г); ∆H0 > 0,
если а) понизить температуру системы, б) понизить давление в системе?
64. В каком направлении произойдет смещение равновесия системы:
2SО3(г)  2SО2(г) + О2(г); ∆H0 > 0
2SО2(г) + О2(г); ∆H0 > 0
если а) повысить температуру системы, б) понизить концентрацию SO2?
65. В каком направлении произойдет смещение равновесия системы:
4HCl(г) + О2(г)  2H2О(г) + 2Cl2(г); ∆H0<0
2H2О(г) + 2Cl2(г); ∆H0<0
а) температуру повысить: б) объем увеличить?
66. Как надо изменить концентрацию А2 и температуру, чтобы сместить равновесие системы вправо?
А2(г) + В2(г)  2АВ(г); ∆H0 > 0
2АВ(г); ∆H0 > 0
Написать выражение константы равновесия.
67. Напишите выражение константы химического равновесия для реакции
MgCO3(т)  MgO(т) + CO2(г); ∆H0 < 0.
MgO(т) + CO2(г); ∆H0 < 0.
Какими способами можно сместить химическое равновесие этой реакции вправо?
68. При состоянии равновесия в системе:
N2(г) + 3H2(г)  2NH3(г); ∆H0 < 0
2NH3(г); ∆H0 < 0
определить, в каком направлении сместится равновесие
а) с ростом температуры; б) при уменьшении объема реакционного сосуда?
69. Как изменится скорость прямой и обратной реакции в системе:
2SO2(г) + O2(г)  2SO3(г); ∆Н°< 0,
2SO3(г); ∆Н°< 0,
если уменьшить объем реактора в 2 раза? Повлияет ли это на равновесие в системе?
70. Указать, какими изменениями концентраций реагирующих веществ можно сместить вправо равновесие реакции:
С(т) + СO2(г)  2СО(г); ∆H0 > 0
2СО(г); ∆H0 > 0
71. При каких условиях равновесие реакции:
4Fe(тв.) + 3O2(г)  2Fe2O3(тв),
2Fe2O3(тв),
будет смещаться в сторону разложения оксида?
72. Метанол получается в результате реакции:
СО(г) + 2H2(г)  CH3OH(ж); ∆Н°< 0.
CH3OH(ж); ∆Н°< 0.
Как будет смещаться равновесие при повышении
а) температуры, б) давления?
73. Как повлияет на выход хлора в системе:
4HCl(г) + O2(г)  2H2O(г) + 2Cl2; ∆H0 < 0,
2H2O(г) + 2Cl2; ∆H0 < 0,
а) повышение температуры в системе, б) уменьшение общего объема смеси,
в) уменьшение концентрации кислорода, г) увеличение общего объема реактора,
д) введение катализатора?
74. В каком направлении сместится равновесие в системах:
1) N2O4(г)  2NO2(г); ∆H0 > 0
2NO2(г); ∆H0 > 0
2)2СО(г) + O2(г)  2СО2 (г); ∆H0< 0,
2СО2 (г); ∆H0< 0,
если а) понизить температуру, б) повысить давление?
75. В каком направлении сместится равновесие в системах:
1) 2СО(г) + O2(г)  2СО2 (г); ∆H0 < 0,
2СО2 (г); ∆H0 < 0,
2) 2N2(г) + О2(г)  2N2O(г) ∆H0 >,0
2N2O(г) ∆H0 >,0
если а) повысить температуру, б) понизить давление?
76. Как повлияет на равновесие в следующей реакции:
FeO(т) + СO(г)  Fe(т) + CO2(г); ∆H0 > 0,
Fe(т) + CO2(г); ∆H0 > 0,
а) повышение температуры, б) повышение давления?
77. В каком направлении произойдет смещение равновесия системы:
2N2O5(г)  4NO2(г) + 2O2(г),
4NO2(г) + 2O2(г),
если а) увеличить концентрацию O2, б) расширить систему?
78. В каком направлении произойдет смещение равновесия системы:
3N2О(г) + 2NН3(г)  4N2(г) + 3Н2О; ∆H0 < 0
4N2(г) + 3Н2О; ∆H0 < 0
если а) повысить температуру системы, б) понизить концентрацию N2?
79. Указать, какими изменениями температуры и давления можно сместить влево равновесие реакции:
СО2(г) + Н2(г)  СО(г) + Н2О(г); ∆H0 < 0
СО(г) + Н2О(г); ∆H0 < 0
80. В каком направлении произойдет смещение равновесия системы:
А2(г) + 3В(г)  2С(т) + 4Д(г); ∆Н°< 0
2С(т) + 4Д(г); ∆Н°< 0
если а) повысить температуру системы; б) увеличить давление?
81. Указать, как необходимо воздействовать на систему
4HCl(г) + О2(г)  2H2О(г) + 2Cl2(г); ∆H0 < 0,
2H2О(г) + 2Cl2(г); ∆H0 < 0,
чтобы сместить равновесие влево:
а) увеличить концентрацию кислорода; б) увеличить концентрацию хлора; в) повысить давление; г) увеличить объем реакционного сосуда?
82. В каком направлении сместится равновесие в системе
4Fe(тв.) + 3O2(г)  2Fe2O3(тв),
2Fe2O3(тв),
при увеличении давления? Напишите выражение константы равновесия.
83. Какими воздействиями на систему
А(г) + В(г)  АВ(г); ∆H0 < 0,
АВ(г); ∆H0 < 0,
можно увеличить равновесную концентрацию продукта реакции АВ. Напишите выражение константы равновесия.
84. Как надо изменить давление и температуру в равновесной системе
А(т) + 2В(г)  С (т); ∆Н°< 0
С (т); ∆Н°< 0
чтобы сместить равновесие вправо? Напишите выражение константы равновесия.
85. В каком направлении произойдет смещение равновесия системы:
2H2(г) + O2(г)  2Н2О(г);; ∆Н°< 0,
2Н2О(г);; ∆Н°< 0,
если а) повысить температуру системы; б) увеличить концентрацию водорода. Напишите выражение константы равновесия.
86. В каком направлении произойдет смещение равновесия системы:
3Fe(тв.) + 4Н2О(г)  Fe3O4(г) + 4H2(г),
Fe3O4(г) + 4H2(г),
если: а) увеличить концентрацию водорода; б) уменьшить концентрацию паров воды?
87. В каком направлении произойдет смещение равновесия системы:
N2(г) + 3H2(г)  2NH3(г); ∆H0 < 0
2NH3(г); ∆H0 < 0
при понижении температуры? Как объяснить, что на практике синтез аммиака ведут при повышенной температуре?
88. Как надо изменить объем реакционной смеси и температуру в равновесной системе:
3О2(г)  2О3(г); ∆H0 > 0
2О3(г); ∆H0 > 0
чтобы сместить равновесие вправо? Напишите выражение константы равновесия
89. Вычислить константу равновесия системы
N2(г) + 3H2(г)  2NH3(г); ∆H0 < 0,
2NH3(г); ∆H0 < 0,
если в состоянии равновесия концентрация аммиака составляет 0,4 моль/л, азота – 0,03 моль/л, а водорода – 0,1 моль/л. Куда сместится равновесие системы при уменьшении объема реакционной смеси?
90.Определить равновесную концентрацию водорода в системе
2HI(г)  H2(г) + I2(г),
H2(г) + I2(г),
если исходная концентрация HI составляла 0,05 моль/л, а константа равновесия Кр = 0,02.