Скорость химических реакций в подавляющем большинстве случаев при повышении температуры возрастает, причем она очень чувствительна к изменению температуры.
Зависимость скорости реакции от температуры определяется эмпирическим правилом Вант-Гоффа, согласно которому при повышении температуры на каждые 100 С скорость гомогенной реакции возрастает примерно в 2-4 раза.
Правило Вант-Гоффа можно выразить соотношением
 ,
,
где  и
и 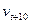 ;
;  и
и  - соответственно скорости и константы скорости реакции до и после повышения температуры на 100С,
- соответственно скорости и константы скорости реакции до и после повышения температуры на 100С,  - температурный коэффициент скорости реакции.
- температурный коэффициент скорости реакции.  - это число, показывающее во сколько раз возрастает скорость данной реакции при повышении температуры системы на 100С.
- это число, показывающее во сколько раз возрастает скорость данной реакции при повышении температуры системы на 100С.
В общем случае, если температура изменилась на Δt 0С, предыдущее уравнение преобразуется к виду:
 .
.
Задача 1. Дана система
N2(г) + 3H2(г)  2NH3(г); ΔН<0.
2NH3(г); ΔН<0.
Рассчитать изменение скорости прямой химической реакции, если обьем системы уменьшить в 2 раза.
Решение: В соответствии с законом действия масс запишем выражения скорости прямой реакции:



 ;
;
Система гомогенная, все вещества находятся в газообразном состоянии. При уменьшении обьема системы в 2 раза концентрация реагентов возрастает также в 2 раза. Запишем новые выражения скоростей реакции:

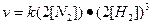 ;
;
Следовательно скорость прямой реакции возрастет в


 .
.
Задача 2.
В реакции С(т)+2H2(г)  CH4(г) концентрацию водорода уменьшили в 3 раза. Как изменится скорость реакции?
CH4(г) концентрацию водорода уменьшили в 3 раза. Как изменится скорость реакции?
Решение.
Согласно закону действия масс, начальная скорость реакции равна vн=k×[H2]2. После уменьшения концентрации водорода в 3 раза скорость станет равна  .. После изменения концентрации водорода скорость изменится следующим образом:
.. После изменения концентрации водорода скорость изменится следующим образом:  . Ответ: скорость реакции уменьшится в 9 раз.
. Ответ: скорость реакции уменьшится в 9 раз.
Задача 3. Как изменится скорость реакции при повышении температуры от 200С до 600С, если температурный коэффициент скорости реакции равен 2?
Решение: Для решения применим правило Вант-Гоффа:
 ;
;  .
.
Следовательно, скорость реакции при повышении температуры возрастет в 16 раз.
Задача 5. При температуре 500С некоторая реакция заканчивается за 2 мин. 15 с. Принимая температурный коэффициент скорости реакции равным 2, рассчитать, через какое время закончится эта реакция, если проводить ее при 700С?
Решение: По правилу Вант-Гоффа рассчитаем, во сколько раз изменится скорость реакции.
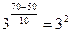 ; з начит отношение:
; з начит отношение:  .
.
Скорость реакции обратно пропорциональна времени реакции. Следовательно, можно записать:
 .
.
Отсюда находим:  .
.
Реакция закончится за 15 секунд.
Контрольные вопросы
31. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 300 С скорость реакции возрастет в 27 раз?
32. Во сколько раз следует увеличить концентрацию водорода в системе
N2(г) + 3H2(г)  2NH3(г); ∆H0 < 0,
2NH3(г); ∆H0 < 0,
Чтобы скорость реакции возросла в 1000 раз?
33. Во сколько раз следует увеличить концентрацию оксида углерода в системе
2CO = CO2 + C, чтобы скорость прямой реакции увеличилась в 4 раза?
34. Во сколько раз следует увеличить давление, чтобы скорость образования NO2 по реакции 2NO + O2  2NO2 возросла в 1000 раз?
2NO2 возросла в 1000 раз?
35. Написать уравнение скорости реакции горения угля (C) в кислороде и определить, во сколько раз увеличится скорость реакции:
а) при увеличении концентрации кислорода в 3 раза;
б) при замене кислорода воздухом.
36. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 32 раз, если температурный коэффициент скорости реакции равен 2?
37. Как изменится скорость прямой реакции в системе
2SO2(г) + O2(г)  2SO3(г);, если концентрацию SO2 увеличить в 2 раза, а концентрацию О2 уменьшить в 2 раза?
2SO3(г);, если концентрацию SO2 увеличить в 2 раза, а концентрацию О2 уменьшить в 2 раза?
38. Температурный коэффициент скорости реакции равен 2. Как изменится скорость реакции при повышении температуры на 400 С.
39. Окисление серы и ее диоксида протекает по уравнениям:
а) S(кр) + O2(г) → SО2(г) б) 2SО2(г) + О2(г)  2SО3(г).
2SО3(г).
Как изменится скорость этих реакций, если объем каждой из систем уменьшить в 4 раза?
39. Вычислить, во сколько раз изменится скорость реакции, протекающей в газовой фазе,
3N2О(г) + 2NН3(г)  4N2(г) + 3Н2О, если
4N2(г) + 3Н2О, если
а) давление системы уменьшить в два раза;
б) увеличить концентрацию аммиака в 3 раза?
40. Как изменится скорость реакции, протекающей в газовой фазе, при понижении температуры на 300 С, если температурный коэффициент скорости реакции равен 2.
41. Во сколько раз изменится скорость прямой реакции
СО(г) + Cl2(г)  СОCl2(г), если концентрацию СО увеличить от 0,03 до 0,12 моль/л, а концентрацию Cl2 уменьшить от 0,06 до 0,02 моль/л?
СОCl2(г), если концентрацию СО увеличить от 0,03 до 0,12 моль/л, а концентрацию Cl2 уменьшить от 0,06 до 0,02 моль/л?
42. Температурный коэффициент скорости реакции равен 3. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры от 150 до 1800 С?
43. Во сколько раз изменится скорость прямой реакции
СО(г) + 2Н2(г)  СН3ОН(г), если
СН3ОН(г), если
а) уменьшить концентрацию СО в 5 раз;
б) уменьшить объем системы в 3 раза?
44. Как изменится скорость реакции, протекающей в газовой фазе, при понижении температуры от 170 до 1400 С? Температурный коэффициент скорости равен 3.
45. Реакция протекает по уравнению: NH3(г) + CO2(г) + H2O(пар)  NH4HCO3(тв). Как изменится скорость прямой реакции, если
NH4HCO3(тв). Как изменится скорость прямой реакции, если
а) увеличить объем системы в 3 раза;
б) уменьшить концентрацию аммиака и паров воды в 2 раза?
46. Температурный коэффициент скорости реакции равен 3. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 400 С?
47. Как изменится скорость прямой реакции
2CH4(г) +O2(г) +2H2O(г)  2 CO2(г) + 6H2(г), если
2 CO2(г) + 6H2(г), если
а) уменьшить концентрацию метана и кислорода в 3 раза;
б) уменьшить объем системы в 2 раза?
48. Чему равен температурный коэффициент реакции, если при повышении температуры на 200С скорость реакции изменится в 4 раза?
49. Реакция идет по уравнению 2CH4(г) +O2(г)  4H2(г) + 2 СО(г).
4H2(г) + 2 СО(г).
Как изменится скорость обратной реакции, если
а) уменьшить объем системы в 4 раза;
б) увеличить концентрацию водорода в 2 раза?
50. Чему равен температурный коэффициент скорости реакции, если скорость реакции, протекающей в газовой фазе, изменилась в 16 раз при понижении температуры на 200С?
51. Реакция идет по уравнению:
Cl2O(г) + H2O(г)  2HClO(ж).
2HClO(ж).
Концентрация исходных веществ составляет [Cl2O] = 0,35 моль/л и [H2O] = 1,3 моль/л. Как изменится скорость прямой реакции, если изменить концентрации веществ до 0,4 моль/л и 0,9 моль/л соответственно?
52. Вычислить, во сколько раз изменится скорость реакции, протекающей в газовой фазе, если понизить температуру от 130 до 900 С. Температурный коэффициент скорости реакции равен 2.
53. Как изменится скорость обратной реакции, протекающей в газовой фазе по уравнению:
2N2O5  4NO2 + O2, если
4NO2 + O2, если
а) уменьшить концентрацию NO2 в 2 раза;
б) уменьшить давление в системе в раза?
54. Во сколько раз изменится скорость реакции, протекающей в газовой фазе, если температуру повысить на 600С? Температурный коэффициент скорости реакции γ = 2.
55. Константа скорости реакции разложения N20,протекающей по уравнению 2N20 = 2N2 + 02, равна 5∙10-4. Начальная концентрация N20 равна 6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, когда разложится 50% N20.
56. Вычислить, во сколько раз изменится скорость реакции, протекающей в газовой фазе, если понизить температуру на 400С? Температурный коэффициент скорости реакции равен 2.
57. Реакция идет по уравнению:
4HCl(г) + О2(г)  2H2О(г) + 2Cl2(г).
2H2О(г) + 2Cl2(г).
Как изменится скорость обратной реакции если
а) давление увеличить в 3 раза;
б) концентрацию HCl увеличить в 2 раза?
58. Чему равен температурный коэффициент скорости реакции, если при понижении температуры на 300С скорость реакции, протекающей в газовой фазе, изменится в 81 раз?
59. Реакция идет по уравнению:
FeO(т) + СO(г)  Fe(т) + CO2(г).
Fe(т) + CO2(г).
Как изменится скорость обратной реакции если
а) давление увеличить в 3 раза;
б) концентрацию CO2 увеличить в 7 раз?
60. Чему равен температурный коэффициент реакции, протекающей в газовой фазе, если при повышении температуры на 200С, скорость реакции изменится в 4 раза?
Константа равновесия
Все химические реакции можно разделить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца – до полного израсходования одного из реагирующих веществ. Например, разложение нитрата аммония:
NH4NO3 ® 2H2O + N2O.
Обратимая реакция может протекать как в прямом, так и в обратном направлении. Примером обратимой реакции может служить синтез иодоводорода:
H2(г) + I2(г)  2HI(г).
2HI(г).
В начале, при смешении исходных веществ, скорость прямой реакции велика, а обратной – равна нулю. Согласно закону действия масс выражение для скорости прямой реакции запишется следующим образом:
 |  |

Исходные вещества в процессе реакции будут расходоваться, следовательно скорость прямой реакции будет уменьшаться. Одновременно появятся продукты реакции, их концентрация будет возрастать. Начнет идти обратная реакция, скорость которой будет увеличиваться:



Когда скорости прямой и обратной реакций станут одинаковыми, наступит химическое равновесие.






 ;
; 
 =
= 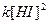 или
или 
Отношение констант скоростей прямой и обратной реакции тоже представляет собой константу. Она называется константой равновесия данной реакции – K.


 K =
K =  .
.
Отсюда окончательно:

Концентрации, приведенные в правой части этого выражения, называются равновесными концентрациями. Константа равновесия при постоянной температуре представляет собой постоянную величину.
Если записать обратимую реакцию в общем виде:
aA + bB  cC + dD,
cC + dD,
то константа равновесия выразится уравнением:
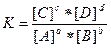 .
.
Если все компоненты реакции находятся в газообразном состоянии,то выражение константы равновесия можно записать через парциальные давления:
 .
.
Уравнения константы равновесия показывают, что в данных условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Изменение концентрации любого из этих веществ влечет за собой изменения концентраций всех остальных веществ; в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
Разобранные примеры являются примерами гомогенного равновесия. В качестве примера гетерогенного равновесия рассмотрим реакцию разложения известняка:
 CaCO3(т)
CaCO3(т)  CaO(т) + CO2(г).
CaO(т) + CO2(г).
Простейшее выражение для константы равновесия этой реакции:
Концентрации чистых жидкостей и твердых веществ просто исключаются из выражений констант равновесия. (Однако они входят в нее неявным образом).
До тех пор пока твердые известняк и негашеная известь находятся в контакте с газом, их влияние на равновесие не изменится. Следовательно, члены CaCO3 и CaO в выражении для константы равновесия остаются постоянными и могут быть включены в K. При этом получается новое выражение:
 ;
;  .
.
Рассмотрим еще один пример – испарение воды:
H2O(ж)  H2O(г).
H2O(г).
Этот процесс может формально рассматриваться как химическая реакция. Запишем выражение константы равновесия:
 .
.
Поскольку [  (ж)] – постоянная величина (до тех пор пока в наличии имеется жидкая вода), можно включить ее в константу равновесия. Таким образом получается выражение:
(ж)] – постоянная величина (до тех пор пока в наличии имеется жидкая вода), можно включить ее в константу равновесия. Таким образом получается выражение:
 ;
; 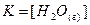 .
.
Принцип Ле-Шателье
Влияние изменения условий на положение равновесия определяется правилом, которое получило название принципа Ле Шателье.
Если на систему, находящуюся в истинном равновесии, воздействовать извне, изменяя какое-либо из условий, определяющих положение равновесия, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Система перейдет из одного состояния равновесия в другое, отвечающее новым условиям. Это происходит потому, что внешнее воздействие в разной степени изменяет скорость двух взаимнопротивоположных реакций.
Принцип Ле Шателье справедлив и для равновесных систем, не связанных с химическими превращениями (кипение, кристаллизация, равновесие и т.д.).