Na2SiO3 – соль сильного основания и слабой кислоты гидролизуется по аниону:
Na2SiO3 ↔ 2Na+ + SiO32-
SiO32- двухзарядный ион, значит, гидролизуется по двум ступеням. Гидролиз обычно протекает только по первой ступени:
SiO32- + H2O ↔ HSiO3– + OH–(ионно-молекулярная форма);
Na2SiO3 + Н2О ↔ NaHSiO3 + NaOH (молекулярная форма).
Образующийся избыток ионов OH– придаёт раствору щелочную среду, рН > 7.
б) При добавлении к раствору Na2SiO3 хлорида аммония, как соли, гидролизующейся по катиону, будет наблюдаться избыток ионов водорода Н+:
NH4Cl ↔ NH4+ + Cl–;
NH4+ + H2O ↔ NH4OH + H+.
Образуемый при гидролизе обеих солей избыток ионов Н+ и ОН¯ провзаимодействует между собой с образованием молекул Н2О (Н+ + ОН¯? Н2О). Дополнительное образование Н2О, согласно принципу Ле Шателье, сместит равновесие системы вправо, в сторону усиления гидролиза обеих солей.
7. Определить количественный состав смеси кремния, алюминия и карбоната кальция, если известно, что при обработке этой смеси раствором щелочи выделяется 8,96 л газа, а при обработке такой же навески исходной смеси раствором НСl также выделяется 8,96 л газа, пропускание которого через раствор Са(ОН)2 приводит к образованию 8,1 г Са(НСОз)2.
Со щелочью будут реагировать кремний и алюминий:
1) Si + 2NaOH + H2O = Na2SiO3 + 2H2
2) 2Al + 2NaOH + 6H2O = 2Na[Al (OH) 4] + 3H2 (реакция пойдет именно так, потому что добавляем раствор щелочи, а не сплавляем с чистой щелочью).
С соляной кислотой будут реагировать алюминий и карбонат кальция:
3) 2Al + 6HCl = 2AlCl3 + 3H2
4) CaCO3 + 2HCl = CaCl2 + CO2 + H2O.
В случае обработки кислотой имеем газовую смесь. Однако дальнейшее пропускание ее через раствор гидроксида кальция позволяет узнать, сколько в ней углекислого газа:
Ca (OH)2 + 2CO2 = Ca(HCO3)2
n (Ca(HCO3) 2) = m (Ca(HCO3) 2) / M (Ca(HCO3) 2) = 16,2/162 = 0,1 моль.
n (CO2) = 2*n (Ca(HCO3) 2) = 2*0,1 = 0,2 моль.
Переходим к уравнению 4).
n (CO2) = 0,2 моль. n (CaCO3) = n (CO2) = 0,2 моль.
V (CO2) = n (CO2) * Vm = 0,2*22,4 = 4,48 л. Тогда водорода при обработке смеси соляной кислотой выделяется: 8,96 - 4,48 = 4,48 л.
По уравнению 3):
n (H2) = V (H2) / Vm = 4,48/22,4 = 0,2 моль.
n (Al) = (n (H2) / 3) * 2 = (0,2/3) * 2 = 0,13 моль.
Переходим к уравнению 2):
n2 (H2) = (n (Al) / 2) * 3 = (0,13/2) * 3 = 0,195 моль. V2 (H2) = 4,48 л.
Всего при обработке смеси раствором щелочи выделилось 8,96 л водорода. Сколько выделилось при реакции с алюминием, выяснили. Значит при реакции с кремнием:
V1 (H2) = 8,96 – 4,48 = 4,48 л
n1 (H2) = 4,48/22,4 = 0,2 моль.
По уравнению 1):
n (Si) = n (H2) / 2 = 0,2/2 = 0,1 моль.
n (Si) = 0,1 моль. = > m (Si) = M (Si) * n (Si) = 28*0,1 = 2,8 г.
n (Al) = 0,4 моль. = > m (Al) = M (Al) * n (Al) = 27*0,4 = 10,8 г.
n (CaCO3) = 0,2 моль. = > m (CaCO3) = M (CaCO3) * n (CaCO3) = 100*0,2 = 20 г.
8. Сколько миллилитров 28%-ного раствора NаОН (р = 1,31 г/см) потребуется для растворения кремния, образовавшегося при прокаливании 6г магния с 6г SiO2
1) n(Mg)= 6г/24г/моль= 0.25 моль
2) n(SiO2)= 6г/60г/моль= 0.1 моль
3) 2Mg+SiO2=Si+2MgO
4) n(Si)= n(SiO2)= 0.1 моль
5) H2O+Si+2NaOH=Na2SiO3+2H2
6) 2n(NaOH)= n(Si)==0.2 моль
7) m (NaOH) = n*Mr/u=0.2 моль *40 г/моль/ 28%= 28.5 г
8) V=m/p = 28.5 г/1.31 г/см = 21.75 мл
9. Определите объем воздуха (н.у.) необходимый для полного сгорания 60 л (н.у.) метана (СН4).
Дано:
объем (н.у.) сгоревшего метана: V(СН4) = 60 л.
Найти:
объем (н.у.) расходовавшегося воздуха: Vвозд. =?
Решение:
Данных, представленных в условии, явно недостаточно для решения задачи. Нам необходимо дополнительно знать количественный состав воздух.
В данном случае в реакции горения метана принимает участие только кислород. Все остальные компоненты представляют собой неактивные примеси. Записываем уравнение реакции:
СН4 + 2О2 = СО2 + 2Н2О
Алгоритм решения можно представить следующим образом:

1. По уравнению горения определим объем кислорода, необходимого для сгорания 60 л метана.

Составим пропорцию:
для сгорания 60 л (СН4) необходимо х л (О2) (по условию)
для сгорания 22,4 л (СН4) необходимо 44,8 л (О2) (по уравнению)

Можно было также найти объем кислорода по закону объемных отношений.
2. Используя дополнительную информацию о содержании кислорода в воздухе, определяем объем воздуха:
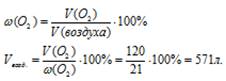
Ответ: 571 л воздуха (н.у.) потребуется для полного сгорания 60 л (н.у.) метана.