·  – определение количества вещества (N0 – число Авогадро).
– определение количества вещества (N0 – число Авогадро).
·  – определение молярной массы вещества (m – масса вещества).
– определение молярной массы вещества (m – масса вещества).
·  – масса молекулы.
– масса молекулы.
·  – число молекул, содержащихся в произвольном количестве вещества.
– число молекул, содержащихся в произвольном количестве вещества.
·  – определение абсолютной температуры идеального газа (ИГ).
– определение абсолютной температуры идеального газа (ИГ).
· p = 2/3 nε; pV = 2/3 E k; pV = mυ 2 /3 – основные уравнение молекулярно–кинетической теории идеального газа, где p – давление газа, n – число молекул в единице объема, ε – средняя кинетическая энергия поступательного движения молекул, V – объем газа, Eк – суммарная кинетическая энергия поступательного движения всех молекул газа, m – масса газа, υ – средняя квадратичная скорость молекул.
· pV0 = RT; pV = mRT/M – уравнение Менделеева – Клапейрона, где V0 – молярный объем, T – температура, R – молярная газовая постоянная, V – объем газа, m – масса газа, m/M = ν – количество вещества, М – молекулярная масса.
·  – уравнение состояния ИГ.
– уравнение состояния ИГ.
·  – закон Бойля – Мариотта.
– закон Бойля – Мариотта.
·  – закон Гей–Люссака.
– закон Гей–Люссака.
·  – закон Шарля.
– закон Шарля.
·  – объединенный газовый закон.
– объединенный газовый закон.
· р = nĸT; p = 2/3 nε; p = ρυ 2 /3; p = mυ 2 /3V – давление газа, где
k = R/N0, k – постоянная Больцмана, N0 – постоянная Авагадро,
ρ – плотность газа.
· n = N0p/RT; N = N0pV/RT; ρ = Mp/RT; m = MpV/RT – концентрация молекул n, число молекул N.
· ν = m/M; ν = V/V0; ν = n/n0; ν = pV/RT; ν = U/U0; ν = N/N0 – количество вещества ν (моль), где U0 – внутренняя энергия (1 моль), U – внутренняя энергия ν моль газа.
· V0 = M/ρ; ρ = m/V; v ' = V/m; N0 = N/  ; m0 = M/N0; D
; m0 = M/N0; D  (1/3)ℓ υ – м олярный объем газа V0, плотность газа ρ, удельный объем газа v ', m0 – масса одной молекулы, D – коэффициент диффузии молекул.
(1/3)ℓ υ – м олярный объем газа V0, плотность газа ρ, удельный объем газа v ', m0 – масса одной молекулы, D – коэффициент диффузии молекул.
· ε =m0υ 2 / 2 = 3/2 kT; ε = 3 pV0/ 2 N0 – средняя кинетическая энергия поступательного движения молекулы.
· U0 = iRT/2 = εN0; U0 = Mυ 2 /2; U = mυ 2 /2; U = iνRT/2 = =εN0ν; U = ipV/2 – внутренняя энергия идеального газа, где i – число степеней свободы.
·  – закон распределения молекул ИГ по скоростям. Продифференцировав f(v) по скорости, приравняв к нулю, получим
– закон распределения молекул ИГ по скоростям. Продифференцировав f(v) по скорости, приравняв к нулю, получим 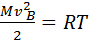 . Откуда при N =, M =, следует с
. Откуда при N =, M =, следует с 
 , максимум
, максимум  и кривая смещается вправо
и кривая смещается вправо  , и наоборот. Площадь под кривой
, и наоборот. Площадь под кривой  При условии T =, i =, N =, с
При условии T =, i =, N =, с  максимум
максимум  и кривая смещается влево
и кривая смещается влево 
· 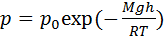 – барометричеcкая формула, где
– барометричеcкая формула, где  – давление на высоте моря,
– давление на высоте моря,  – высота над уровнем моря. Газы с
– высота над уровнем моря. Газы с  exp
exp 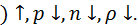 При условии
При условии 
 Тяжелые молекулы сосредоточены ближе к Земле, легкие – выше над Землей.
Тяжелые молекулы сосредоточены ближе к Земле, легкие – выше над Землей.
· QТ = A; QV = ∆U =  ; QР = ∆U + A =
; QР = ∆U + A =  –первое начало термодинамики для изотермического, изохорического, изобарического процессов, где Q –количество теплоты, A – работа газа.
–первое начало термодинамики для изотермического, изохорического, изобарического процессов, где Q –количество теплоты, A – работа газа.
·  ν
ν  A = 0,
A = 0,  – изменение внутренней энергии, работа, изменение энтропии при изохорическом процессе.
– изменение внутренней энергии, работа, изменение энтропии при изохорическом процессе.
·  ;
;  ν
ν 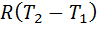 ;
;  ν
ν  ;
;  – первый закон термодинамики, работа, изменение внутренней энергии, изменение энтропии при изобарическом процессе.
– первый закон термодинамики, работа, изменение внутренней энергии, изменение энтропии при изобарическом процессе.
· 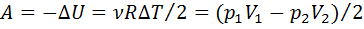 – работа ИГ при адиабатическом процессе.
– работа ИГ при адиабатическом процессе.
·  – работа газа при изобарном расширении.
– работа газа при изобарном расширении.
·  – работа газа при изотермическом расширении.
– работа газа при изотермическом расширении.
· ∆U v =  ; ∆U p =
; ∆U p =  – изменение внутренней энергии идеального газа, при постоянном объеме и постоянном давлении.
– изменение внутренней энергии идеального газа, при постоянном объеме и постоянном давлении.
·  ,
, 
 – уравнение адиабатического процесса (уравнение Пуассона).
– уравнение адиабатического процесса (уравнение Пуассона).
·  ;
;  ;
;  ;
;  – энтропия, изменение энтропии при обратимом (об) процессе.
– энтропия, изменение энтропии при обратимом (об) процессе.
·  ;
;  ;
;  ;
;  – энтропия, изменение энтропии при необратимом (н) процессе.
– энтропия, изменение энтропии при необратимом (н) процессе.
·  ,△U = 0, △
,△U = 0, △  – работа, изменение внутренней энергии и изменение энтропии при изотермическом процессе (m =, M =, N =).
– работа, изменение внутренней энергии и изменение энтропии при изотермическом процессе (m =, M =, N =).
·  – изменение энтропии при изохорическом (m =, M =, N =) процессе.
– изменение энтропии при изохорическом (m =, M =, N =) процессе.
·  – изменение энтропии при изобарическом (m =, M =, N =) процессе.
– изменение энтропии при изобарическом (m =, M =, N =) процессе.
· Цикл Карно. Участки: T1 = const  , ∆Q = 0
, ∆Q = 0  ,
,
T2 = const  , ∆ Q = 0
, ∆ Q = 0 
· Параметры ИГ на участке 1 – 2: Q > 0; A > 0; ∆ S > 0; T =; V ↑; p ↓; U =; ρ ↓; n ↓; υ =; ε =; l ↑; D ↑.
· Параметры ИГ на участке 2 – 3: ∆ Q = 0; A > 0; ∆ S = 0; T ↓; V ↑; p ↓;
U ↓; ρ ↓; n ↓; υ ↓; ε ↓; l ↑.
· Параметры ИГ на участке 3 – 4: Q < 0; A < 0; ∆ S < 0; T =; V ↓; p ↑;
∆U =; ρ ↑; n ↑; υ =; ε =; l ↓; D ↓.
· Параметры ИГ на участке 4 – 1: Q = 0; A < 0; ∆ S = 0; T ↑; V ↓; p ↑; U ↑; ρ ↑; n ↑; υ ↑; ε ↑; l ↓; D↓.
·  – термический коэффициент полезного действия для кругового процесса.
– термический коэффициент полезного действия для кругового процесса.
·  – термический коэффициент полезного действия цикла Карно.
– термический коэффициент полезного действия цикла Карно.
Теплоемкость
·  – определение теплоемкости тела.
– определение теплоемкости тела.
·  – определение удельной теплоемкости вещества.
– определение удельной теплоемкости вещества.
·  – определение молярной теплоемкости вещества.
– определение молярной теплоемкости вещества.
·  – определение удельных теплот: плавления (кристаллизации), парообразования (конденсации), сгорания топлива.
– определение удельных теплот: плавления (кристаллизации), парообразования (конденсации), сгорания топлива.
·  – уравнение теплового баланса.
– уравнение теплового баланса.
·  – уравнение Ван–дер–Ваальса для моля реального газа.
– уравнение Ван–дер–Ваальса для моля реального газа.