 |
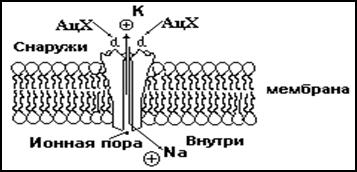
Рис. 6 Схема белка образующего рецепторный ацетилхолиновый канал
АцХ-активируемый канал образован пятью белковыми субъединицами. Две из них, -субъединицы одинаковы, остальные три - , - и -субъединицы - различаются. Их молекулярная масса варьирует от 40000 до 65000, все пять субъединиц образуют трубчатую структуру с общей мол. массой около 250000. Эти данные согласуются с размерами каналообразных структур, которые наблюдаются при электронно-микроскопических исследований и пронизывают мембрану.
Каналы выступают из мембраны с обеих сторон, причем над наружной ее поверхностью возвышается воронкообразная структура, образующая вход в канал.
Рецепторный участок канала располагается на наружной поверхности мембраны. Каждая из двух -субъединиц канала содержит участок связывания АцХ. Если к обоим этим участкам присоединяется лиганд (АцХ или какой-либо его агонист, например карбахолин или никотин), то канал с переходит из закрытого состояния в открытое. Этот процесс лучше всего изучен на мышцах лягушки, в двигательных концевых пластинках которых располагаются АцХ - активируемые каналы.
Каналы двигательной концевой пластинки скелетных мышц лягушки при активации ацетилхолином становятся проницаемыми как для К+, так и для Na+. При этом возникает входящий ток, потенциал реверсии для которого составляет около -10 мВ. Плотность АцХ - активируемых каналов в этой области равна примерно 104/мкм2.
Активный транспорт
При нормальном состояние внутриклеточная концентрация различных неорганических веществ зависит от типа клеток (табл. 1),.
Таблица 1
Концентрация некоторых ионов внутри и снаружи в мышечной клетке* и в спинальных мотонейронах млекопитающих (ммоль/л)
| Ион | Внутри клетки | Снаружи клетки |
| Na+ | 10,0*-15,0 | 120,0*-150,0 |
| K+ | 140,0*-150,0 | 2,5*-5,5 |
| Ca+ | <10-8 * | 2,0* |
| Cl- | 4,0*-9,0 | 120*-125 |
| НСО3- | 8,0* | 27,0* |
| А- | 155,0* | 5,0* |
однако следует учесть общие закономерности. Концентрация ионов К+ в цитоплазме наиболее велика; его содержится в 10-30 раз больше, чем во внеклеточной жидкости. Напротив, внутриклеточная концентрация свободных ионов Na+ и Сl, меньше (примерно 1:10), чем внеклеточная. Еще одна важная особенность состоит в том, что концентрация Са2+ внутри клеток на несколько порядков ниже, чем во внеклеточной жидкости. Это обусловливается во первых активным транспортом Са2+ наружу через клеточную мембрану, а во вторых поглощением этого иона другими органеллами, митохондриями и цитоплазматическим ретикулумом. В результате концентрация Са2+ в цитоплазме обычно бывает существенно ниже 10-6 М.
Клеточные мембраны гораздо более (примерно в 30 раз) проницаемы для К+, чем для Na+.
Проницаемость мембран для С1- варьирует. У одних клеток она близка к проницаемости для К+, у других ниже. Проницаемость клеточной мембраны для Na+ довольно низка, но не настолько, чтобы полностью предотвратить проникновение этого катиона в клетку.
Содержание натрия, калия и кальция в среде, есть с одной стороны, состояние жесткой гомеостатической константы, а с другой, процесс с высокой степенью осцилляции. Для поддержания гомеостатической константы ионов в мембрану встроен механизм активного транспорта ионов (рис.7), который обеспечивает перераспределение, их против градиента концентрации обеспечивая стабильность градиента ионов. Мембранные
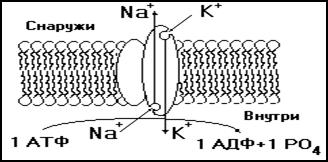 |
Рис.7 Схема Na/K –насоса – АТФазы, погруженной в липидный бислой плазматической мембраны.
белки переносят ионы через мембрану против концентрационного градиентов, потребляя для этого метаболическую энергию.
Наиболее важный процесс активного транспорта - это работа Na/K-насоса, существующего практически во всех клетках; насос выкачивает ионы натрия из клетки, одновременно накачивая ионы калия внутрь клетки. Таким образом обеспечивается низкая внутриклеточная концентрация ионов натрия и высокую ионов калия (таб.1). Градиент концентрации ионов натрия на мембране имеет специфические функции, связанные с передачей информации в виде электрических импульсов, а также с поддержанием других активных транспортных механизмов и регулирования объема клетки. Поэтому, более 1/3 энергии, потребляемой клеткой, расходуется на Na/K-насос, а в некоторых наиболее активных клетках на его работу расходуется до 70% энергии.
Na/К-транспортный белок представляет собой АТФазу, состоящую из четырех функциональных субединиц, двух больших и двух малых. На внутренней поверхности мембраны она расщепляет АТФ на АДФ и фосфат (рис7).
На транспортировку трех ионов натрия из клетки и одновременно двух ионов калия в клетку используется энергия одной молекулы АТФ, т. е. суммарно за один цикл из клетки удаляется один положительный заряд. Таким образом, Na/K-насос является электрогенным (создает электрический ток через мембрану), что приводит к увеличению электроотрицательности мембранного потенциала.
Транспортный белок выполняет эту операцию с высокой скоростью: от 150 до 600 ионов натрия в секунду. Аминокислотная последовательность транспортного белка известна, однако еще не достаточно изучен механизм этого сложного обменного транспорта. Данный процесс описывают с использованием энергетических профилей переноса белками ионов натрия или калия. По характеру изменения этих профилей, связанных с постоянными изменениями конформации транспортного белка (процесс, требующий затраты энергии), можно судить о стехиометрии обмена: два иона калия обмениваются на три иона натрия.
Na/K-насос, как и изолированная Na+/К+ -зависимая мембранная АТФаза, специфически ингибируется сердечным гликозидом уабаином (сгрофантином). Работа Na/K-насоса представляет собой многоступенчатую химическую реакцию, она, подобно всем химическим реакциям, в значительной степени зависит от температуры. Если изолированный препарат охладить примерно на 18°С, то поток ионов натрия из клетки быстро уменьшится в 15 раз, и сразу после нагревания восстановится до исходного уровня. Такое уменьшение потока ионов натрия из клетки в несколько раз больше, чем - то, которое бы соответствовало температурной зависимости процесса диффузии или простой химической реакции. Сходный эффект наблюдается, когда запас метаболической энергии истощается в результате отравления динитрофенолом (ДНФ), химический реагент блокирующий АТФазную активность. В связи с этим следует,что поток ионов натрия из клетки обеспечивается энергозависимой реакцией - активным насосом.
Другой характеристикой насоса наряду со значительной температурной и энергетической зависимостью является наличие уровня насыщения (как и у всех других химических реакций); это означает, что скорость работы насоса не может возрастать бесконечно при повышении концентрации транспортируемых ионов. В тоже время поток пассивно диффундирующего вещества растет пропорционально разности концентраций
Помимо Na/K-насоса плазматическая мембрана содержит еще один насос - кальциевый; это насос откачивает ионы кальция Са2+ из клетки и участвует в поддержании их внутриклеточной концентрации на крайне низком уровне (табл. 1).
Кальциевый насос присутствует с очень высокой плотностью в саркоплазматическом ретикулуме мышечных клеток, которые накапливают ионы кальция в результате расщепления молекул АТФ.
Таким насос образом, обеспечивает идеальную компенсацию пассивных диффузионных токов, является электрогенным за счет разницы в числе перенесенных в клетку и из клетки зарядов.
Активность Na/K-насоса регулируется внутриклеточной концентрацией ионов натрия. Скорость работы насоса замедляется при снижении концентрации ионов натрия, подлежащих выводу из клетки, так что работа насоса и поток ионов натрия внутрь клетки уравновешивают друг друга, поддерживая внутриклеточную концентрацию ионов натрия на уровне примерно 10 ммоль/л.
Для поддержания равновесия между насосными и пассивными мембранными токами, необходимо намного больше молекул Na/K-насоса, чем канальных белков для ионов калия и натрия. При открытом состоянии канала через него проходят десятки тысяч ионов за несколько миллисекунд, а поскольку канал обычно открывается несколько раз в секунду, всего за это время через него проходит более 108 ионов. Одиночный насосный белок перемещает несколько сотен ионов натрия в секунду, следовательно, плазматическая мембрана должна содержать примерно в 1000 раз больше насосных молекул, чем канальных.
Измерения канальных токов в покое показали наличие в среднем одного калиевого и одного натриевого открытого канала на 1 мкм2 мембраны; из этого следует, что на том же пространстве должно присутствовать около 1000 молекул Na/K-насоса, т.е. расстояние между ними составляет в среднем 34 нм; диаметр насосного белка, как и канального, составляет 8-10 нм. Таким образом, мембрана достаточно плотно насыщена насосными молекулами.
Потоки ионов натрия внутрь клетки, а ионов калия из клетки компенсируемое работой насоса, имеет и другое значение, заключающееся в сохранении стабильного осмотического давления и постоянного объема.
Внутри клетки существует высокая концентрация крупных анионов, главным образом белков А- (табл. 1), которые не способны проникать через мембрану (или проникают через нее очень медленно), поэтому являются фиксированным компонентом внутри клетки. Чтобы уравновесить заряд этих анионов, необходимо равное количество катионов. Благодаря действию Na/K-насоса этими катионами в основном оказываются ионы калия.
Существенное повышение внутриклеточной концентрации ионов могло бы происходить только при возрастании концентрации анионов вследствие потока Сl- по градиенту концентрации в клетку (табл. 1), но мембранный потенциал противодействует этому. Входящий ток Сl- присутствует только до тех пор, пока не будет достигнут равновесный потенциал для ионов хлора, это наблюдается, когда градиент ионов хлора практически противоположен градиенту ионов калия, (ионы хлора заряжены отрицательно).
Таким образом, устанавливается низкая внутриклеточная концентрация ионов хлора, соответствующая низкой внеклеточной концентрации ионов калия.
Если мембранный потенциал уменьшается, при блокаде Na/K-насоса, например при аноксии, то равновесный потенциал для ионов хлора снижается, а внутриклеточная концентрация ионов хлора соответственно повышается. Восстанавливая равновесие зарядов, ионы калия также входят в клетку; суммарная концентрация ионов в клетке возрастает, что повышает осмотическое давление; это заставляет воду поступать в клетку. Клетка набухает. Такое набухание наблюдается in vivo в условиях недостатка энергии.
.Значение Na/K-насоса для клетки не ограничивается стабилизацией нормальных градиентов К+ и Na+ на мембране. Энергия, запасенная в мембранном градиенте Na+, часто используется для обеспечения мембранного транспорта других веществ. Например, сотранспорт Na+ и молекулы сахара в клетку.
Мембранный транспортный белок переносит молекулу сахара в клетку даже против градиента концентрации, в то же время Na+ движется по градиенту концентрации и потенциала, обеспечивая энергию для транспорта сахаров. Такой транспорт сахаров полностью зависит от существования высокого градиента Na+. Если внутриклеточная концентрация Na+ существенно возрастает, то транспорт cахаров прекращается. Для различных cахаров существуют разные сотранспортные системы.
Транспорт аминокислот в клетку сходен с транспортом сахаров, он также обеспечивается градиентом Na+; существует по крайней мере пять различных систем сотранспорта, каждая из которых специализирована для какой-либо одной группы родственных аминокислот.
Помимо сотранспортных систем существуют также антисотранспортных. Одна из них, например, за один цикл переносит один ион кальция из клетки в обмен на три входящих иона натрия. Энергия для транспорта Са2+ образуется за счет входа трех ионов натрия по градиенту концентрации и потенциала. Этой энергии достаточно (при потенциале покоя) для поддержания высокого градиента ионов кальция (менее 10-7 моль/л внутри клетки до приблизительно 2 ммоль/л вне клетки).