Биологическая мембрана это много функциональная структура представляющая граничный слой, формирующий замкнутые участки организма, клетки и органеллы клеток и разделяющая внутреннюю среду от внешней. Морфофункциональное строение мембраны обеспечивает ей проявление высокого уровня электрической активности.
В основе структуры мембраны лежит бимолекулярный липидный слой, этот слой непроницаем для ионов, и проявляет свойства диэлектрика. Внешняя и внутренней среда, обладая высокой электропроводностью, в месте с липидным слоем формирует электрический конденсатор, способный накапливать и удерживать электрические заряды, таким образом мембрана, обладает электрической емкостью. В липидный бислой мембраны встроены каналы, по которым, неорганические ионы могут проходить и переносить электрические заряды, эти каналы придают мембране электропроводность.
Биологическую мембрану, удобнее представлять в виде эквивалентной электрической цепи (рис.8), которая состоит из параллельно соединенных конденсатора и сопротивления. Конденсатор “С” эквивалент диэлектрического липидного бислоя и двусторонней токопроводящей среды примыкающих к нему, а сопротивление “R” эквивалент проводимости, обусловленной электропроводностью ионных каналов. Исследования показали, что удельное сопротивление “R” мембраны составляет, в состоянии покоя 1*103 – 1*104 Ом/см2, при возбуждении удельное сопротивление мембраны уменьшается и достигает 25 Ом/см2. ЭТО свидетельствует о зависимости удельного сопротивления мембраны от плотности и состоянии проводящих ионных каналов и подвижности ионов.
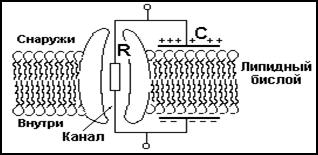 |
Рис. 8 схема электрического эквивалента биологической мембраны.
C – электрическая емкость мембраны. R – электрическое сопротивление.
Удельная емкость мембраны составляет 1*10-6Ф/см2 (1мкф/см2), что соответствует расчетным показателям (при толщине липидного слоя 5нм и диэлектрической постоянной мембранных липидов равной 3).
Электрический эквивалент мембраны объясняет воздействие локального импульса тока на соседние и удаленные участки мембраны имеющей большую протяженность (мембрана аксонов нейронов).
Так аксон нейрона в отношении электрических свойств можно представить, как электрический кабель, используемый в радиотехнике для передачи электрических сигналов. Кабельная линия состоит, из токопроводящей жилы - “аксоплазма нервного волокна”, покрытой изолирующей оболочкой - “липидный слой мембраны”. Поверх изолирующей оболочки уложен токопроводящий экран - “внеклеточная среда”. Качество кабеля (величина затухания – ослабления сигнала) зависит от электрического сопротивления внутренней жилы “диаметр нервного волокна, удельное сопротивление аксоплазмы 30 Ом/см” и от свойств изолирующей оболочки “количества проводящих каналов, удельное сопротивление 1000 Ом/см2“. Сопротивление внеклеточной среды составляет 20 Ом/см. Эквивалентная электрическая схема такого кабельного элемента представлена на (рис.9).
Локальное воздействие импульса тока Vс, затухает на элементах представленной схемы. Величина затухания определяется в основном значениями величины сопротивлений Rk,
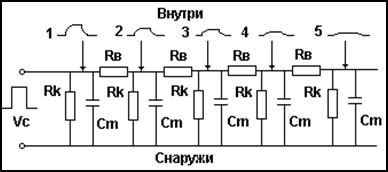 |
Рис.9 Принципиальная схема электрического эквивалента мембраны аксона. Ra – электрическое сопротивление аксоплазмы. Rk – электрическое сопротивление ионных каналов мембраны. Cm – электрическая емкость мембраны. Vc – локальное импульсное воздействие. 1, 2, 3, 4, 5 – распределение электрического импульсного воздействия в электрической цепи образованной мембранное аксона.
которое может, изменятся в зависимости от количества каналов на мембране. При миелинизации мембраны, когда количество активных каналов уменьшается, снижается и величина затухания, таким образом, локальный электрический стимул сохраняет свою величину на большем удалении от точки воздействия. Рассмотренные свойства мембраны, формируют для мембран функциональное качество - кабельные свойства
При образовании клетки, замкнутой структуры, имеющей разделенную внешнюю и внутреннюю среду, при наличии на мембране ионных каналов, активных транспортных систем, создаются условия, когда мембрана становится источником ЭДС (источником электрического тока).
Внешняя среда клеток представлена внеклеточной интерстициальной жидкостью, которая омывает клетки. Интерстициальная жидкость имеет относительно низкое содержание белков – анионов и высокие концентрации ионов натрия и хлора. Внутриклеточная жидкость, наоборот богата белками, аминокислотами и ионами калия (таб. 1).Ионная разница Na, K в средах, создается активно, работой Na/K – насоса при затрате энергии АТФ.
Мембрана клетки по своей природе является полупроницаемой, она способна через калиевые каналы пассивно обеспечивать поток калия из внутренней среды во неклеточную по градиенту концентрации ионов. При этом анионы (белки, аминокислоты), не в состоянии покидать внутриклеточную среду. Такое положение ионов, нарушает начальное электронейтральное равновесие сред (внешней, внутренней). Если ранее положительный заряд ионов калия, во внутриклеточной среде, был уравновешен, то при диффузии, потенциал внутренней среды клетки становится не скомпенсированным (отрицательным), напротив, потенциал внешней среды приобрел положительное значение за счет положительных зарядов диффундированного калия. В следствие этого, на мембране возникает электрохимическая разность потенциалов, величина которого определяется концентрацией иона на внутренней и наружной сторонах мембраны. Мембрана клетки, приобретая заряды, становится поляризованной, и является источником ЭДС. Установившийся потенциал на мембране стабилизируется, и препятствует дальнейшему переносу ионов по градиенту концентрации (равновесный потенциал).
Величина равновесного потенциала для ионов К может быть рассчитана из уравнения Нернста.
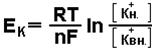 |
где Ек – равновесный потенциал для К+ , R – газовая постоянная, Т – абсолютная температура, F – число Фарадея, n – валентность иона, Кн – Квн – наружная и внутренняя концентрации ионов.
Полная электрохимическая разность потенциалов мембраны определяется распределением ионов Na+ и Cl-. Для каждого из ионов может быть рассчитан равновесный потенциал, исходя из концентрации иона (таб.1).
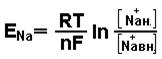
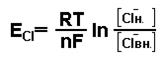
Однако разность потенциалов, сформированная на мембране не равна алгебраической сумме равновесных потенциалов, а определяется с учетом подвижности через мембрану каждого иона.
Электрический эквивалент источников ЭДС на мембране представлен, на (рис. 10).
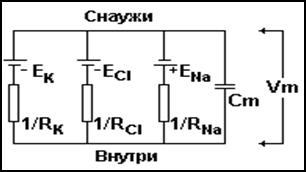
Рис.10 Схема электрического эквивалента мембраны, как источника ЭДС.
ЕК – равновесный потенциал калия = -90мВ. ЕNa - равновесный потенциал натрия = +60мВ. ЕCl - равновесный потенциал хлора = -70мВ. Vm – мембранный потенциал = -70мВ. Cm – постоянная электрическая емкость мембраны. 1/RK, 1/RNa, 1/RCl – проводимость каналов.
Расчет мембранного потенциала по уравнению Гольдмана с учетом проводимости для каждого иона показал, что величина потенциала равна -70мВ.
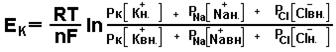
где, РK, PNa, PCl, - константы проницаемости для ионов, в состоянии покоя, для гигантского аксона кальмара, их отношение составляет РK: PNa: PCl = 1:004:045. Расчеты показывают, что основной потенциал мембраны формируется преимущественно, равновесным потенциалом калия и только незначительная утечка ионов натрия во внутрь, меняет этот потенциал.
Ион хлора, не участвует в формировании потенциала мембраны, он пассивно распределен за счет равновесного электрохимического потенциала мембранытак как ион хлора может пассивно диффундировать через мембрану. Однако, этот ион в некоторых клеточных мембранах, где присутствуют специфические ионные каналы и его активный транспорт формирует равновесный электрохимический потенциал.
Равновесный электрохимический потенциал клеточной мембраны в состоянии покоя называется потенциалом покоя (ПП).
Потенциал покоя клетки, это сумма метаболического и диффузного потенциалов величина которого может изменятся, при изменении условий среды. Если на мембрану клетки подействовать электрическим током, то на мембране произойдут сдвиги равновесного состояния. Так при воздействии внешнего источника тока, когда катодный электрод (-) находится с внутренней стороны мембраны, а анодный электрод (+) с наружной стороны мембраны произойдет нарушение равновесного потенциала для ионов калия. Ионы калия дополнительно будут диффундировать из клетки и потенциал мембраны будет еще более отрицательным, произойдет гиперполяризация мембраны. При смене полярности внешнего источника тока, происходит смещение равновесного потенциала для ионов натрия. Ионы натрия начинают поступать во внутрь клетки, происходит уменьшение электроотрицательности мембраны, мембрана деполяризуется. Изменения мембранного потенциала при действии внешнего источника тока представлены на (рис. 11).
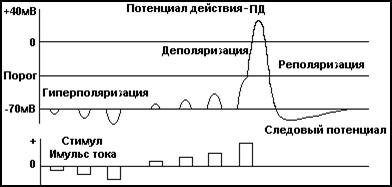 |
Рис. 11
Основными методами при электрофизиологических исследованиях являются методы раздражения и регистрации разностей потенциалов между различными участками тканей или клеток. При этом регистрируют временные изменения этой разности потенциалов, которая обычно возникает в ответ на электрическое раздражение; она проявляется также при естественных раздражениях, в результате процессов обмена веществ и даже в отсутствии какого-либо раздражения. В физиологии периферических нервов наиболее распространена следующая схема опыта: электрическое раздражение - ткань - регистрация изменений потенциала.
Целью настоящей работы является: обучение и приобретение навыков студентами в исследованиях функциональных систем организма.
ЭЛЕКТРОННАЯ АППАРАТУРА
СТИМУЛЯТОРЫ
Как правило, раздражение должно изменять жизненные процессы в ткани, в результате чего в возбудимой ткани обычно возникает возбуждение (импульс). Прибор, генерирующий электрический ток для раздражения, называется стимулятором. Один из наиболее простых стимуляторов (ЭСЛ-2 Г5-26) представляет собой генератор прямоугольных импульсов с независимой регулировкой их частоты (f), длительности (t) амплитуды (V) и задержкой раздражающего импульса относительно импульса синхронизации. На рис. 1 представлена функциональная схема электростимулятора.
Генератор частоты следования (1) задает частоту следования импульсов тока. Каскад задержки (2) формирует время между импульсами синхронизации и раздражающими импульсами. Каскад формирования выходных импульсов (3) регулирует длительность импульсов раздражения. Усилитель мощности (4) формирует, регулирует амплитуду, полярность выходного импульсного сигнала.
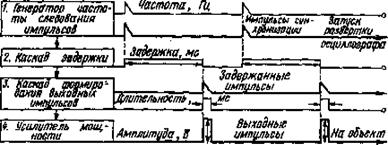
Рис. 1. Функциональная схема электростимулятора ЭСЛ-2
В физиологическом эксперименте с целью повышения достоверности воспроизведения результатов, электростимулятор к биологическому объекту подключают через изолирующую приставку (трансформатор}.
Изолирующая приставка обеспечивает гальваническую, емкостную развязку стимулятор- объект, тем самым исключается протекание тока раздражающего импульса (артефакт) через входные цепи усилителя биопотенциалов (УБП). Уменьшение тока по цепи стимулятор - объект - отводящие электроды - усилитель, исключает перегрузку УБП и позволяет повысить точность измерений.
Для некоторых экспериментов требуется, чтобы одиночный импульс был подан в определенный момент опыта. Это обеспечивается цепью внешнего запуска прибора. Обычно на передней панели стимулятора имеются две клеммы "Внешний запуск", при замыкании которых (тумблер) стимулятор подает одиночный импульс.
В других экспериментах нужна серия импульсов с определенной частотой повторения (f). Режим работы стимулятора — подача одиночного импульса или серии импульсов - определяется положением переключателя на передней панели прибора. Частота повторения импульсов регулируется переключателем и шкалой, про градуированных в импульсах в секунду (Гц). Так же регулируется и требуемое выходное напряжение (в вольтах, милливольтах). Обычно стимулятор позволяет регулировать и длительность импульса в пределах от 10 мкс до 10 с и более.
Часто стимулятор используют вместе с электроннолучевым осциллографом, так что реакция ткани на раздражение выявляется в виде отклонения луча осциллографа по вертикали. В этом случае стимулятор обычно генерирует импульс синхронизации, который запускает развертку осциллографа, а затем, после задержки, с выходных клемм стимулятора поступает раздражающий импульс. Таким образом, на экране осциллографа можно установить и момент раздражения и момент реакции ткани.
ЭЛЕКТРОДЫ
Электроды служат связующим звеном между объектом исследования и приборами. Существует много различных форм электродов, особенности которых определяются их назначением.
В зависимости от роли, выполняемой в данном эксперименте, электроды могут быть стимулирующими и отводящими (рис 2, Л — Н). Принципиальной разницы между теми и другими нет, так как один и тог же электрод может выполнять и ту, и другую функцию.
Если электроды предназначены для поляризации ткани, т. е. для воздействия на нее постоянным током, то их называют поляризующими.
По конструкции, рассчитанной на определенный способ отведения (или раздражения), различают биполярные (рис. 2, А, Д—Л), II униполярные (рис. 2, Б, В, М) электроды.
При униполярном методе отведения потенциалов, стимуляции и поляризации тканей различают активный электрод (дифферентный) и пассивный (индифферентный). Активный электрод располагают в зоне отведения потенциалов или на том участке ткани, который необходимо подвергнуть воздействию. Пассивный электрод помещают в некотором удалении от активного, обычно на участке ткани, имеющем низкий и относительно постоянный потенциал, либо на умерщвленном участке ткани, либо в окружающую объект жидкую электропроводную среду. При этом в ряде случаев необходимо, чтобы площадь поверхности, контактирующей с объектом, у пассивного электрода была в несколько раз больше, чем у активного. Индифферентные электроды часто бывают выполнены в виде пластинки из серебра или олова, (рис. 2, Н),
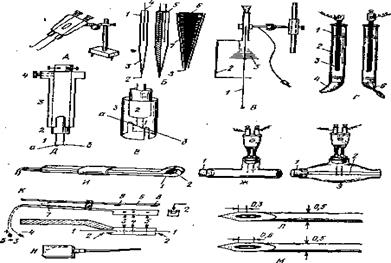
Рис. 2. Внешний вид и схемы различных типов электродов
Если электроды предназначены для расположения на поверхности объекта (на поверхности мышцы, мозга и т. п.), они называются поверхностными (рис. 2, Л, В, Г). Такие электроды используют и в тех случаях, когда исследуемый объект может быть выделен из окружающих тканей (например, участок нервного ствола) или когда оперативным путем открывается доступ к его поверхности.
Для работы с объектами, расположенными в глубине тканей, применяют погружные электроды (рис. 2, Б, Д—М). Конструктивная особенность этих электродов состоит в том, что их токопроводящая система (металлические проводники или электролит) защищена от соприкосновения с окружающими тканями, не являющимися объектом исследования.
Часто при физиологических исследованиях возникает необходимость применять неполяризующиеся электроды.
'* Существует ряд общих требований, предъявляемых ко всем электродам. Они не должны: 1) оказывать на объект вредного влияния, 2) менять свои свойства при прохождении через них тока и 3) становиться сами источником потенциалов. Последнее особенно важно при электрофизиологических исследованиях, когда отводимые потенциалы малы и могут быть значительно искажены поляризационными потенциалами.
Как известно, импульсные или переменный токи дают незначительный эффект поляризации, поэтому при работе с ними можно пользоваться металлическими электродами, не реагирующими с электролитами тканей объекта и не выделяющими ионов, изменяющих состояние объекта. Такими свойствами обладают благородные металлы (золото, серебро, платина), а'также нержавеющая сталь, никель, хром и др.
В противоположность этому постоянный ток, проходя через электроды и ткани объекта, вызывает ряд электрохимических процессов. В результате между электродами возникает разность потенциалов, противоположная по знаку воздействующему или отводимому потенциалу. Поэтому при воздействии на объект постоянным током, а также при отведении медленно изменяющихся или постоянных потенциалов необходимо применять нелоляризующиеся электроды.
Чаще всего в этих случаях используют серебряные электроды, поверхность которых электрохимическим путем покрыта тонким слоем хлорида серебра. Для их приготовления в сосуд из темного стекла с 0,9%-ным раствором NaCl (0,IH HC1) погружают серебряные и угольный электроды. К серебряным электродам подключают анод (+), а к угольному — катод (-) любого источника постоянного тока (например, батарея, аккумулятор) напряжением 1,5-^6 В. Затем пропускают постоянный ток плотностью от 0,1 до 10 А/м2 до тех пор, пока серебряные электроды не покроются сплошным слоем хлористого серебра (светлосерый налет, чернеющий на свету). При соприкосновении хлорированных электродов с объектом создается система Ag-AgCI-электролиты тканей объекта, дающая слабый поляризационный ток, которым можно пренебречь. Неполяризующиеся электроды другого типа представляют собой (рис. 2, Г) стеклянные трубки, заполненные насыщенным раствором ZnSC>4. В раствор 2 помещают цинковую альгамированную пластинку 3, которую получают погружением цинковой пластинки на несколько минут в 10%-ный раствор F^SO,,, а затем в ртуть. Нижний конец стеклянной трубки закрывают каолином, замешанным на растворе Рин-гера 4. Наружной части каолиновой пробки придают форму, удобную для контакта с объектом. Иногда пробку делают из гипса и вставляют в нее мягкую волосяную кисточку 5.
Когда объектом исследования являются микроструктуры (например, одиночные нервные клетки или мышечные волокна), на смену обычным макроэлектродам приходят .микроэлектроды. Они применяются для отведения потенциалов от одиночных клеток или от групп клеток. Потенциалы отводят как внеклеточно, подводя электрод близко к телу клетки, так и внутриклеточно, вводя электрод внутрь клетки.
Для внутриклеточного отведения обычно используют стеклянные микроэлектроды. Они представляют собой стеклянный капилляр (рис. 2, Б, I) с диаметром 1,5-ьЗ мм. Конец капилляра оттягивают (при нагревании) так, чтобы диаметр кончика 2 составлял доли микрометра (обычно меньше 0,5 мкм). Полость капилляра 3 заполняют ЗМ раствором KCI и в него погружают серебряную хлорированную проволоку 4, конец которой соединяют непосредственно с переходным устройством (катодный повторитель) и затем со входом усилителя.
Стеклянные микроэлектроды могут служить и для внутриклеточной стимуляции. Если при этом необходимо одновременно отводить потенциалы, то применяют спаренные двухканальные электроды (рис. 2,Б, 6). Они представляют собой два спаянных капилляра с оттянутыми концами, полости которых изолированы, друг от друга. Один канал такого электрода служит для униполярного отведения, другой—-для униполярного воздействия на клетку (например, анодом или катодом постоянного тока).
Стеклянные микроэлектроды с диаметром кончика больше 1 мкм применяют для и внеклеточных отведений. Внеклеточные потенциалы можно отводить металлическими микроэлектродами. Последние представляют собой стальную (нихром) иглу (рис. 2, Б,б), один конец которой затачивают (чаще всего электролитически) так, чтобы диаметр кончика 8 составлял 5-И5 мкм. Снаружи такую иглу покрывают изолирующим лаком 7, чтобы свободным от изоляции оставался только кончик.
Электроды для стимуляции и отведения могут применяться как в остром, так и в хроническом эксперименте. В последнем случае их иногда вживляют в ткани объекта. Такие электроды называют вживленными.
Некоторые конструктивные особенности электродов могут быть обусловлены стремлением приспособить их к специфике объекта исследования или расширить возможности их использования. Так, для отведения потенциалов от поверхности коры больших полушарий или мозжечка удобен «навесной» электрод (рис. 2, б). Благодаря тому, что его отводящий стержень из серебра подвешен к рамке из диэлектрика 2 на пружинящем волоске от часового баланса 3, электрод не давит на поверхность коры и не травмирует ее даже в случае значительной пульсации мозга.
Погружные электроды (рис. 2, Л, М), выполненные в виде тонких игл (диаметр 0,5 мм), предназначены для отведения биотоков от мышц или от подкорковых структур мозга.
Электроды в стеклянном изолирующем корпусе для стимуляции нервов теплокровных животных представлены на рис. 2, Ж, 3. Один из них, Ж, предназначен для раздражения пересеченного нерва. Нерв вводят внутрь трубки за привязанную к его концу лигатуру. Фиксации нерва достигают прижатием лигатуры пробкой. После этого электроды погружают в ткани, что препятствует охлаждению нервов.
Другие электроды, 3, могут служить для работы с непересеченными нервами. Для этого пробку вынимают, а нерв вводят внутрь корпуса через боковую прорезь 2, проходящую с одной стороны трубки по всей ее длине. Для непересеченных нервов предназначены также погружные электроды, представленные на рис. 2, И, К. Проводники тока у электродов И проходят по желобкам в пластинке из диэлектрика. В загнутой ее части они выступают и соприкасаются с нервом 2. В электродах К нерв. 1-1 проходит через прорези в корпусе 2 и контактирует с тремя серебряными проводниками 3, 4, 6. Два из них, 3 и J, соединены вместе и подключаются к аноду, а центральный проводник 4 подсоединяется к катоду. Это позволяет уменьшить распространение петель тока (внепо-люсное распространение тока). После того, как нерв помещен на электроды, полость корпуса сверху закрывают крышкой 6, прижимаемой пружинкой 7. При этом выступы на крышке 8 несколько опускают нерв, что обеспечивает его лучшее прилегание к электродам.
Электроды Д и Е (рис, 2) позволяют работать как на пересеченных, так и на целых нервах. Их можно использовать и как поверхностные Д и как погружные Е. В последнем случае электроды У с помещенным на них нервом а — б втягивают внутрь корпуса 3 так, чтобы нерв проходил
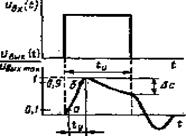
Рис. 3. Частотная и переходная характеристика усилителя
Для того чтобы усилить без искажений любой импульс биоэлектрической активности, нужно, чтобы усилитель был способен усилить все компоненты спектра синусоидальных частот, необходимые для правильного воспроизведения этого сигнала. Например, для передачи «быстрых» компонентов импульса необходимо, чтобы цепи усилителя пропускали высокочастотные составляющие спектра сигнала. Пропускание низкочастотных составляющих — необходимое условие усиления постоянного или медленно изменяющегося напряжения. Однако спектр сигналов различной формы может располагаться как в ограниченной. так и бесконечно широкой области частот. Усилительные устройства обладают конечной шириной полосы пропускания, поэтому под условной шириной спектра импульсов понимают все составляющие спектра сигнала, существенные для воспроизведения его формы с заданной точностью.
Нахождение спектров сигнала связано с применением рядов и интегральных преобразовании Фурье, что представляет определенную сложность. Задача может быть сведена к более простой оценке искажений отдельных компонентов сигнала при его прохождении через линейные RC-т-цепи усилительного тракта.
Излишняя неравномерность частотой характеристики в области граничных частот может нарушить исходные соотношения между амплитудами компонентов сложного сигнала. Обычно постоянные времени тв и т„ выбирают таким образом, чтобы в точках граничных частот коэффициент усиления составлял примерно 70 % от максимального значения (рис. 3). Как известно, граничные частоты связаны с тв и т„ соотношениями fB = (2лт„)"' fH = (2лтн)"', т. е., меняя величины тв и тн мы получаем возможность смещать граничные частоты, изменяя полосу пропускания усилителя. Так, одновременное увеличение тв и т„, приведет к сужению полосы со стороны высоких частот и расширению в области низких. Проведем анализ воздействия прямоугольного импульса на линейные RC-цепи усилителя. Не нарушая общности, результаты этого анализа могут быть распространены на импульсы, встречающиеся в практике электрофизиологического эксперимента, хотя они значительно отличаются от прямоугольных. При прохождении прямоугольного импульса через интегрирующую RC-цепь происходит замедление нарастания напряжения на выходе этой цепи, фронт импульса как бы «затягивается». При прохождении прямоугольного импульса через дифференцирующую RC-цепь по экспоненциальному закону происходит уменьшение напряжения на выходе этой цепи. Это явление искажения вершины («медленная» компонента) прямоугольного импульса иногда называется «скалыванием» плоской части сигнала. Так как усилительный тракт содержит оба вида цепей, то напряжение на вы ходе усилителя будет отличаться от входного уменьшенной крутизной фронта и «сколотой» вершиной. Такой вид изменения напряжения на выходе называется переходной характеристикой (рис. 3).
Переходные искажения, которым подвергается импульс, служат качественными показателями усилителей и характеризуются временем установления ty (равно времени, в течение которого напряжение на выходе изменяется от 10 до 90 % своего максимального значения — точки а и б на рис. 3) и величиной «скола» Дс - AUc/Umax, где AUC — напряжение скола. Несложно показать, что время установления связано с постоянной времени тв равенством ty = 2,2 тв
Величина «скола», характеризующая искажения плоской вершины импульса, выражается в процентах относительно максимального значения UBblx и определяется по формуле Дс - 1 - е"'/т".
Существует тесная связь между частотной и переходной характеристиками усилителей Дс =2л fHty и ty = 0,35 Гц. Это означает, что искажения «медленной» компоненты импульса будут тем меньше, чем меньше значение fH, т. е. чем шире полоса пропускания в области низких частот.
Выражения, связывающие ty, т„, fB и Дс, т, f|(, могут служить для выбора параметров схемы, для определения граничных частот частотной характеристики при усилении сигналов сложной формы. Параметры Дс, ty, характеризующие искажения прямоугольного импульса, являются своего рода калибровочными величинами, с помощью которых можно определять искажения импульсов различной формы.
Рис. 4. Импульсмонофазной электрограммы (А) и частотная характеристика (Б), соответствующая его воспроизведению без значительных искажений
Так, если на вход реального усилителя подать импульс с конечной длительностью фронта нарастания tH (Рис. 4), то искажения этого нарастающего напряжения могут быть приближенно учтены по следующей формуле:
Для сравнительно точного воспроизведения формы импульсов биоэлектрической активности могут быть рекомендованы следующие пределы полосы пропускания усилителя: для нервного импульса 10 Гц — 10 кГц, для ЭКГ 0,2-100 Гц, для ЭГ (монофазной) 0-^-200 Гц, для ЭЭГ 0,3-^200 Гц, для векторэлектрограммы (ВКГ) 0-^200 Гц.
В некоторых случаях при отведении монофазной ЭГ (когда tH достигает значений 1 мс) fB = 800 Гц.
В усилителях биопотенциалов, как правило, предусматривается возможность изменения полосы частот (ступенчатым переключением значений тв и тн — фильтров нижних и верхних частот).
Это вызвано необходимостью подавления различного рода мешающих сигналов при избирательной регистрации того или иного процесса. Например, помехами при отведениях нейрограммы («быстрый» процесс) могут быть медленные составляющие от механических движений, дыхания и т. д.
В электрофизиологии применяются также усилители постоянного тока, характерная особенность которых состоит в том, что они могут усиливать сколь угодно медленные электрические сигналы.
Нижняя граничная частота таких усилителей равна нулю (тн = О, т„ ^ со). Частотная характеристика в области высших частот в усилителях этого-типа имеет тот же вид, что и в усилителях переменного тока.
|
Одним из важных показателей, характеризующих работу усилителя, является входное сопротивление.
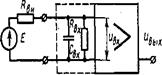
Рис. 5. Эквивалентная схема входной цепи усилителя
Схема измерения э.д.с. источника сигнала £ с внутренним сопротивлением RB1, при помощи усилителя с входным сопротивлением Rfix изображена на рис. 5, где Снх — емкость, образованная входной динамической емкостью усилительных элементов (лампы или транзисторы) и емкостью монтажа. При макроэлектродных отведениях влиянием этой емкости из-за малых ее значений можно пренебречь.
Напряжение, действующее непосредственно на входных зажимах усилителя, определяется выражением (UBX = E(RBH/RBS +!)"'. Таким образом, точность измерения величины Е будет тем больше, чем больше отношение RBH/RBX поэтому в усилителях напряжения, в частности в усилителях биопотенциалов RBX > RBII. Внутреннее сопротивление источников биоэлектрической активности может быть самым разным. Так, при внеклеточных отведениях ЭГ, ЭКТ RBII, различных источников колеблется от нескольких килоом до нескольких десятков килоом. Поэтому усилители электрокардиографов и векторкардиоскопов имеют входные сопротивления от 500 кОм до 1 МОм.
RBH участков нервных стволов или волокон, от которых отводится активность, могут находиться в пределах от нескольких десятков кОм до нескольких сотен кОм. Этим, в частности, определяется RBX усилителей биопотенциалов, которое обычно равно 5-ИО МОм.
При отведении биопотенциалов стеклянными микроэлектродами RBH достигает (в основном из-за сопротивления микроэлектродов) значений
[OVlO9 Ом. Поэтому RBX усилителя в этом случае должно быть не ниже 10'°н-10п Ом, и тогда необходимо учитывать влияние емкости Свх на прохождение высокочастотных компонентов биопотенциалов.
Как видно из рис. 5, на входе усилителя образуется интегрирующая це?пь, постоянная времени которой тв= ReHCB* (пря условии, что RBX > RSH в 10 раз). Это, естественно, приведет к сужению полосы пропускания частот указанной схемы. Так, при сопротивлении микроэлектрода 3-Ю7Ом и входной емкости 10 пФ тв = 3-Ю7-ИО" — 3-Ю"4 с и верхняя граничная частота fBX = 530 Гц.
Такое значение полосы пропускания в ряде случаев может оказаться недостаточным. В этом легко убедиться на примере регистрации нервного импульса со временем нарастания переднего фронта tH = 200 мкс. Находим параметры переходной характеристики усилителя fH = 530 Гц, ty = 660 мкс. Тогда передний фронт импульса затянется до 700 мкс.
Недопустимость столь больших искажений очевидна. Поэтому в микроэлектродных усилителях принимается целый ряд мер для уменьшения влияния входной емкости: специальные входные каскады — катодные или истоковые повторители и схемы с положительной или отрицательной обратной связью, введение которых позволяет нейтрализовать действие входной емкости.
Почти все усилительные устройства, входящие в состав приборов для регистрации биоэлектрической активности, строятся по дифференциальной схеме. К преимуществам таких каскадов усиления по сравнению с обычными од покаскадным и можно отнести меньшую величину нелинейных искажений и большую стабильность в работе. Одним из важных свойств дифференциального усилителя является способность подавления внешних помех симфазного сигнала). Это свойство характеризуется коэффициентом подавления (дискриминации). Например, в используемых в электрофизиологии усилителях биопотенциалов универсального типа УБП-02, УБП2-03, УБПФ4-03 коэффициент дискриминации равен 104. Такие усилители обладают высокой чувствительностью (не менее 20 мкВ/см) и полосой пропускания от 0,1 Гц до 40 кГц (у некоторых типов fB = 15 кГц), Предусмотрена возможность работы с усилением по постоянному току (в этом случае чувствительность не превышает значений 1 мВ/см), rbx = 10^15 МОм. С применением выносных катодных повторителей (УБП1 -02) RBS оказывается равным примерно 100 МОм.
Не столь высокие требования предъявляются к характеристикам усилителей электрокардиографов. Реальная чувствительность послед-
них не превышает значений десятых долей милливольта на сантиметр. Нижняя граничная частота равна 0,1-5-0,2 Гц. В некоторых типах приборов f,, = 0. Верхняя граница полосы пропускания ограничивается, как правило, частотными данными регистрирующих (чернилопишущих) устройств, у которых fB = 100 Гц.
В экспериментах, связанных с регистрацией ВКГ, используют трех-канальные векторэлектрокардиоскопы. На входы усилителей этих приборов подаются два сигнала различных отведении. После усиления один из сигналов подается на вертикальные, а другой — на горизонтальные отклоняющие пластины электронно-лучевой трубки с длительным послесвечением. Полученная на экране трубки ВКГ, своего рода фигура Лиссажу, характеризует пространственное распределение потенциалов сердца. Эти приборы могут быть использованы также для одновременной записи трех стандартных отведении ЭКГ. Полоса пропускания усилителей векторэлектрокардиоскопов 0-^-400 Гц, чувствительность 0,5 мВ/см.