Введение
Предлагаемая вашему вниманию брошюра является окончанием, третьей частью пособия для подготовки к экзамену по химии (первые две части – занятия 1–6 и 7–9 опубликованы ранее). Третья часть пособия ещё больше напоминает рабочую тетрадь – в ней приведены специальные «трафареты».
Показать «трафарет» для задания №22
Основной целью занятий 11 и 12 является не столько объяснение, как решать задачи, сколько предоставление возможности для тренировки навыков решения и закрепления умений грамотного оформления заданий. «Домашние задания» (по 10 вариантов задач в формате ОГЭ) по-возможности максимально раскрывают круг вопросов соответствующего экзаменационного задания.
Занятие 10 несколько отличается от других. Его «теоретическая часть» посвящена актуализации тех знаний по органической химии, которые предположительно должны быть у учеников, заканчивающих 9 класс. На занятии ученики под руководством учителя составляют две «шпаргалки», которые можно распечатать и пользоваться ими не только при решении заданий в формате ОГЭ, но и при дальнейшем изучении органической химии в старших классах.
В пособии предусмотрена возможность проверять правильность выполнения всех заданий по открывающейся информации. Материал рассчитан на учеников, желающих в дальнейшем подготовиться к сдаче ЕГЭ по химии и имеющих базовые знания.
План занятий
| Номер занятия | Содержание занятия | Номер задания в ОГЭ |
| Вычисление массовой доли химического элемента в веществе | ||
| Строение атома. Строение электронных оболочек атомов первых 20 элементов ПСХЭ Д.И.Менделеева | ||
| Периодический закон и ПСХЭ Д.И.Менделеева | ||
| Периодический закон и ПСХЭ Д.И.Менделеева. Закономерности изменения свойств элементов и их соединений в связи с положением в ПСХЭ | ||
| Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая | ||
| Валентность химических элементов. Степень окисления химических элементов | ||
| Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях. Классификация химических реакций по различным признакам: количеству и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии | ||
| Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних) | ||
| Реакции ионного обмена и условия их осуществления | ||
| Степень окисления химических элементов. Окислитель и восстановитель. Окислительно-восстановительные реакции | 14 и 20 | |
| Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе (хлорид-, сульфат-, карбонат-ионы, ион аммония). Получение газообразных веществ. Качественные реакции на газообразные вещества (кислород, водород, углекислый газ, аммиак) | ||
| Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений | ||
| Химические свойства оксидов: основных, амфотерных, кислотных | ||
| Химические свойства оснований. Химические свойства кислот | ||
| Химические свойства солей (средних) | ||
| Химические свойства простых веществ: металлов и неметаллов | ||
| Химические свойства простых веществ. Химические свойства сложных веществ | ||
| Чистые вещества и смеси. Правила безопасной работы в химической лаборатории. Лабораторная посуда и оборудование. Человек в мире веществ, материалов и химических реакций. Проблемы безопасного использования веществ и химических реакций в повседневной жизни. Разделение смесей и очистка веществ. Приготовление растворов. Химическое загрязнение окружающей среды и его последствия | ||
| Первоначальные сведения об органических веществах: предельных и непредельных углеводородах (метане, этане, этилене, ацетилене) и кислородсодержащих веществах: спиртах (метаноле, этаноле, глицерине), карбоновых кислотах (уксусной и стеариновой). Биологически важные вещества: белки, жиры, углеводы | ||
| Мысленный эксперимент | ||
| Вычисление массовой доли растворённого вещества в растворе. Вычисление количества вещества, массы или объёма вещества по количеству вещества, массе или объёму одного из реагентов или продуктов реакции |
Следующая статья
© Издательский дом «Первое сентября»
Цифровые технологии в образовании
Занятие 10
Проверка домашнего задания
| Задание | Вариант | |||||||||
| Содержание задания | Номер задания в ОГЭ |
| Первоначальные сведения об органических веществах: предельных и непредельных углеводородах (метане, этане, этилене, ацетилене) и кислородсодержащих веществах: спиртах (метаноле, этаноле, глицерине), карбоновых кислотах (уксусной и стеариновой). Биологически важные вещества: белки, жиры, углеводы |
Теоретическая часть
Задание для учащихся. Вам будут предложены текст и таблица-подсказка. Внимательно всё проанализируйте и заполните две «шпаргалки », используя предложенную вам информацию, периодическую систему, учебник, пособия по химии или Интернет.
ТЕКСТ 1
Органическая химия заметно отличается от химии неорганической. Во-первых, большинство объектов её изучения – вещества молекулярного строения. Во-вторых, среди этих веществ в основном присутствуют связи углерод-водород и углерод-углерод. Эти связи малополярны или неполярны из-за близких значений электроотрицательностей водорода и углерода. Неполярное или малополярное соединение плохо смешивается с самым распространённым на Земле полярным растворителем – водой. С другой стороны, наличие в молекулах атомов кислорода, азота и других элементов, позволяет органическим веществам создавать водородные связи и в результате смешиваться с водой в любых соотношениях.
В неорганической химии часто достаточно определить состав вещества, чтобы по справочникам узнать его свойства. В органической химии знания только состава вещества недостаточно. Вещества с одним и тем же составом имеют разные температуры кипения (например, вещества, состав которых C3H6O: аллиловый спирт кипит при +97 °C; пропаналь – при +49 °C, а ацетон – при +56 °C). Также различны их химические свойства: аллиловый спирт и пропаналь реагируют со свежеосаждённым гидроксидом меди(II) при нагревании (правда при этом получаются разные продукты реакций), а ацетон – не реагирует.
Строение вещества приблизительно можно показать на модели молекулы. Ниже вам предложены фотографии моделей нескольких разных молекул. В них черные шарики изображают атомы углерода, оранжевые – атомы водорода, голубые – атомы кислорода. Обратите внимание на угловое строение фрагментов (–O–H) в спиртах и кислотах – эта «угловатость» позволяет атомам кислорода образовывать водородные связи.
Напомним ещё и о некоторых частностях:
· метан является основным компонентом природного газа;
· глицерин используется в парфюмерной промышленности, а также при производстве взрывчатых веществ;
· этанол – главный компонент алкогольных напитков и, одновременно, дезинфицирующее средство;
· уксусная кислота образуется при скисании вина или яблочного сока.
Таблица-подсказка
 Увеличить
Увеличить
| Метан t пл = –182,5 °С, t кип = –161,4 °С |  Увеличить
Увеличить
| Метанол t пл = –94 °С, t кип = 65 °С |
 Увеличить
Увеличить
| Этан t пл = –172 °С, t кип = –88,6 °С | 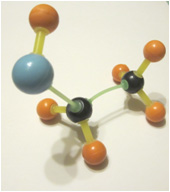 Увеличить
Увеличить
| Этанол t пл = –113 °С, t кип = 79 °С |
 Увеличить
Увеличить
| Этилен (этен) t пл = –169,5 °С, t кип = –103,8 °С |  Увеличить
Увеличить
| Уксусная кислота t пл = 17 °С, t кип = 118 °С |
 Увеличить
Увеличить
| Ацетилен (этин) t возгонки = –84 °С |  Увеличить
Увеличить
| Глицерин t пл = 17,9 °С, t кип = 290 °С, смесь с водой (две трети глицерина) замерзает при –46,5 °С |
Шпаргалка 1
| Метан | Этан | Этилен | Ацетилен |
| Утверждения о составе и строении молекул органических веществ | |||
| 1. В состав молекулы входят… атомов углерода и … атомов водорода | |||
| 2. Составу молекулы соответствует общая формула | |||
| 3. Относительная молекулярная масса (Mr) равна | |||
| 4. Атомы углерода в молекуле соединены... связью | |||
| 5. Все атомы в молекуле соединены ковалентными полярными связями | |||
| Утверждения о принадлежности органического вещества к тому или иному классу углеводородов | |||
| Утверждения о физических свойствах органического вещества | |||
| 1. Является... веществом (агрегатное состояние) при н.у. (или при комнатной температуре). | |||
| ____________________________________ | |||
| 2. Хорошо (или плохо) растворим в воде. | |||
| ____________________________________ | |||
| 3. Проводит электрический ток. | |||
| ____________________________________ | |||
| Утверждения о химических свойствах органического вещества | |||
| 1. Для вещества характерны реакции: | |||
| 2. Вступает в реакцию: | |||
| с кислородом, хлором, бромом. ____________________________________ | |||
| с хлороводородом и водородом | |||
| с водой | |||
| бромную воду, раствор перманганата калия ________ | бромную воду, раствор перманганата калия ________ | ||
| со щелочными металлами ___________ | ________ с Na, K | ||
| 3. Сгорает с образованием | |||
Показать полный текст
Шпаргалка 1
| Метан | Этан | Этилен | Ацетилен |
| Утверждения о составе и строении молекул органических веществ | |||
| 1. В состав молекулы входят… атомов углерода и … атомов водорода | |||
| 1 и 4 (CH4) | 2 и 6 (C2H6) | 2 и 4 (C2H4) | 2 и 2 (C2H2) |
| 2. Составу молекулы соответствует общая формула | |||
| C n H2 n +2 | C n H2 n +2 | C n H2 n | C n H2 n –2 |
| 3. Относительная молекулярная масса (Mr) равна | |||
| 4. Атомы углерода в молекуле соединены... связью | |||
| ― | одинарной | двойной | тройной |
| 5. Все атомы в молекуле соединены ковалентными полярными связями | |||
| Да | Нет, связь между атомами углерода неполярная | ||
| Утверждения о принадлежности органического вещества к тому или иному классу углеводородов | |||
| Предельные (насыщенные) | Непредельные (ненасыщенные) | ||
| Утверждения о физических свойствах органического вещества | |||
| 1. Является... веществом (агрегатное состояние) при н.у. (или при комнатной температуре). | |||
| И при н.у. и при комнатной температуре эти вещества – газы. | |||
| 2. Хорошо (или плохо) растворим в воде. | |||
| В воде эти вещества растворимы плохо. | |||
| 3. Проводит электрический ток. | |||
| Ток не проводят, электролитами не являются. | |||
| Утверждения о химических свойствах органического вещества | |||
| 1. Для вещества характерны: | |||
| только реакции замещения | реакции замещения и отщепления | реакции присоединения и полимеризации | реакции присоединения и замещения |
| 2. Вступает в реакцию: | |||
| с кислородом, хлором, бромом. Да, но реагируют все по-разному: | |||
| с хлороводородом и водородом | |||
| не реагируют | не реагируют | реагирует | реагирует в две стадии |
| с водой | |||
| реагирует (синтез-газ) | не реагирует | реагирует (этанол) | реагирует (ацетальдегид) |
| бромную воду, раствор перманганата калия не обесцвечивают | бромную воду, раствор перманганата калия обесцвечивают | ||
| со щелочными металлами не реагируют | реагирует с Na, K | ||
| 3. Сгорает с образованием | |||
| углекислого газа и воды | углекислого газа, сажи и воды |
Шпаргалка 2
| Метанол | Этанол | Глицерин | Уксусная кислота |
| Утверждения о составе и строении молекул органических веществ | |||
| 1. В состав молекулы входят… атомов углерода, … атомов водорода и... атомов кислорода | |||
| 2. Составу молекулы соответствует общая формула | |||
| 3. Относительная молекулярная масса (Mr) равна | |||
| 4. Атомы углерода в молекуле соединены... связью | |||
| Атомы углерода и кислорода в молекуле соединены... связью | |||
| 5. Все атомы в молекуле соединены ковалентными полярными связями | |||
| Утверждения о принадлежности органического вещества к классу | |||
| Утверждения о физических свойствах органического вещества | |||
| 1. Является... веществом (агрегатное состояние) при н.у. (или при комнатной температуре) | |||
| 2. Хорошо (или плохо) растворим в воде | |||
| 3. Проводит электрический ток | |||
| Утверждения о химических свойствах органического вещества | |||
| 1. Для вещества характерны реакции | |||
| 2. Вступает в реакцию | |||
| с кислородом ________________________________________________________; | |||
| c водородом _________________________________________________________; | |||
| cо щелочными металлами _____________________________________________; | |||
| c оксидом меди(II) ____________________________________________________; | |||
| c HCl (конц., нагревание, кат.) | |||
| c гидроксидом меди(II) при комнатной температуре | |||
| c карбонатом кальция | |||
| Окраску лакмуса | |||
| 3. Сгорают с образованием ___________________________________ |
Показать полный текст
Шпаргалка 2
| Метанол | Этанол | Глицерин | Уксусная кислота |
| Утверждения о составе и строении молекул органических веществ | |||
| 1. В состав молекулы входят… атомов углерода, … атомов водорода,... атомов кислорода | |||
| 1, 4 и 1 (CH4O) | 2, 6 и 1 (C2H6O) | 3, 8 и 3 (C3H8O3) | 2, 4 и 2 (C2H4O2) |
| или CH3OH | или C2H5OH | 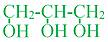
| или CH3COOH |
| 2. Составу молекулы соответствует общая формула | |||
| C n H2 n +2O | C n H2 n +2O | C n H2 n +2O3 | C n H2 n O2 |
| C n H2 n +1OH | C n H2 n +1OH | C n H2 n –1(OH)3 | C n –1H2 n –1COOH |
| 3. Относительная молекулярная масса (Mr) равна | |||
| 4. Атомы углерода в молекуле соединены... связью | |||
| ― | одинарной | одинарной | одинарной |
| Атомы углерода и кислорода в молекуле соединены... связью | |||
| одинарной | одинарной | одинарной | с одним атомом – одинарной, с другим – двойной |
| 5. Все атомы в молекуле соединены ковалентными полярными связями | |||
| Да | Нет, связь между атомами углерода неполярная | ||
| Утверждения о принадлежности органического вещества к классу | |||
| Одноатомные спирты | Одноатомные спирты | Многоатомные спирты | Одноосновные карбоновые кислоты |
| Утверждения о физических свойствах органического вещества | |||
| 1. Является... веществом (агрегатное состояние) при н.у. (или при комнатной температуре) | |||
| И при н.у., и при комнатной температуре – это жидкости | И при н.у., и при комнатной температуре – это жидкости | Чистое вещество (100 %) при н.у. – твёрдое, при 20–25 °С – жидкость | Чистое вещество (100 %) при н.у. – твёрдое, при 20–25 °С – жидкость |
| 2. Хорошо (или плохо) растворим в воде | |||
| хорошо | хорошо | хорошо | хорошо |
| 3. Проводит электрический ток | |||
| Ток не проводят, электролитами не являются | Ток не проводят, электролитами не являются | Ток не проводят, электролитами не являются | Слабый электролит* |
| *Уксусная кислота проводит электрический ток только в виде разбавленного раствора. | |||
| Утверждения о химических свойствах органического вещества | |||
| 1. Для вещества характерны реакции | |||
| замещения | замещения и отщепления | замещения и отщепления | замещения |
| 2. Вступает в реакцию | |||
| с кислородом реагируют все – горят (даже безводная уксусная кислота); | |||
| с водородом не реагируют; | |||
| со щелочными металлами реагируют с выделением водорода; | |||
| с оксидом меди(II) реагируют при нагревании, продукты разные; | |||
| с HCl (конц., нагревание, кат.) | |||
| реагируeт | реагируeт | реагируeт | не реагируeт |
| с гидроксидом меди(II) при комнатной температуре | |||
| не реагируют | не реагируют | ярко-синий раствор | голубой раствор** |
| с карбонатом кальция | |||
| не реагируют | не реагируют | не реагируют | реагирует (раствор) |
| Окраска лакмуса | |||
| не изменяется | не изменяется | не изменяется | становится краснее |
| **С оксидом и гидроксидом меди(II) реагирует водный раствор кислоты. | |||
| 3. Сгорают с образованием углекислого газа и воды |
Задание для учащихся. Внимательно прочтите предложенный ниже текст, заполните пропуски и рассмотрите фотографии.
ТЕКСТ 2
Стеариновая кислота СН3(СН2)16СООН (C__H__COOH или C__H__O2): t пл = 69,6 °С, t кип = 376,1 °С; растворимость в воде: 0,03 г (M (C__H__O2) = ___ г/моль; 0,03 г – это _______ моль) на 100 г воды. Из-за низкой растворимости в воде она не вступает во многие реакции с неорганическими веществами, в которые вступает кислота уксусная.
Производными этой кислоты и глицерина являются природные соединения – жиры.
Соли стеариновой кислоты являются главным компонентом любого твёрдого мыла, потому что обладают моющим действием – способствуют удалению загрязнений с кожи и тканей.
Показать полный текст
На рисунках ниже шаростержневая модель не стеариновой, а всего лишь октановой кислоты «в профиль» и «анфас».

| Её формула C7H14COOH или C8H15O2. Молекула стеариновой кислоты в два раза длиннее. | 
|
Дополнительная информация
Классификации и названия органических соединений
· Али фати ческие (ациклические) – углеводороды и их производные (в том числе спирты, кислоты и т.п.) нециклического строения.
· Али цикли ческие (циклоалифатические) – углеводороды и их производные (в том числе спирты, кислоты и т.п.), содержащие в молекулах один или несколько циклов из атомов углерода.
Классификация и названия углеводородов
· Насыщенные или предельные, или алк ан ы – углеводороды, не содержащие кратных связей.
· Не насыщенные или непредельные – углеводороды, с кратными связями. К ним относятся:
o алк ен ы (или олефины, или этиленовые углеводороды) – имеют одну двойную связь;
o алк ин ы (или ацетиленовые углеводороды) – имеют одну тройную связь;
o алка диен ы (или диеновые углеводороды) – имеют две двойные связи.
· Ароматические или арены – углеводороды, содержащие одно или несколько бензольных колец, гомологи бензола.
Классификация и названия кислородсодержащих соединений
· Спирты:
o одноатомные (метанол, этанол, пропанолы и др);
o многоатомные (этиленгликоль, глицерин).
· Фенолы.
· Альдегиды и кетоны.
· Карбоновые кислоты:
o одноосновные (уксусная, пропановая, стеариновая);
o многоосновные (щавелевая, янтарная).
· Эфиры:
o простые (диметиловый, диэтиловый);
o сложные (метилформиат, этилацетат).
Некоторые понятия
Функциональная группа – это атом или группа атомов, которая определяет характерные химические свойства вещества, поскольку является реакционным центром молекулы.
Радикал в органической химии – это группа атомов, соединённая с функциональной группой молекулы. Обычно при химических реакциях радикал переходит из одного соединения в другое без изменений. Радикал может содержать функциональные группы, которые не принимают участия в конкретной реакции. Иногда углеводородные радикалы могут, в свою очередь, превратиться в «функциональную группу» (например, при хлорировании уксусной кислоты в присутствии красного фосфора).
В химии существует также понятие «свободные радикалы» – это реальные частицы, «способные к независимому существованию» (хотя многие из них неустойчивые), они содержат один или несколько неспаренных электронов.
Гомологи – это вещества одного класса, отличающиеся друг от друга по составу на целое число групп CH2.
Изомеры – это вещества, имеющие одинаковую молекулярную формулу, но разное строение или расположение в пространстве, а, следовательно, и разные свойства.
· Структурная изомерия вызвана разным порядком соединения атомов в молекуле. Она подразделяется на изомерию углеродного скелета, изомерию положения функциональной группы и межклассовую изомерию.
· Пространственная изомерия возможна для веществ, молекулы которых различаются не порядком соединения атомов, а их расположением в пространстве. Все биологически важные соединения имеют этот вид изомерии.
Гибридизация атомных орбиталей
У атомов на каждом слое, начиная со 2-го, есть одна шарообразная s -орбиталь и три вытянутых вдоль координатных осей p -орбитали.
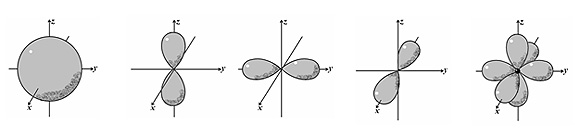
Суть гибридизации заключается в изменении формы орбитали – она становится «целенаправленной» – основная часть электронной плотности находится «с одной стороны» от атома, обычно такая орбиталь направлена на связь с другим атомом.
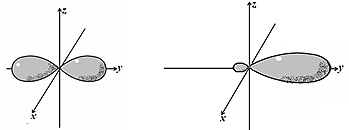
В гибридизации всегда участвует одна s -орбиталь и одна, две или все три p -орбитали. На рисунке показано взаимодействие одной s - и одной p -орбиталей.
|
Домашнее задание
Таблица для записи ответов
| Задание | Вариант | |||||||||
Задание 17
1. Для метана верны следующие утверждения:
1) относительная молекулярная масса равна 26;
2) является жидким веществом при комнатной температуре;
3) составу молекулы соответствует общая формула C n H2 n;
4) вступает в реакцию с кислородом и хлором;
5) сгорает с образованием углекислого газа и воды.
2. Для этана верны следующие утверждения:
1) относится к непредельным углеводородам;
2) плохо растворим в воде;
3) в состав молекулы входят 1 атом углерода и 4 атома водорода;
4) атомы углерода в молекуле соединены тройной связью;
5) вступает в реакции замещения.
3. Для этилена верны следующие утверждения:
1) является газообразным веществом при комнатной температуре;
2) в состав молекулы входят 3 атома углерода, 8 атомов водорода и 3 атома кислорода;
3) атомы углерода в молекуле соединены двойной связью;
4) вступает в реакции замещения;
5) вступает в реакцию с натрием и карбонатом кальция.
4. Для ацетилена верны следующие утверждения:
1) относительная молекулярная масса равна 30;
2) плохо растворим в воде;
3) проводит электрический ток (является электролитом);
4) составу молекулы соответствует общая формула C n H2 n –2;
5) не вступает в реакцию с хлором и раствором перманганата калия.
5. Для метанола верны следующие утверждения:
1) относится к предельным углеводородам;
2) является газообразным веществом при комнатной температуре;
3) в состав молекулы входят один атом углерода, четыре атома водорода и один атом кислорода;
4) атомы углерода в молекуле соединены одинарной связью;
5) сгорает с образованием углекислого газа и воды.
6. Для этанола верны следующие утверждения:
1) относительная молекулярная масса равна 46;
2) плохо растворим в воде;
3) проводит электрический ток (является электролитом);
4) составу молекулы соответствует общая формула C n H2 n O2;
5) вступает в реакцию с кислородом и натрием.
7. Для глицерина верны следующие утверждения:
1) является многоатомным спиртом;
2) проводит электрический ток (является электролитом);
3) составу молекулы соответствует общая формула C n H2 n O2;
4) вступает в реакцию с кислородом и гидроксидом меди(II);
5) все атомы в молекуле соединены ковалентными полярными связями.
8. Для уксусной кислоты верны следующие утверждения:
1) относительная молекулярная масса равна 46;
2) хорошо растворима в воде;
3) составу молекулы соответствует общая формула C n H2 n O2;
4) вступает в реакцию с медью и гидроксидом меди(II);
5) сгорает с образованием угарного газа и водорода.
9. Для стеариновой кислоты верны следующие утверждения:
1) относится к многоосновным карбоновым кислотам;
2) является жидким веществом при комнатной температуре;
3) из стеариновой кислоты и глицерина можно синтезировать твёрдые жиры;
4) в состав молекулы входят 18 атомов углерода, 36 атомов водорода и 2 атома кислорода;
5) все атомы в молекуле соединены одинарной связью.
10. Для белков верны следующие утверждения:
1) могут быть гидролизованы до аминокислот при длительном нагревании с концентрированной соляной кислотой;
2) являются жизненно важной частью продуктов питания;
3) не меняют своих свойств при денатурации;
4) в состав молекулы белка входят только атомы углерода, водорода и кислорода;
5) все атомы в молекуле соединены одинарной связью.
Предыдущая статья
Следующая статья
© Издательский дом «Первое сентября»
Цифровые технологии в образовании
Занятие 11
Проверка домашнего задания
Проверка домашнего задания
| Задание | Вариант | |||||||||
| Содержание задания | Номер задания в ОГЭ |
| Мысленный эксперимент |
Теоретическая часть
Задание для учащихся. Прочтите предложенные ниже задачи. Для первой задачи уже дано решение, прочтите его, заполните пропуски. Постепенно решайте задачи, заполняя пропуски самостоятельно, или, если не получается, «подсматривая» в ответ.
Задача 1
Даны вещества: железо, сульфат железа(II), растворы гидроксида натрия, азотной кислоты (60 %), хлороводорода.
Используя воду и необходимые вещества только из этого списка, получите в результате двух последовательных реакций гидроксид железа(II).
Запишите уравнения проведённых химических реакций. Опишите признаки этих реакций. Для второй реакции напишите сокращённое ионное уравнение.
Решение
1. Выпишите формулы данных вам веществ:
Fe, FeSO4, NaOH (р-р), HNO3 (60%-й р-р), HCl;
и формулу вещества, которое надо получить – Fe(OH)2.
2. Перечитайте условие – краткое ионное уравнение надо написать для второй реакции – именно для той, в которой будет получено нужное нам вещество. Можно сразу написать краткое ионное уравнение. Гидроксид железа(II) – это нерастворимое в воде вещество, он образуется из ионов Fe2+ и OH–: Fe2+ + 2OH– = Fe(OH)2↓.
3. Какие вещества нужно взять, чтобы в их растворах были необходимые ионы? Очевидно, что одно из них – раствор гидроксида натрия NaOH (поскольку среди данных нам веществ нет другого источника ионов OH–). Вторым веществом не может быть сульфат железа(II) FeSO4, иначе гидроксид железа(II) получится в результате одной-единственной реакции, что не соответствует условию задачи. Следовательно, надо получить сначала другое соединение железа, растворив металл в кислоте.
4. Предложены две кислоты. При растворении железа в азотной кислоте такой концентрации образуется нитрат железа(III); при растворении железа в соляной кислоте получается хлорид железа(II) – то, что и нужно – он растворим в воде и предоставит необходимые ионы Fe2+.
