Титан активно реагирует с азотом, образуя прочные нитриды, нерастворимые в металле. Вместе с тем, он сильный модификатор, т. е. элемент, способствующий измельчению зерна в металле.
4. Алюминий—А1 (Тпл =658 °С; Тисп =2500 °С; ρ =2,7 г/см3) - наиболее сильный раскислитель этой группы. Образует амфотерный оксид А1203.
Раскисление жидкого металла алюминием сопровождается значительным выделением тепла, обеспечивающим дополнительный подогрев металла сварочной ванны, что благотворно влияет на протекающие процессы.
Однако окись алюминия с трудом всплывает на поверхность сварочной ванны и частично остается в шве в виде неметаллических включений. Это одна из причин незначительного применения алюминия как раскислителя при сварке сталей.
Как и титан, алюминий склонен образовывать с азотом стойкие нитриды.
Раскисление с получением газообразных продуктов реакции.
Рассмотрим две типичные реакции этого вида раскисления металла.
Раскисление углеродом.
Этот процесс может протекать в два этапа:

При этом наблюдается одновременное присутствие железа, закиси железа, углерода, окиси углерода и углекислого газа.
При сварке наиболее вероятны следующее:
1) при окислении металла устойчивой формой оксида железа будет FeO;
2) раскисление металла углеродом идет только до образования окиси углерода, так как при высоких температурах этот продукт очень устойчив, т. е. по 1-й реакции.
Константа равновесия для этой реакции

После принятых допущений:
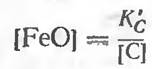
На рис. 126 показаны кривые зависимости равновесного содержания закиси железа от содержания углерода в стали для различных температур.

Из рис. 126 следует:
- с увеличением содержания углерода в металле интенсивно уменьшается содержание в нем закиси железа,
- с ростом температуры процесса раскисляющая способность углерода повышается и раскисление идет значительно полнее, чем при низких температурах.
Однако, несмотря на хорошую раскисляющую способность, углерод как раскислитель находит ограниченное применение. Это объясняется двумя обстоятельствами (углерод – очень эффективный компонент, недостаток или избыток которого очень существенно отражается на свойствах металла):
1) возможностью образования пор в металле шва
- если в металле высокое содержание углерода и FeO, то реакция выгорания углерода может протекать бурно,
- на участках, кристаллизующихся в последнюю очередь, где выгорание затянулось.
2) при добавлении углерода во флюс в качестве раскислителя возможностью повышения содержания углерода в металле шва с соответствующим изменением механических показателей стали, что не всегда допустимо.
Раскисление водородом
представляется следующим уравнением:

Отсюда концентрация закиси железа, отвечающая состоянию равновесия,

Восстановление металла водородом имеет много общего с восстановлением его окисью углерода. Однако водород слабее, чем СО, раскисляет металл.