Кофермент Q
 По химической природе кофермент Q имеет сходство в строении молекулы с витаминами Е и К и представляет собой 2,3-диметокси-5-метил-1,4-бензохинон с изопреновой цепью в 6-м положении. Число остатков изопрена в боковой цепи убихинон в разных организмах варьируется от 6 до 10. Такие варианты кофермента Q обозначают как Сo Q6, Сo Q7 и т. д.
По химической природе кофермент Q имеет сходство в строении молекулы с витаминами Е и К и представляет собой 2,3-диметокси-5-метил-1,4-бензохинон с изопреновой цепью в 6-м положении. Число остатков изопрена в боковой цепи убихинон в разных организмах варьируется от 6 до 10. Такие варианты кофермента Q обозначают как Сo Q6, Сo Q7 и т. д.
В клетках Saccharomyces cerevisiae содержится Co Q6, Escherichia coli — Co Q8, грызунов — Co Q9. В митохондриях клеток большинства млекопитающих, включая человека, встречается убихинон только с 10 изопреновыми звеньями.[1]
Кофермент Q представляет собой желто-оранжевые кристаллы без вкуса и запаха. Температура плавления 49-51° С. Растворим в диэтиловом эфире, очень слабо растворим в этаноле, практически нерастворим в воде. На свету постепенно разлагается и окрашивается. С водой образует эмульсию с концентрацией 10 %, 20 % и 40 %.
Кофермент Q принимает участие в реакциях окислительного фосфорилирования, является компонентом цепи переноса электронов в митохондриях. Ингибиторы работы убихинона останавливают реакции окислительного фосфорилирования.
Кофермент Q является компонентом цепи переноса электронов, принимает участие в переносе электронов с NADH-дегидрогеназного комплекса (комплекс I) и сукцинатдегидрогеназного комплекса (II) на комплекс III, и участвует таким образом в синтезе АТФ.
Также кофермент Q является антиоксидантом и, в отличие от других антиоксидантов, регенерируется организмом. Кроме того, кофермент Q восстанавливает антиоксидантную активность витамина Е — α-токоферола.
Антиоксидантное действие кофермента Q обусловлено главным образом его восстановленной формой (Co Q H2). Активность восстановленной формы кофермента Q на три порядка выше невосстановленной. Реакцию нейтрализации свободных радикалов восстановленным коферментом Q можно записать следующим образом 2LOO• + Co QH2 → 2LООН + Co Q.
4) ЦИТОХРОМЫ, сложные белки (гемопротеиды), содержащие в качестве простетич. группы гем. Служат переносчиками электронов в процессах внутриклеточного дыхания, окислит. фосфорилирования, фотосинтеза, ферментативного гидроксилирования и в др. биол. окислит.-восстановит. р-циях. Цитохромы найдены у всех животных, растений и микроорганизмов. Известно неск. десятков индивидуальных цитохромов, многие из к-рых выделены в гомогенном состоянии. Определены первичные структуры и пространственная организация многих цитохромов наиб. хорошо изучены св-ва цитохрома с. В зависимости от природы гема цитохромы делят на 4 группы, обозначаемые буквами а, b, с и d. У цитохрома а гем имеет строение протопорфирина (см.Порфирины) и содержит формильный заместитель; цитохром b содержит протогем (ферропротопорфирин), нековалентно связанный с полипептидной цепью; уцитохрома с боковые заместители протопорфирина ковалентно связаны с полипептидной цепью; у цитохрома d гем представлен дигидропорфирином (хлорином). Атом Fe, входящий в состав гемов цитохромов и подвергающийся окислению и восстановлению, координирован 4 связями с атомами N порфириновых колец и 2 - с лигандами, принадлежащими полипептидным цепям (остатки гистидина, цистеина). Нек-рые цитохромы содержат неск. одинаковых или разных гемов.
Все цитохромы ярко окрашены и имеют характерные спектры поглощения света в видимой области, меняющиеся при их окислении или восстановлении. В типичном спектре имеются три основные полосы поглощения  полосы в порядке убывания длин волн), по изменению к-рых обычно судят о степени восстановленности цитохрома.
полосы в порядке убывания длин волн), по изменению к-рых обычно судят о степени восстановленности цитохрома.
Донорами электронов для цитохромов обычно служат флавины, гидрохиноны, железо-серные белки или другие цитохромы; акцепторами - другие цитохромы или кислород (цитохромоксидазы). Нек-рые цитохромы (цитохромоксидаза, цитохром Р-450) прочно связаны с мембранами митохондрий, микросом (липопротеидные комплексы) и не раств. в воде, другие (напр., цитохром с) раств. в ней.
Цитохромы реагируют с лигандами, конкурирующими с естественным координац. окружением атома Fe гемов (СО, анионы азида, цианида и др.). Связывание этих лигандов приводит к изменению спектральных св-в и инактивации цитохромов.
Дыхательная цепь включает множество белков-переносчиков
Всего цепь переноса электронов (англ. electron transport chain) включает в себя около 40 разнообразных белков, которые организованы в 4 больших мембраносвязанных мульферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ.
Строение ферментативных комплексов дыхательной цепи
1 комплекс. НАДН-КоQ-оксидоредуктаза
Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН, 22 белковых молекулы, из них 5 железосерных белков с общей молекулярной массой до 900 кДа.
Функция
1. Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
2. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
2 комплекс. ФАД-зависимые дегидрогеназы
Данный комплекс как таковой не существует, его выделение условно. Он включает в себя ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса НАДН в митохондрию).
Функция
1. Восстановление ФАД в окислительно-восстановительных реакциях.
2. Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q.
3 комплекс. КоQ-цитохром с-оксидоредуктаза
Данный комплекс включает цитохромы b и c1. Кроме цитохромов в нем имеются 2 железо-серных белка. Всего насчитывается 11 полипептидных цепей общей молекулярной массой около 250 кDа.
Функция
1. Принимает электроны от коэнзима Q и передает их на цитохром с.
2. Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
4 комплекс. Цитохром с-кислород-оксидоредуктаза
В этом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза, всего содержит 6 полипептидных цепей. В комплексе также имеется 2 иона меди.
Функция
1. Принимает электроны от цитохрома с и передает их на кислород с образованием воды.
2. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
5 комплекс
Пятый комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей, подразделенных на две большие группы:
· одна группа формирует субъединицу Fо (произносится со звуком "о", а не "ноль" т.к олигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс.
· другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ.
Упрощенно считают, что для синтеза 1 молекулы АТФ необходимо прохождение приблизительно 3-х протонов Н+
6) окислительное фосфорилирование
ОКИСЛИТЕЛЬНОЕФОСФОРИЛИРОВАНИЕ, синтез АТФ из аденозиндифосфата и неорг. фосфата, осуществляющийся в живых клетках, благодаря энергии, выделяющейся при окислении орг. в-в в процессе клеточного дыхания. В общем виде окислительное фосфорилирование и его место в обмене в-в можно представить схемой:

Поскольку АТФ необходим для осуществления мн. процессов, требующих затраты энергии (биосинтез, совершение мех. работы, транспорт в-в и др.), Окислительное фосфорилирование играет важнейшую роль в жизнедеятельности аэробных организмов. Образование АТФ в клетке происходит также благодаря др. процессам, напр. в ходе гликолиза и разл. типов брожения, протекающих без участия кислорода. Их вклад в синтез АТФ в условиях аэробногодыхания составляет незначит. часть от вклада окислительного фосфорилирования (ок. 5%).
У животных, растений и грибов окислительное фосфорилирование протекает в спе-циализир. субклеточных структурах-митохондриях у бактерий ферментные системы, осуществляющие этот процесс, находятся в клеточной мембране.
Митохондрии окружены белково-фосфолипидной мембраной. Внутри митохондрий (в т. наз. матриксе) идет ряд метаболич. процессов распада пищ. в-в, поставляющих субстраты окисления АН2 для окислительного фосфорилирования. Наиб. важные из этих процессов -трикарбоновых кислот цикл и т. наз.  -окисление жирных к-т (окислит. расщепление жирной к-ты с образованием ацетил-кофермента А и к-ты, содержащей на 2 атома С меньше, чем исходная; вновь образующаяся жирная к-та также может подвергаться
-окисление жирных к-т (окислит. расщепление жирной к-ты с образованием ацетил-кофермента А и к-ты, содержащей на 2 атома С меньше, чем исходная; вновь образующаяся жирная к-та также может подвергаться  -окислению). Интермедиаты этих процессов подвергаются дегидрированию (окислению) при участииферментов дегидрогеназ; затем электроны передаются в дыхат. цепь митохондрий-ансамбль окислит.-восстановит. ферментов, встроенных во внутр. митохонд-риальную мембрану. Дыхат. цепь осуществляет многоступенчатый экзэргонич. перенос электронов (сопровождается уменьшением своб. энергии) отсубстратов к кислороду, а высвобождающаяся энергия используется расположенным в той же мембране ферментом АТФ-синтетазой, для фос-форилированияАДФ до АТФ. В интактной (неповрежденной) митохондриальной мембране перенос электронов в дыхат. цепи и фосфорилирование тесно сопряжены между собой. Так, напр., выключение фосфорилирования по исчерпании АДФ либо неорг. фосфата сопровождается торможением дыхания (эффект дыхат. контроля). Большое число повреждающих митохондриальную мембрану воздействий нарушает сопряжение между окислением и фосфори-лированием, разрешая идти переносу электронов и в отсутствие синтеза АТФ (эффект разобщения).
-окислению). Интермедиаты этих процессов подвергаются дегидрированию (окислению) при участииферментов дегидрогеназ; затем электроны передаются в дыхат. цепь митохондрий-ансамбль окислит.-восстановит. ферментов, встроенных во внутр. митохонд-риальную мембрану. Дыхат. цепь осуществляет многоступенчатый экзэргонич. перенос электронов (сопровождается уменьшением своб. энергии) отсубстратов к кислороду, а высвобождающаяся энергия используется расположенным в той же мембране ферментом АТФ-синтетазой, для фос-форилированияАДФ до АТФ. В интактной (неповрежденной) митохондриальной мембране перенос электронов в дыхат. цепи и фосфорилирование тесно сопряжены между собой. Так, напр., выключение фосфорилирования по исчерпании АДФ либо неорг. фосфата сопровождается торможением дыхания (эффект дыхат. контроля). Большое число повреждающих митохондриальную мембрану воздействий нарушает сопряжение между окислением и фосфори-лированием, разрешая идти переносу электронов и в отсутствие синтеза АТФ (эффект разобщения).
Механизм окислительного фосфорилирования можно представить схемой: Перенос электронов (дыхание)  А ~ В
А ~ В 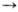 АТФ А ~ В-высокоэнергетич. интермедиатПредполагалось, что А ~ В - хим. соед. с макроэргич. связью, напр. фосфорилир. фермент дыхат. цепи (хим. гипотеза сопряжения), или напряженнаяконформация к.-л. белка, участвующего в окислительном фосфорилировании (конформац. гипотеза сопряжения). Однако эти гипотезы не получили эксперим. подтверждения. Наиб. признанием пользуется хемиосмотич. концепция сопряжения, предложенная в 1961 П. Митчеллом (за развитие этой концепции в 1979 ему присуждена Нобелевская премия). Согласно этой теории, своб. энергия транспорта электронов в дыхат. цепи затрачивается на перенос из митохондрийчерез митохондриальную мембрану на ее наружную сторону ионов Н+ (рис. 2, процесс 1). В результате на мембране возникает разность электрич. потенциалов
АТФ А ~ В-высокоэнергетич. интермедиатПредполагалось, что А ~ В - хим. соед. с макроэргич. связью, напр. фосфорилир. фермент дыхат. цепи (хим. гипотеза сопряжения), или напряженнаяконформация к.-л. белка, участвующего в окислительном фосфорилировании (конформац. гипотеза сопряжения). Однако эти гипотезы не получили эксперим. подтверждения. Наиб. признанием пользуется хемиосмотич. концепция сопряжения, предложенная в 1961 П. Митчеллом (за развитие этой концепции в 1979 ему присуждена Нобелевская премия). Согласно этой теории, своб. энергия транспорта электронов в дыхат. цепи затрачивается на перенос из митохондрийчерез митохондриальную мембрану на ее наружную сторону ионов Н+ (рис. 2, процесс 1). В результате на мембране возникает разность электрич. потенциалов  и разность хим. активностей ионов Н+
и разность хим. активностей ионов Н+  (внутри митохондрий рН выше, чем снаружи). В сумме эти компоненты дают трансмембранную разность электрохим. потенциалов ионов водорода
(внутри митохондрий рН выше, чем снаружи). В сумме эти компоненты дают трансмембранную разность электрохим. потенциалов ионов водорода  между матриксом митохондрий и внеш. водной фазой, разделенными мембраной:
между матриксом митохондрий и внеш. водной фазой, разделенными мембраной:

где R-универсальная газовая постоянная, T-абс. т-ра, F- число Фарадея. Величина  обычно составляет ок. 0,25 В, причем осн. часть (0,15-0,20 В) представлена электрич. составляющей
обычно составляет ок. 0,25 В, причем осн. часть (0,15-0,20 В) представлена электрич. составляющей 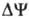 . Энергия
. Энергия  , выделяющаяся при движении протонов внутрь митохондрий по электрич. полю в сторону меньшей их концентрации (рис. 2, процесс 2), используется АТФ-синтетазой для синтеза АТФ. Т. обр., схему окислительного фосфорилирования, согласно этой концепции, можно представить в след. виде:
, выделяющаяся при движении протонов внутрь митохондрий по электрич. полю в сторону меньшей их концентрации (рис. 2, процесс 2), используется АТФ-синтетазой для синтеза АТФ. Т. обр., схему окислительного фосфорилирования, согласно этой концепции, можно представить в след. виде:
Перенос электронов (дыхание)  АТФ
АТФ
Сопряжение окисления и фосфорилирования через  позволяет объяснить, почему окислительное фосфорилирование, в отличие от гликолитич. ("субстратного") фосфорилирования, протекающего в р-ре, возможно лишь в замкнутых мембранных структурах, а также почему все воздействия, снижающие электрич. сопротивление и увеличивающие протонную проводимость мембраны, подавляют ("разобщают") окислительное фосфорилирование. Энергия
позволяет объяснить, почему окислительное фосфорилирование, в отличие от гликолитич. ("субстратного") фосфорилирования, протекающего в р-ре, возможно лишь в замкнутых мембранных структурах, а также почему все воздействия, снижающие электрич. сопротивление и увеличивающие протонную проводимость мембраны, подавляют ("разобщают") окислительное фосфорилирование. Энергия  , помимо синтеза АТФ, может непосредственно использоваться клеткой для др. целей - транспорта метаболитов, движения (у бактерий), восстановления нико-тинамидных коферментов и др.
, помимо синтеза АТФ, может непосредственно использоваться клеткой для др. целей - транспорта метаболитов, движения (у бактерий), восстановления нико-тинамидных коферментов и др.
В дыхат. цепи имеется неск. участков, к-рые характеризуются значит. перепадом окислит.-восстановит. потенциала  и сопряжены с запасанием энергии (генерацией
и сопряжены с запасанием энергии (генерацией  ). Таких участков, наз. пунктами или точками сопряжения, обычно три: НАДН: убихинон-редуктазное звено (
). Таких участков, наз. пунктами или точками сопряжения, обычно три: НАДН: убихинон-редуктазное звено ( 0,35-0,4 В), убихинол: цитохром-c-редуктазное звено (
0,35-0,4 В), убихинол: цитохром-c-редуктазное звено ( ~ ~ 0,25 В) и цитохром-с-оксидазный комплекс (
~ ~ 0,25 В) и цитохром-с-оксидазный комплекс ( ~ 0,6 В)-пункты сопряжения 1, 2 и 3 соотв. (рис. 3). Каждый из пунктов сопряжения дыхат. цепи м.б. выделен из мембраны в виде индивидуального ферментного комплекса, обладающего окислит.-восстановит. активностью. Такой комплекс, встроенный в фосфолипидную мембрану, способен функционировать как протонный насос.
~ 0,6 В)-пункты сопряжения 1, 2 и 3 соотв. (рис. 3). Каждый из пунктов сопряжения дыхат. цепи м.б. выделен из мембраны в виде индивидуального ферментного комплекса, обладающего окислит.-восстановит. активностью. Такой комплекс, встроенный в фосфолипидную мембрану, способен функционировать как протонный насос.
В организме окислительное фосфорилирование подавляется мн. токсичными в-вами, к-рые по месту их действия можно разделить на три группы: 1)ингибиторы дыхат. цепи, или т. наз. дыхат. яды (см. Дыхание). 2) Ингибиторы АТФ-синтетазы. Наиб. распространенные ингибиторы этого класса, употребляемые в лаб. исследованиях, - антибиотик олигомицин и модификатор карбоксильных групп белка дициклогексилкарбодиимид. 3) Т. наз. разобщители окислительного фосфорилирования. Они не подавляют ни перенос электронов, ни собственно фосфорилирование АДФ, но обладают способностью уменьшать величину 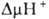 на мембране, благодаря чему нарушается энергетич. сопряжение между дыханием и синтезом АТФ. Разобщающее действие проявляет большое число соед. самой разнообразной хим. структуры. Классич. разобщители - в-ва, обладающие слабыми кислотными св-вами, способные проникать через мембрану как в ионизованной (депротонированной), так и в нейтральной (протонированной) формах. К таким в-вам относят, напр., 1-(2-дицианометилен)гидразино-4-трифтор-метоксибензол, или карбонилцианид-n-трифторметокси-фенилгидразон, и 2,4-динитрофенол
на мембране, благодаря чему нарушается энергетич. сопряжение между дыханием и синтезом АТФ. Разобщающее действие проявляет большое число соед. самой разнообразной хим. структуры. Классич. разобщители - в-ва, обладающие слабыми кислотными св-вами, способные проникать через мембрану как в ионизованной (депротонированной), так и в нейтральной (протонированной) формах. К таким в-вам относят, напр., 1-(2-дицианометилен)гидразино-4-трифтор-метоксибензол, или карбонилцианид-n-трифторметокси-фенилгидразон, и 2,4-динитрофенол
Двигаясь через мембрану в электрич. поле в ионизованной форме, разобщитель уменьшает  ; возвращаясь обратно в протонир. состоянии, разобщитель понижает
; возвращаясь обратно в протонир. состоянии, разобщитель понижает  (рис. 4). Т. обр., такой "челночный" тип действия разобщителя приводит к уменьшению
(рис. 4). Т. обр., такой "челночный" тип действия разобщителя приводит к уменьшению 