Контрольное задание № 14
1. Напишите схемы катодного и анодного процессов при электролизе раствора соли с инертными электродами.
2. Рассчитайте массу (для газа – объём при н.у.) выделившегося на катоде вещества, при заданных условиях.
| Вариант | Соль | Сила тока,А | Время | Вариант | Соль | Сила тока,А | Время |
| Na2SO4 | 1,5ч | Co(NO3)3 | 0,50 | 1,5ч | |||
| CuSO4 | 40мин | MgCl2 | 0,30 | 50мин | |||
| CuCl2 | 0,5ч | K2SO4 | 0,80 | 6,0ч | |||
| Pb(NO3)2 | 2,5 | 25мин | NaNO3 | 3,50 | 2,5ч | ||
| FeCl2 | 1ч | PtCl2 | 5,0 | 10мин | |||
| KNO3 | 50мин | Li2SO3 | 5,5 | 40мин | |||
| SnCl2 | 1,5 | 30мин | NaCrO2 | 4,0 | 50мин | ||
| KCl | 3,5 | 45мин | K3PO4 | 4,5 | 1ч | ||
| Ca(NO3)2 | 1,5ч | AlCl3 | 6,0 | 2ч | |||
| AgNO3 | 2,3 | 35мин | PtCl4 | 5,0 | 3ч | ||
| MnSO4 | 1,7 | 60мин | HgSO4 | 0,9 | 4ч | ||
| ZnSO4 | 0,9 | 2,0ч | K2S | 0,7 | 5ч | ||
| NaBr | 0,8 | 20мин |
Тема: Коррозия металлов
Теоретическая часть.
Коррозия металлов - самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой.
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
анодный – окисление металла Me0 - n 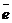
 = Me n+
= Me n+
и катодный – восстановление ионов водорода 2Н+ + 2 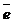 = H2
= H2
или молекул кислорода, растворенного в воде, О2 + 2Н2О + 4 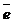 = 4ОН-.
= 4ОН-.
Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии-коррозии во влажном воздухе при комнатной температуре -деполяризатором является кислород.
В практике часто имеют дело с контактом двух различных металлов. При наличии электролита в месте контакта самопроизвольно возникает коррозионный гальванический элемент. При гальванокоррозии различают атмосферную коррозию (коррозию металла в нейтральной среде в присутствии кислорода) и коррозию в кислой среде (как в присутствии, так и в отсутствии кислорода).
Рассмотрим, коррозию железа, контактирующего с медью, в различных условиях.
1) Атмосферная коррозия.
Схема возникающего при этом коррозионного элемента следующая:
Fe │Н2О, О2│ Сu.
В таком элементе Fe - анод, а Сu -катод, так как φ0Fe2+/Fe= - 0.44 В, φ0Cu2+/Cu= 0,34 В.
На аноде протекает процесс: Fe = Fe2 + 2e,
на катоде: О2 + 2Н2О = 4 OН- (кислородная деполяризация).
Суммарная реакция: 2Fe + O2 + 2H2O = 2Fe (OH)2.
Продуктом коррозии является Fe (OН)2,который окисляется кислородом воздуха до Fe (ОН)3: 4Fe (OН)2 + О2 + 2H2O = 4Fe (OН)3.
2) Коррозия в нейтральной среде.
Схема коррозионного элемента:
Fе│Н2О│Cu.
Процесс на аноде: Fe -2е = Fe2+. Процесс на катоде:
2Н2О + 2е = Н2 + 2ОН- (водородная деполяризация).
Суммарная реакция: Fe + 2H2O = H2 + Fe(ОН)2.
Продуктом коррозии, как и в первом случае, является Fe (ОН)2, который, по вышеуказанной реакции, превращается в Fe (ОН)3.
3) Коррозия в растворе серной кислоты с растворенным кислородом.
Схема коррозионного гальванического элемента:
Fe |H2SO4, О2| Сu.
На аноде протекает тот же процесс (Fe = Fe2+ + 2e),
а на катоде - O2 + 4H+ + 4e = 2H2O
Суммарная реакция: 2Fe + О2 + 4H+ = 2Fe2+ + 2H2O.
Продуктом коррозии является соль FeSO4
4) Коррозия в растворе хлороводородной кислоты.
Схема коррозионного гальванического элемента:
Fe |HCl|Сu.
На аноде протекает процесс: Fe = Fe2+ + 2e,
на катоде: 2H+ + 2e = H2.
Суммарная реакция: Fe + 2H+ = Fe2+ + H2.
Продуктом коррозии является соль FeCl2.
Контрольное задание №15
1. Для двух металлов находящихся в контакте друг с другом определите, какой из металлов будет корродировать при попадании их в электролитически проводящую среду.
2. Написать уравнение коррозии протекающей в соответствующей среде электролита.
3. Предложите известные вам способы защиты от коррозии.
| Вариант | Контакти-рующие металлы | Среда электролита | Вариант | Контакти- рующие металлы | Среда электролита |
| Fe, Ag | Влажный воздух | Zn, Ag | Морская вода | ||
| Fe, Cu | Соляная кислота | Cu, Sn | Вода, насыщенная О2 | ||
| Zn, Fe | Влажный воздух с СО2 | Cr, Pb | Соляная кислота | ||
| Fe, Cu | Раствор H2SO4 | Fe, Pb | Кислая среда | ||
| Fe, Sn | Раствор H2SO4 | Fe, Mg | Вода, насыщенная О2 | ||
| Fe, Sn | Вода, насыщенная Н2 | Zn, Ag | Влажный воздух | ||
| Fe, Ni | Вода, насыщенная СО2 | Pb, Cu | Водный раствор | ||
| Cr, Cu | Соляная кислота | Zn, Cr | Раствор H2SO4 | ||
| Al, Cu | Раствор CuС12 | Pb, Ag | Влажный воздух | ||
| Mg, Al | Морская вода | Zn, Ni | Раствор H2SO4 | ||
| Mg, Sn | Раствор H2SO4 | Fe, Sn | Соляная кислота | ||
| Co, Fe | Влажный воздух | Fe, Ag | Соляная кислота | ||
| Fe, Cr | Водный раствор |
Тема: Электрохимия
Теоретическая часть.
Переход энергии химической реакции в энергию электрического тока и обратно происходит в электрических системах, состоящих из электродов и электролитов. Электрод – это система, состоящая из двух фаз, одна из которых является металлом, а другая – электролитом. Схематически записывается:
Ме|Ме+х. Между компонентами фаз происходит электродная реакция сопровождающаяся переходом электрических зарядов из одной фазы в другую и возникновением скачка потенциала на границе их раздела.
Механизм возникновения электродного потенциала.
Если погрузить металлическую пластинку в воду, то катионы металла на её поверхности гидратируются полярными молекулами воды и переходят в жидкость, заряжая её положительно. При этом электроны, в избытке остающиеся в металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В результате этого в системе устанавливается подвижное равновесие.
На границе соприкосновения металла и жидкости возникает двойной электрический слой, характеризующийся определенным скачком потенциала.
Абсолютные значения электродных потенциалов измерить не удается.

-
- + +
- + +
- +
металл (Zn) - раствор (Zn+2)
Итак: при погружении металла в раствор, содержащий ионы этого же металла, на поверхности раздела фаз образуется двойной электрический слой и возникает определенный скачек потенциала, который называют электродным потенциалом.
Процесс перехода ионов металла в жидкость является обратимым, схематично выражается уравнением:
Me + m H2O ↔ Me(H2O)n+m + ne (1)
В растворе на металле
При погружении различных металлов в воду величины возникающих потенциалов различны. Чем активнее металл, тем больше ионов переходят в окружающую водную среду, следовательно, тем больше величина отрицательного заряда, возникающего на металлической пластинке.
При погружении металла в раствор соли этого металла, равновесие (1) смещается, из металла в раствор будет переходить меньше ионов, а значит уменьшиться отрицательный заряд металла и его отрицательный потенциал. При удалении избыточных электронов из металла, равновесие (1) сместится вправо. Такие условия создаются в гальваническом элементе. При погружении металлов в растворы их солей одни из них заряжаются положительно (это менее активные металлы), другие, наоборот, отрицательно (это более активные металлы). Потенциал каждого электрода зависит от природы металла, концентрации его ионов в растворе и температуры.
При погружении металла в раствор его соли с активностью больше или меньше 1 моль/л, потенциал Е металла отличается от стандартного. В этом случае его величина вычисляется по формуле Нернста:
eМе = e0Ме + 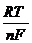 2,303 lg a Ме+n, где (1)
2,303 lg a Ме+n, где (1)
eМе - электродный потенциал металла Ме в растворе, (В).
e0Ме – стандартный электродный потенциал, (В).
R - универсальная газовая постоянная -8,31 Дж\мольК;
Т – температура по шкале Кельвина;
F – число Фарадея – 96500 Кл\моль;
n – число электронов, участвующих в электродном процессе;
2,303 – модуль перехода от натуральных логарифмов к десятичным;
a – активность ионов металла в растворе;
Активность ионов связана с концентрацией раствора и эта связь выражается уравнением
аме +х = fа С,
где аме+х – активность, С- молярная концентрация раствора и fа –коэффициент активности, учитывающий электростатическое взаимодействие ионов в растворе.
Где 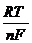 2,303 = 0,059 или Ж
2,303 = 0,059 или Ж
Уравнение принимает вид: eМе = e0Ме + 0,059/n ∙ lg a Ме+n,
Из уравнения следует: стандартным потенциалом e0 называется такой потенциал, который возникает на металлической пластинке, находящейся в контакте с одноименными ионами в растворе, с активностью ионов 1моль\л,.в нормальных условиях (Р=101,3 кПа = 1атм; Т=298К)
Величина e0 характеризует химическую активность металла: чем активнее металл, тем отрицательнее его стандартный потенциал.
Электрод, состоящий из платины, насыщенной водородом под давлением в 101,325 кПа и погруженной в водный раствор с активностью ионов водорода равной единице, называется нормальным водородным электродом.