Если стандартный потенциал какого-либо металла больше водородного, его принято считать положительным, если меньше – отрицательным.
Если все металлы расположить последовательно по возрастающей величине их стандартных потенциалов, получится ряд стандартных электродных потенциалов (ряд напряжений). В табл. приведены стандартные потенциалы некоторых металлов.
- В этом ряду слева направо происходит уменьшение химической активности металлов.
- Ряд напряжений широко используется в практике при составлении гальванических элементов, (например, при составлении гальванического элемента из цинка и свинца в качестве положительного берется свинцовый (e0Sb = 0, 13 в), а в качестве отрицательного – цинковый (e0Zn = - 0,76 в)), при изучении взаимодействия между металлами и кислотами, между солями и металлами.
- Зная ряд напряжений можно предвидеть направление реакции вытеснения одних элементов другими. Металлы, стоящие в ряду напряжения после водорода, не способны вытеснять водород из кислот. Вытеснение металла из солей другим металлом осуществляется только в том случае, если вытесняющий металл расположен в ряду напряжений до вытесняемого.
Величина стандартного окислительно-восстановительного потенциала характеризует свойства окислителей и восстановителей, а именно:
- чем выше e0ОВ, тем более сильным окислителем являются ионы в высшей степени окисления;
- чем ниже e0ОВ, тем более сильным восстановителем являются ионы в низшей степени окисления.
Стандартные окислительно-восстановительные потенциалы некоторых систем приведены в табл.6. (Приложение)
Два металла, погруженные в растворы солей, соединенных солевым мостиком, образуют гальванический элемент. При соединении обоих электродов проводником происходит движение электронов. На электроде из активного металла происходит окисление атомов, этот электрод принято считать анодом. Электроны поступают во внешнюю цепь, являясь источником электронов. На менее активном металле происходит восстановление ионов металла, этот электрод считается положительным, называют – катодом
Гальваническим элементом (цепью) называется устройство, в котором энергия химической реакции превращается в электрическую.
Гальванический элемент схематически записывается следующим образом (на примере элемента Даниэля-Якоби):
(+)Cu½CuSO4½KCl½ZnSO4½Zn (-)
eCu eZn
Cлева записывается более электроположительный электрод, которым в данной цепи является медный. Реакция, протекающая на левом электроде, является восстановительной, на правом – окислительной. Реакция гальванического элемента равна сумме двух реакций:
на левом электроде происходит восстановление: Cu2+ + 2e®Cu,
на правом электроде – окисление: Zn – 2e ® Zn2+
При этом левый электрод заряжается положительно, правый – отрицательно, во внешней цепи ток пойдет справа налево, во внутренней – слева направо за счет перемещения анионов электролита.
Гетерогенная граница между электродом и раствором отражается вертикальной чертой, которая указывает на возникновение скачка потенциала на данной границе. Роль электролитического проводника между электродами выполняет насыщенный раствор KCl.
Максимальная разность потенциалов, достигаемая при обратимой работе гальванической цепи, называется электродвижущей силой (ЭДС). При определении ЭДС из большего электродного потенциала левого электрода вычитают меньший электродный потенциал правого электрода Е=eCu - eZn
(+)Ме1½Ме1n +½электролитический проводник½Ме2n + ½Ме2 (-)
ЭДС данной гальванической цепи вычисляется по уравнению:
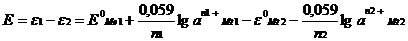
где: e1 и e2 – электродные потенциалы,
а1 и а2 – активности ионов металлов в растворах,
n1+ и n2+ - заряды ионов.
Задача1.
Составить схему гальванического элемента состоящего из медного и цинкового электродов погруженных в растворы с концентрацией электролитов Zn 2+ 0.1моль/л и Cu2+ 0,01 моль /л. Рассчитать э.д.с. гальванического элемента.
Дано: Решение:
С (Zn 2+) = 0,1моль/л Схема гальванической цепи:
(Cu2+) = 0,01 моль /л (+)Cu½CuSO4½KCl½ZnSO4½Zn (-)
Найти: Е (гальванического элемента)? Используя вышеприведенное уравнение
Е0(Сu) = 0,34в Е = 0,34 – (-0,76) +0,059/2 (lg 0.1- lg0.01)= Е0(Zn) = -0,76в = 1,16 в
Ответ: Е = 1,16 в
Э.д.с. гальванического элемента, составленного из двух разных электродов, но с одинаковой концентрацией (активностью) их солей, равна разности стандартных потенциалов этих электродов.
Контрольное задание №16
1. Составьте схему гальванического элемента из двух электродов, погруженных в раствор с соответствующей концентрацией.
2. Напишите уравнение реакции на электродах.
3. Рассчитайте ЭДС этого гальванического элемента для стандартных условий.
| Вариант | Концентрация катионов полуэлементов, моль/л | Концентрация катионов полуэлементов, моль/л | |||
| Первого | Второго | Первого | второго | ||
| Zn/Zn2+ - 0.01 | Ag/Ag+ - 0.02 | Ni/Ni2+ - 0.02 | Ni/Ni 2+ -0.2 | ||
| Mg/Mg2+ - 0.1 | Ag/Ag+ - 0.2 | Al/Al3+ - 0.3 | Fe/Fe2+- 0.2 | ||
| Cu/Cu2+ - 0.02 | Ni/Ni2+ - 0.01 | Mg/Mg2+- 0.1 | Cu/Cu2+ - 0.1 | ||
| Pb/Pb2+ - 0.01 | Cu/Cu2+ - 0.1 | H2/2H+ - 1 | Ag/Ag+ - 0.1 | ||
| Ag/Ag+-0.001 | Ag/Ag+ - 1.0 | Fe/Fe2+ - 0.02 | Ag/Ag+ - 0.1 | ||
| Zn/Zn2+ - 0.1 | Ni/Ni2+ - 0.1 | Ag/Ag+-0.01 | Ni/Ni2+ - 0.1 | ||
| Fe/Fe2+ - 0.1 | Cu/Cu2+ -0.1 | Zn/Zn2+ - 0.1 | Fe/Fe2+ - 0.1 | ||
| Mn/Mn2+ - 0.2 | Ag/Ag+ - 0.01 | H2/2H+ - 1 | Cr/Cr3+ - 0.1 | ||
| Fe/Fe2+ - 0.1 | Cr/Cr3+ - 0.1 | Ni/Ni2+ - 0.05 | Mn/Mn2+ - 0.2 | ||
| Ni/Ni2+ - 0.05 | Cu/Cu2+ - 0.2 | H2/2H+ - 0.02 | Cd/Cd2+ - 0.02 | ||
| Sn/Sn2+ -0.02 | Cu/Cu2+ - 0.1 | Sn/Sn2+ -0.02 | Ag/Ag+ - 0.01 | ||
| Mg/Mg2+- 0.05 | Cu/Cu2+ - 0.2 | Cu/Cu2+ - 0.2 | Fe/Fe2+ - 0.1 | ||
| H2/2H+ - 0.02 | Ni/Ni2+ - 0.1 |