2K+1Cl+5O3-1 = 2K+1Cl-1 + 3O20
2K+1Br-1 + Cl20 = Br20 + 2K+1 Cl-1
Изменение степени окисления может быть вызвано перемещением электронов, а также перераспределением электронной плотности. Под степенью окисления понимают тот условный заряд атома, который приобрел бы этот атом элемента, если предположить, что он принял или отдал то или иное число электронов.
Основные положения теории:
1. Окислением называется процесс отдачи электронов атомом, молекулой или ионом.
Al - 3ē = Al3+ ; H2 - 2ē = 2H+; 2Cl- - 2ē = Cl2
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом.
S + 2ē = S2-; Cl2 + 2ē = 2Cl-; Fe3+ + ē = Fe2+
3. Атомы, молекулы, ионы, отдающие электроны, называются
восстановителями, в реакции они окисляются.
Атомы, молекулы, ионы, присоединяющие электроны, - окислители, в
реакции они восстанавливаются.
4.Окисление всегда сопровождается восстановлением и наоборот:
восстановитель - ē ↔ окислитель
окислитель + ē ↔ восстановитель
Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
Повышение или понижение степени окисления атомов отражается в электронных уравнениях. При этом не имеет значения, переходят ли электроны от одного атома к другому полностью и образуют ионные связи или электроны только оттягиваются к более электроотрицательному атому и возникает полярная связь. О способности того или иного вещества проявлять окислительные, восстановительные или двойственные (как окислительные, так и восстановительные) свойства можно судить по степени окисления атомов окислителя и восстановителя.
Атом того или иного элемента в своей высшей степени окисления не может её повысить (отдать электроны) и проявляет только окислительные свойства, а в низшей степени окисления нее может её повысить (принять электроны) и проявляет только восстановительные свойства. Атом же элемента, имеющий промежуточную степень окисления, может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители: активные неметаллы (О2, F2, Cl2), концентрированные растворы H2SO4, растворы HNO3 любой концентрации; KMnO4;К2Cr2O7 и другие вещества, содержащие элементы в максимальной степени окисления.
Типичные восстановители: активные металлы; Н2; С; СО; Н2S; HJ и другие вещества, содержащие элементы в низших (отрицательных) степенях окисления.
В окислительно-восстановительных реакциях обычно не изменяют степени окисления:
- ионы щелочных и щелочноземельных металлов;
- ионы водорода (кроме реакций металлов с кислотами – неокислителями);
- ионы кислорода (кроме реакций с участием пероксида водорода Н2О2);
В окислительно-восстановительных реакциях часто происходят следующие
изменения степеней окисления элементов:
 Мn2+ - в кислой среде
Мn2+ - в кислой среде

 КМnО4
КМnО4  MnO2 - в нейтральной среде
MnO2 - в нейтральной среде
K2МnO4 - в щелочной среде
 SO2 – в реакциях с малоактивными металлами, стоящими в ряду
SO2 – в реакциях с малоактивными металлами, стоящими в ряду
напряжений после водорода, и с неметаллами

 H2SO4 S0 – в реакциях с металлами средней активности, стоящими в
H2SO4 S0 – в реакциях с металлами средней активности, стоящими в
ряду напряжений между цинком и водородом.
H2S – в реакциях с активными металлами, стоящими в ряду напряжений до цинка.
Степень окисления – это условный заряд атома в соединении, вычисленный исходя из предположения, что оно состоит только из ионов.
Отрицательное значение (-) степени окисления имеют атомы, которые приняли электроны от других атомов, то есть в их сторону смещено связующее электронное облако.
Например: NaCl-1
Положительное значение (+) степени окисления имеют атомы, отдающие свои электроны другим атомам, то есть связующее электронное облако оттянуто от
них.
Например: металлы в соединениях, Na+1Cl
Нулевое значение (0) степени окисления имеют атомы в молекулах простых
веществ, электронное облако в равной мере принадлежит обоим атомам.
Например: Cl2, О2, Н2
Алгебраическая сумма степеней окисления атомов в соединении всегда равна
нулю:
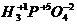 ® (+1)×3 + (+5) + (-2)×4 = 0;
® (+1)×3 + (+5) + (-2)×4 = 0;
а в сложном ионе – заряду иона: [ 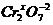 ]2- ® 2x + (-2)×7 = -2; x = +6
]2- ® 2x + (-2)×7 = -2; x = +6