Диоксид и гидроксид титана. Диоксид титана находится в природе в основном виде трех модификаций: рутила, брукита и анатаза, отличающихся по своей кристаллической структуре и физическим свойствам. В природе диоксид рутила обычно загрязнен примесями железа и окрашен в черный цвет, чистый TiO2 на холоду бесцветен, при нагревании приобретает желтоватый цвет.
Даже аморфный диоксид титана нерастворим в воде и разбавленных кислотах. Из-за своей химической инертности он применяется в производстве различных эмалей и красок. Определенным образом обработанные в виде тонкого порошка оксид титана используют в виде минеральной краски – титановые белила – для покрытий и окраски тканей. По кроющей способности она превосходит цинковые белила, а по прочности – свинцовые. Также в смеси с другими оксидами ее используют для получения глазури.
В горячей концентрированной серной кислоте растворяется медленно, лучше всего растворяется в расплавленных гидросульфатах щелочных металлов.
TiO2 + КНSO4 = Ti (SO4)2 + К2SO4 + H2O
TiO2 + Н2SO4 = TiОSO4 + H2O
Сульфат или оксосульфат титана разлагается при кипячении с водой, или в слабокислом растворе. При этом образуется b- титановая кислота, ей приписывают формулу H2TiO3. Ее отличают от a-титановой кислоты, которая получается при действии свеже приготовленного кислого раствора сульфата титана с гидроксидами или карбонатами щелочных металлов или с аммиаком на холоду.
Ti (SO4)2 + K2CO3 + H2SO4 = H4TiO4 + K2SO4 + CO2
Ti (SO4)2 + NH4OH = Ti(OH)4 + (NH4)2SO4
a-титановая кислота представляет собой слизистое вещество типа гидрогеля, полагают, что ее состав H4TiO4, т.е. это ортотитановая кислота. Свежеосажденный гидроксид титана растворяется в кислотах с образованием производных титанил иона TiO2+. Если концентрированная кислота берется в избытке, то образуются комплексные соединения состава [TiО(SO4)2]2- или [Ti(SO4)3]2-.
H4TiO4 + H2SO4 = TiOSO4 + H2O
H2[TiO(SO)2]
Свежеосажденный гидроксид титана реагирует также с концентрированными растворами щелочей с образованием гидроксокомплексов
2 NaOH + Ti (OH)4 = Na2[Ti(OH)6]
b- титановая кислота кислота менее реакционноспособна, она почти не растворяется в кислотах, кроме горячей серной кислоты. Между a- и b-титановыми кислотами существует ряд переходных состояний. Cтарение происходит довольно быстро даже при комнатной температуре, конечным продуктом является гидратированный оксид TiO2 × n H2O.
При нагревании Ti (OH)4 претерпевает следующие превращения
Ti (OH)4 ® H2TiO3 ® TiO2 ® Ti2O3
Превращение белого диоксида в фиолетовый оксид требует прокаливания в течение достаточно длительного времени.
Оксиды циркония и гафния образуются в виде белых, нерастворимых в воде порошков при прокаливании гидроксидов циркония и гафния или их солей с летучими кислородными кислотами, тугоплавки.
Zr(NO3)4 =ZrO2 + NO2 + O2
Zr(OH)4= ZrO2 + H2O
Кристаллические оксиды, полученные плавлением, нерастворимы в кислотах, за исключением плавиковой, но легко сплавляются со щелочами и карбонатами щелочных металлов. Слабопрокаленные довольно легко растворяются в минеральных кислотах; после сильного прокаливания они растворимы в концентрированной серной кислоте.
ZrO2 + 8HF = H4[ZrF8] + 4H2O
ZrO2 + KOH = K2ZrO3 + H2O
Гидроксиды циркония и гафния представляют собой белые желатинообразные осадки с переменным содержанием воды. Осажденные на холоду они растворяются в разбавленных кислотах. Очень легко образуют коллоидные растворы. Если осаждение вести при нагревании, то получаются гидроксиды с меньшим содержанием воды, они трудно растворяются в кислотах и их называют b - кислотами. Гидроксид титана растворим в концентрированных щелочах, гидроксиды циркония и гафния с щелочами практически не взаимодействуют.
Основные свойства металлов и их соединений по подгруппе сверху вниз возрастают.
Галогениды титана, циркония и гафния. Тетрафториды полимерны, к.ч. титана равно 6, циркония и гафния 8. Хлориды (кроме жидкого хлорида титана), бромиды и иодиды представляют собой молекулярные кристаллы, устойчивость которых обусловлено образованием p-системы вакантных орбиталей металлов и неподеленными электронными парами галогенов. Почти все галогениды бесцветны, за исключением бромида титана и иодидов.
Получают галогениды восстановлением соответствующих оксидов углем в атмосфере нужного галогена
TiO2 + C + Cl2 = TiCl4 + CO2
Все тетрагалогениды летучи, химически активны, склонны к присоединению донорских молекул (воды или аммиака).
Гидратированные ионы Ti+4, Zr+4 и Hf+4 вследствие большого размера в растворе существовать не могут, и их растворимые соли сильно гидролизуются. Гидролиз протекает с образованием многоядерных комплексных соединений. В качестве первой стадии гидролиза TiCl4 рассматривают его координационное насыщение до TiCl4 × 2 H2О, второй и последующих – отщепление молекул хлороводорода и образование оловых и оксоловых комплексов.




 Cl H2O Cl
Cl H2O Cl

 1) TiCl4 + 2H2O ↔ Ti + 4 H2O ↔
1) TiCl4 + 2H2O ↔ Ti + 4 H2O ↔
 |
Cl H2O Cl


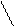 H2O OH OH
H2O OH OH


 Ti + 4KCl
Ti + 4KCl
OH OH OH2











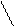 H2O OH OH H
H2O OH OH H


 O
O

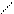
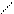



 2 Ti ↔ Ti Ti ↔—Ti — O — Ti—
2 Ti ↔ Ti Ti ↔—Ti — O — Ti—





 O
O
OH OH OH2 H
Переход оловых комплексов в оксоловые протекает легче, чем обратное превращение. Переходу гидроксоаквакомплексов в оловые или оксоловые способствуют повышение температуры, щелочная среда и стояние раствора. При этом возможна даже образование коллоидных растворов за счет дальнейшей полимеризации. В многоядерных комплексах возможно замещение молекул воды и гидроксогрупп на присутствующие в воде анионы. Это объясняет образование при взаимодействии оксидов и гидроксидов с кислотами не средних, а оксосолей или основных солей.
Из кислых солей можно выделить кристаллогидраты состава TiOCl2 × 2 H2O, TiOSO4 × 2 H2O, ZrOCl2 × 8 H2O, ZrOSO4 × 8 H2O, HfOCl2 × 2 H2O.
Соединения простого состава получают только в неводных растворах, например, сульфат титана можно получить взаимодействием тетрахлорида титана и триоксида серы в хлористом сульфуриле или сплавлением оксида титана и пиросульфата калия, нитрата циркония – взаимодействием безводных хлорида циркония и оксида азота (V).
ZrCl4 + 4N2O5 = Zr(NO3)4 + 4NO2Cl
TiCl4 + 4 SO3 = Ti (SO4)2 + 2SO2Cl2
TiO2 + 2 K2S2O7 = Ti (SO4)2 + 2 K2 SO4
Сульфид титана. При пропускании смеси тетрахлорида титана с сероводородом через раскаленную фарфоровую трубку образуются золотые чешуйки дисульфида титана
TiCl4 + 2 Н2S = Ti S2 + 4 НCl
На холоду реакция идет иначе
ТiCl4 + 2 Н2S = Ti Cl2 + S + 2 НCl
При обычной температуре он устойчив на воздухе, при нагревании на воздухе переходит в диоксид титана, при нагревании в токе азота или водорода в низшие сульфиды Ti2S3 и Ti S. Дисульфид титана не растворяется в воде даже при кипячении, ни в разбавленных серной, соляной кислотах и растворе аммиака. Разлагается он концентрированными азотной или серной кислотами с выделением серы.
TiS2 + O2 = TiO2 + SO2
Ti S2 + Н2SO4 = Ti OSO4 + S + H2O
При кипячении растворяется в едком калие с образованием титаната и сульфида калия.
Ti S2 + КОН = К2TiO3 + К2S
Ti S2 + 2CO2(сухой) = TiO2 + 2CO + S
Карбиды титана, циркония и гафния можно получить спеканием порошкоообразного металлов или их диоксидов с прокаленной сажей в графитовом сосуде при 2000°С в атмосфере водорода. Карбид титана по своему внешнему виду похож на металлический титан, но отличается от него более высокой температурой плавления и большей стойкостью к кислотам. Применяют его благодаря большой прочности для изготовления металлокерамических материалов
Э + С = ЭС
Карбид циркония получают при восстановлении его оксидов углем, это черные с металлическим блеском кристаллы, электропроводны. В расплавленном состоянии карбид циркония растворяет углерод, который выделяется в виде графита при охлаждении.
Карбид циркония не так устойчив, он растворяется в азотной, серной кислотах и царской водке, но на него не действует соляная кислота. Легко растворяется в расплавленных щелочах, при повышенных температурах взаимодействует с азотом и галогенами. Часто используется для получения галогенпроизводных циркония.