1. Спирты реагируют с щелочными и щелочноземельными металлами, образуя солеобразные соединения – алкоголяты. Со щелочами спирты не взаимодействуют.
2СH3CH2CH2OH + 2Na 2СH3CH2CH2ONa + H2
2СH3CH2OH + Сa (СH3CH2O)2Ca + H2
В присутствии воды алкоголяты гидролизуются: (СH3)3С–OK + H2O (СH3)3C–OH + KOH
Это означает, что спирты – более слабые кислоты, чем вода.
2. Взаимодействие с органическими кислотами (реакция этерификации) приводит к образованию сложных эфиров.
| O II | O II | ||||
| CH3– | C- | -OH + H - | -OC2H5 H2SO4CH3– | C | –O–C2H5(уксусноэтиловый эфир (этилацетат)) + H2O |
В общем виде:
| O II | H+ | O II | |||||
| R– | C- | -OH + H- | -OR’ | | R– | C | –O–R’ + H2O |
II. Реакции с разрывом связи R–OH.
1. С галогеноводородами: R–OH + HBr R–Br + H2O
2. С концентрированной серной кислотой:
| C2H5O- | -H + H–O | O | C2H5O | O | ||
| \ // S / \\ | | \ // S (этилсерная кислота) + H2O / \\ | ||||
| H–O | O | H–O | O |
| C2H5–O | O | C2H5O | O | |||
| \ // S / \\ | | \ // S (диэтилсерная кислота(диэтилсульфат)) + H2O / \\ | ||||
| C2H5O- | -H + H–O | O | C2H5O | O |
III. Реакции окисления
1. Спирты горят: 2С3H7ОH + 9O2 6СO2 + 8H2O
2. При действии окислителей:
a) первичные спирты превращаются в альдегиды (или в карбоновые кислоты)
| O II | O II | |||||||
| R- | -CH2–OH | (первичный спирт) ––[O] | R- | -C | (альдегид) ––[O] | R- | -C | (карбоновая к-та) |
| I H | I OH |
| K2Cr2O7 | O II | K2Cr2O7 | O II | |
| CH3–CH2–OH | –––– | CH3–C | –––– | CH3–C |
| H2SO4 | I H | H2SO4 | I OH |
| O II CH3OH + CuO ––t H–C I H | + Cu + H2O |
b) вторичные спирты окисляются до кетонов
| R- | -CH- | -R’(вторичный спирт) ––[O] | R- | -C- | -R'(кетон) |
| I OH | II O |
| CH3– | CH–CH2–CH3 I OH | ––K2Cr2O7,H2SO4 | CH3– | C–CH2–CH3 II O |
c) третичные спирты устойчивы к действию окислителей.
IV. Дегидратация
Протекает при нагревании с водоотнимающими реагентами.
1. Внутримолекулярная дегидратация приводит к образованию алкенов
CH3–CH2–OH ––t>140C,H2SO4 CH2=CH2 + H2O
| CH3 \ | CH3 I | |||
| CH3–C– | CH–CH3 | ––t,H2SO4 | CH3– | C=CH–CH3 + H2O |
| I HO | I H |
При отщеплении воды от молекул вторичных и третичных спиртов атом водорода отрывается от соседнего наименее гидрогенизированного атома углерода; образующийся алкен содержит наибольшее число заместителей при двойной связи (правило Зайцева).
2. Межмолекулярная дегидратация даёт простые эфиры
| R- | -OH + H- | -O–R –– t,H2SO4 R–O–R(простой эфир) + H2O |
| CH3–CH2- | -OH + H- | -O–CH2–CH3 ––t<140C,H2SO4 CH3–CH2–O–CH2–CH3(диэтиловый эфир) + H2O |
Обе реакции конкурируют между собой. Увеличение температуры и разбавление инертным растворителем благоприятствуют внутримолекулярному процессу.
Многоатомные спирты
Получение
1. Этиленгликоль (этандиол-1,2) синтезируют из этилена различными способами:

3CH2=CH2 + 2KMnO4 + 4H2O 3HO–CH2–CH2–OH + 2MnO2 + 2KOH
2. Глицерин (пропантриол -1,2,3) получают гидролизом жиров (см. "Жиры") или из пропилена по схемам:

Физические свойства
Этиленгликоль и глицерин – бесцветные, вязкие жидкости, хорошо растворимые в воде, имеют высокие температуры кипения.
Химические свойства
Для многоатомных спиртов характерны основные реакции одноатомных спиртов. В отличие от них, они могут образовывать производные по одной или по нескольким гидроксильным группам, в зависимости от условий проведения реакций.
Многоатомные спирты, как и одноатомные, проявляют свойства кислот при взаимодействии с активными металлами, при этом происходит последовательное замещение атомов водорода в гидроксильных группах.
| CH2–OH I CH2–OH | Na ––– -1/2H2 | CH2–ONa I CH2–OH | Na ––– -1/2H2 | CH2–ONa I CH2–ONa |
Увеличение числа гидроксильных групп в молекуле приводит к усилению кислотных свойств многоатомных спиртов по сравнению с одноатомными.
Так, они способны растворять свежеосаждённый гидроксид меди (II) с образованием внутрикомплексных соединений:
| CH2–OH 2 I + Cu(OH)2(голубой осадок) CH2–OH |  (гликолят меди (ярко-синий раствор)) (гликолят меди (ярко-синий раствор))
|
(одноатомные спирты с Cu(OH)2 не реагируют).
Глицерин легко нитруется, давая тринитроглицерин – сильное взрывчатое вещество (основа динамита):
| CH2–O- | -H | HO- | -NO2 | CH2–O–NO2 | |||
| I | H2SO4 | I | |||||
| CH –O- | -H | + | HO- | -NO2 | ––– | CH–O–NO2 | + 3H2O |
| I | I | ||||||
| CH2–O- | -H | HO- | -NO2 | CH2–O–NO2 |
При его взрыве выделяется большое количество газов и тепла:
| CH2–O–NO2 I 4CH–O–NO2 12CO2 + 6N2 + 10H2O + O2 + Q I CH2–O–NO2 |
Применение
Этиленгликоль применяют:
1) в качестве антифриза;
2) для синтеза высокомолекулярных соединений (например, лавсана).
Глицерин применяют:
1) в парфюмерии и в медицине (для изготовления мазей, смягчающих кожу);
2) в кожевенном производстве и в текстильной промышленности;
3) для производства нитроглицерина.

Фенолы
Фенолы содержат гидроксил непосредственно связанный с атомом углерода ароматического кольца. По числу гидроксильных групп, присоединенных к кольцу, фенолы подразделяются на одно-, двух- и многоатомные.
Изомерия фенолов обусловлена взаимным положением заместителей в бензольном кольце.
орто-крезол  мета-крезол
мета-крезол  пара-крезол
пара-крезол 
Получение
Фенол в промышленности получают:
1) окислением изопропилбензола (кумола) в гидроперекись с последующим разложением её серной кислотой.
| CH3 I | CH3 I | ||||||
| H3C–CH | H3C–C–O–OH | OH | O | ||||

| O2 | 
| H2SO4 | 
| II | ||
| | ––– | + H3C– | C | –CH3 |
2) из бензола по способу Рашига:

| HCl + O2 | 
| H2O(Cu2+) | 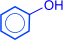
|
| –––––– | –––––– | |||
| -H2O | -HCl |
Химические свойства
1. Кислотные свойства у фенолов выражены сильнее, чем у спиртов. В результате сопряжения неподелённой пары электронов кислородного атома с - электронной системой ароматического кольца, электронная плотность О-атома перемещается частично на связь С–О, увеличивая при этом электронную плотность в бензольном ядре (в особенности в орто- и пара-положениях). Электронная пара связи О–Н сильнее притягивается к атому кислорода, способствуя тем самым созданию большего положительного заряда на атоме водорода гидроксильной группы и, следовательно, отщеплению этого водорода в виде протона.
| H+ | 
|
Фенолы, в отличие от спиртов, образуют феноляты не только при взаимодействии с активными металлами, но и с водными растворами щелочей.

| OH + 2Na | 
| ONa(фенолят натрия) + H2 |

| OH + NaOH | 
| ONa + H2O |
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией, идентифицирующей фенолы:

| ||||||

| OH + FeCl3 | 
| O–Fe | + 3 HCl | ||

|
Фенолы – очень слабые кислоты, поэтому феноляты легко гидролизуются и разрушаются не только сильными, но и очень слабыми кислотами:

| ONa + H2SO4 | 
| OH + NaHSO4 |

| ONa + CO2 + H2O | 
| OH + NaHCO3 |
Фенолы образуют простые эфиры (синтез Вильямсона) и сложные эфиры

| O | Na + Br- | -CH2–CH3 | 
| O–CH2–CH3(этилфениловый эфир) + NaBr |
и сложные эфиры
| O II | O II | |||||

| O | H + Cl- | -C–CH3(хлорангидрид укс.кислоты) | 
| O– | C–CH3(фениловый эфир укс.кислоты) + HCl |
2. Реакции бензольного кольца. Гидроксильная группа у фенолов является очень сильным орто- и пара-ориентантом. Реакции замещения атомов водорода в бензольном кольце протекают в более мягких условиях, чем у бензола. При бромировании и нитровании могут быть получены 2,4,6-тризамещенные производные
| OH | OH | OH | ||||

| + 3H2O | 3HNO3 ––– H2SO4 | 
| 3Br2 ––– | 
| + 3HBr |
| NO2 | Br | |||||
| 2,4,6 – тринитро фенол (пикриновая кислота) | 2,4,6–трибром- фенол |
3. Гидрирование.
| OH | OH | |

| 3H2 –– Ni |  (циклогексанол) (циклогексанол)
|
Применение
Фенол применяется при производстве фенолформальдегидных смол, в фармацевтической промышленности и как антисептик (карболовая кислота).
Гидрохинон (1,4-диоксибензол) – проявитель в фотографии.