Ко II аналитической группе относятся катионы Ca2+, Ba2+, Sr2+. Основные свойства этих металлов выражены сильно, поэтому соли, образованные сильными кислотами, в воде не гидролизуются и имеют в растворах реакцию среды, близкую к нейтральной. Большинство их солей бесцветны. Хорошо растворимы в воде галогениды, нитраты и ацетаты. Характерной особенностью катионов II группы является образование труднорастворимых сульфатов, фосфатов, карбонатов, оксалатов, хроматов.
Групповым реактивом является раствор серной кислоты. Наименьшей растворимостью обладает сульфат бария, наибольшей – сульфат кальция. Осаждение CaSO4 всегда бывает неполным.
Реакции катиона Са2+.
Реакция с карбонатом аммония (NН4)2СО3
Катион Са2+ с групповым реактивом (NН4)2СО3 образует белый аморфный осадок карбоната кальция, при нагревании переходящий в крупнокристаллический:
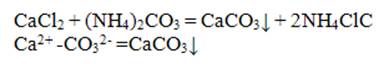
Для более полного осаждения катиона Са2+ реакцию следует проводить в аммиачной среде. Осадок СаСОз растворим и разбавленных соляной, азотной и уксусной кислотах:
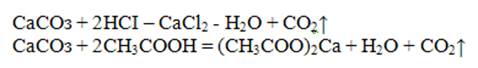
Проведение реакции: В пробирку прилить 2-3 капли раствора соли кальция и 1-2 капли раствора гидроксида аммония NH4OH. Пробирку со смесью нагреть на водяной бане, после чего в пробирку прибавить 2-3 капли карбоната аммония (NН4)2CO3. Наблюдать выпадение осадка. Осадок разделить на две части, к одной части добавить раствор соляной кислоты, а к другой раствор уксусной кислоты. Наблюдать растворение осадка в обеих пробирках. Реакция с о к с а л а т о м аммония (NH4)2C204 - качественная реакция.
Катион Са2' с океадатом аммония (NH4)2C2О4 образует белый кристаллический осадок оксалата кальция:

Реакция осаждения Са2+ используется при определении полноты вложения молока в супах Осадок растворим в сильных кислотах и нерастворим в уксусной кислоте (даже при нагревании па водяной бане):

Проведений реакции: В пробирку налить 2-3 капли раствора соли кальция и столько же раствора оксалата аммония (NН4)2С2О4. Наблюдать выпадение осадка. Осадок разделить на две части, к одной части прилить раствор соляной кислоты, а к другой - раствор уксусной кислоты. Наблюдать растворение осадка только в соляной кислоте.
Реакции катиона Ва2+.
Реакция с карбонатом а м м о и и я (NH4)2CO3.
Катион Ва2+ с групповым реактивом (NH4)2CO3 образует белый аморфный осадок карбонат бария, при нагревании переходящий в крупнокристаллический:
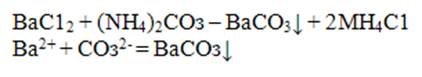
Для более полного осаждения катиона Ва реакцию следует проводить в аммиачной среде. Осадок BaCO3 растворим в разбавленных сильных кислотах (кроме H2SO4) и слабой уксусной:

Проведение реакции: В пробирку налить 2-3 капли раствора соли бария, 1-2 капли раствора гидроксида аммония NН4ОН. Пробирку со смесью нагреть па водяной бане, после чет в пробирку прилить 2-3 капли раствора карбоната аммония (NH4)2СО3 Наблюдать выпадение осадка белого цвета. Осадок разделить на две части, к одной части добавить раствор соляной кислоты, а к другой - раствор уксусной кислоты. Наблюдать растворение осадка в обеих пробирках.
Реакция с хроматом калия К2СrO4 - качественная реакция.
Катион Ва2+ с реактивом К2СrO4 образует осадок хромат бария желтого цвета:

Другие катионы второй группы с хроматом калия осадка не дают. Катионы Ва2+ можно обнаружить и исследуемом растворе хроматом калия только в нейтральной или слабокислой среде, так как и сильных кислотах осадок ВаCrO4 растворяется

Проведение реакции: В пробирку прилили 2-3 капли раствора соли бария и столько же раствора хромата калия K2CrO4. Наблюдать выпадение осадка желтого цвета. Осадок разделить на две части, к одной части осадка добавить раствор соляной кислоты» к другой раствор уксусной кислоты. Наблюдать растворение осадка в соляной кислоте.
Реакция с серной кислотой Н2SO4 (или растворимыми сульфатами).
Катион Ва2+ образует с серной кислотой H2SO4 или с ее растворимыми солями Na3SO4, K2SO4, (NH4)SO4 белый кристаллический осадок сульфат бария:

Осадок BaSO4 нерастворим ни в кислотах, пи в щелочах Проведение реакции: В пробирку прилить 2-3 капли раствора соли бария и I-2 капли раствора серной кислоты или раствора соли серной кислоты. Наблюдать выпадение осадка белого цвета.