Рассмотрим подробно функции состояния ТД системы и их значение для описания калорических свойств систем. Еще раз отметим, что это величины являются полными дифференциалами от своих параметров, т.е. их изменение зависит только от состояния, а не от пути перехода между этими состояниями. Изменение функции состояния в циклическом процессе равно нулю по определению.
I.) Энтропия.
Рассмотрим цикл Карно. Пусть одна тепловая машина работает с идеальным газом, а другая с другим рабочим телом, причем температуры нагревателей  и холодильников
и холодильников  этих машин равны. По I теореме Карно КПД этих машин равны и не зависят от природы рабочего вещества.
этих машин равны. По I теореме Карно КПД этих машин равны и не зависят от природы рабочего вещества.  Þ
Þ  , отметим, что
, отметим, что  , тогда
, тогда
 Þ
Þ 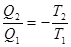 Þ
Þ  .
.
Получили важный результат. Оказывается, что если 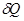 не является функцией состояния, и за цикл не равна нулю
не является функцией состояния, и за цикл не равна нулю 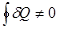 , то приведенная теплота
, то приведенная теплота 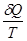 уже является функцией состояния, т.е. на замкнутом цикле ее изменение равно нулю. У понятия «приведенная теплота» нет наглядного примера, его трудно как-то представить.
уже является функцией состояния, т.е. на замкнутом цикле ее изменение равно нулю. У понятия «приведенная теплота» нет наглядного примера, его трудно как-то представить.

| - данное тождество называется тождеством Клаузиуса, оно справедливо только для обратимых процессов. |
Отсюда следует:

| - для любого обратимого процесса не зависит от пути, и, следовательно, является функцией состояния. |
Эту функцию назвали энтропия. От греческого «энтропос» - возвращение, поворот. Каждое состояние тела характеризуется определенным значением энтропии 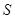 , подобно тому, как оно характеризуется определенным значением внутренней энергии
, подобно тому, как оно характеризуется определенным значением внутренней энергии  .
.
По определению в интегральной форме 
или в дифференциальной форме  , Þ
, Þ  .
.
Тождество Клаузиуса говорит, что при замкнутых обратимых процессах энтропия не меняется.
I начало ТД для обратимых процессов можно записать:  , его еще называют основное ТД тождество.
, его еще называют основное ТД тождество.
Рассмотрим, что происходит при необратимых процессах. Возьмем необратимый цикл Карно, для него КПД меньше, чем у обратимого цикла, т.е.
 Þ
Þ  Þ
Þ 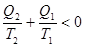 - для необратимых процессов изменение отрицательно. Если обобщать для случая кругового процесса:
- для необратимых процессов изменение отрицательно. Если обобщать для случая кругового процесса:

| - неравенство Клаузиуса, для необратимых процессов. |
Как изменяется энтропия в необратимых процессах? Рассмотрим циклический процесс. Из состояния 1 в состояние 2 система перешла по необратимому процессу, а из состояния 2 в состояние 1 по другому обратимому процессу.
 Имеем
Имеем 
отсюда  Þ
Þ  Þ
Þ 
Пусть система изолирована, нет обмена энергией с внешней средой  , т.е. наше неравенство в левой части станет равным нулю.
, т.е. наше неравенство в левой части станет равным нулю.
 Þ
Þ 
В необратимых процессах для замкнутых систем энтропия возрастает. Мы полагали  ! Если система обменивается теплотой с внешней средой, то ее энтропия может вести себя любым образом.
! Если система обменивается теплотой с внешней средой, то ее энтропия может вести себя любым образом.
 Рассмотрим еще один пример теплопередачу
Рассмотрим еще один пример теплопередачу 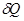 от одного тела к другому. Соприкоснулись два тела.
от одного тела к другому. Соприкоснулись два тела.  .
.
Тело 1 отдало  ,
,  ;
;
тело 2 приняло  ,
, 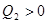 ;
;  . Объединим оба тела в систему и посмотрим, что стало с энтропией, отметим, что энтропия величина аддитивная:
. Объединим оба тела в систему и посмотрим, что стало с энтропией, отметим, что энтропия величина аддитивная:

Убеждаемся, что при теплообмене (необратимый процесс), т.е. при передаче количества теплоты от более горячего тела к более холодному, энтропия увеличивается. Реальные необратимые процессы идут таким образом, что изменение энтропии должно быть положительным.
Т.к.  , следовательно, энтропия отличает обратимые и необратимые процессы, показывает направления реальных процессов.
, следовательно, энтропия отличает обратимые и необратимые процессы, показывает направления реальных процессов.
Для необратимых, неравновесных процессов тождество Клаузиуса превращается в неравенство:  Þ
Þ 
- это неравенство Клаузиуса для необратимых процессов, которое при полном рассмотрении всех потерь теплоты и работы тоже превращается в равенство.
Еще одна формулировка II начала ТД:
Энтропия замкнутой системы в необратимых процессах возрастает. В обратимых процессах остается постоянной. Т.о. для обратимого цикла  ; для необратимого цикла в изолированных системах
; для необратимого цикла в изолированных системах  .
.
Что же важно:
Энергия сохраняется, поэтому она не может указывать направление процессов. Все реальные процессы необратимы, поэтому в замкнутых системах они идут в направлении возрастания энтропии. Т.о. энтропия указывает направление реальных процессов. Рост энтропии означает все большую недоступность превращения тепла в работу. Максимум энтропии соответствует состоянию равновесия.
Энтропия экстенсивная величина, она пропорциональна количеству вещества.  .
.
Энтропия обладает свойством аддитивности: энтропия системы равна сумме энтропий тел, входящих в систему. Этим свойством так же обладают внутренняя энергия, масса, …. Не обладают этим свойством давление, температура. Физический смысл имеет не сама энтропия, а ее изменение.
Обратимые адиабатические процессы, для которых  , характеризуются постоянной энтропией
, характеризуются постоянной энтропией 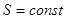 , поэтому их можно назвать изоэнтропийные.
, поэтому их можно назвать изоэнтропийные.
Отметим, что более глубокий смысл энтропии вскрывается в статистической физике. Там энтропия связана с понятием термодинамической вероятности состояния системы.
Получим выражение для энтропии - функции состояния одного моля идеального газа. Используем основное ТД тождество, и термическое уравнение состояния идеального газа:
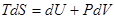 Þ
Þ  , учтем
, учтем 
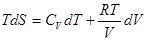 Þ
Þ  проинтегрировав, получим общее решение,
проинтегрировав, получим общее решение,
 , где
, где  - уровень отсчета энтропии.
- уровень отсчета энтропии.
Мы убедились, что энтропия идеального газа является функцией  .
.
Рассчитаем изменение энтропии при выравнивании температуры двух тел, приведенных в тепловой контакт. Вычисления будут основываться на том, что энтропия является функцией состояния.
Если система перешла из одного состояния в другое посредством необратимого процесса, то логично мысленно перевести систему из первого состояния во второе с помощью некоторого обратимого процесса и рассчитать происходящее при этом изменение энтропии. Оно равно изменению энтропии при необратимом процессе.
Обозначим массы удельные теплоемкости при постоянном объеме, и температуры первого и второго тел соответственно  ,
,  ,
,  и
и  ,
,  ,
,  . При тепловом контакте температуры выравниваются. Будем считать для упрощения расчета, что теплообмен происходить при постоянном объеме
. При тепловом контакте температуры выравниваются. Будем считать для упрощения расчета, что теплообмен происходить при постоянном объеме  каждого из тел, теплоемкости
каждого из тел, теплоемкости  и
и  не зависят от температуры,
не зависят от температуры,  . Тело 1 отдало
. Тело 1 отдало  ,
,  ; тело 2 приняло
; тело 2 приняло  ,
, 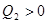 ; Для определения температуры
; Для определения температуры 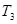 , которую будут иметь тела по достижении термодинамического равновесия, можно написать уравнение
, которую будут иметь тела по достижении термодинамического равновесия, можно написать уравнение  , с учетом I начала ТД:
, с учетом I начала ТД:
 ,
,
отсюда следует, что 
В исходном состоянии тела  и
и  изолированы друг от друга и имеют разные температуры. Затем они приводятся в тепловой контакт. В результате теплообмена тела приходят в состояние 2. Однако переход из состояния 1 в состояние 2 можно совершить также и с помощью обратимых процессов. В этом случае тела
изолированы друг от друга и имеют разные температуры. Затем они приводятся в тепловой контакт. В результате теплообмена тела приходят в состояние 2. Однако переход из состояния 1 в состояние 2 можно совершить также и с помощью обратимых процессов. В этом случае тела  и
и  считаются изолированными, и каждое из них обратимым процессом приводится в состояние 2 при одинаковой температуре
считаются изолированными, и каждое из них обратимым процессом приводится в состояние 2 при одинаковой температуре 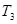 . После этого они приводятся в контакт, но это никакого изменения в их состояния не вносит. Таким образом, в обоих случаях начальное и конечное состояния одинаковы, и изменение энтропии можно просчитать с помощью обратимого процесса по формуле определения энтропии:
. После этого они приводятся в контакт, но это никакого изменения в их состояния не вносит. Таким образом, в обоих случаях начальное и конечное состояния одинаковы, и изменение энтропии можно просчитать с помощью обратимого процесса по формуле определения энтропии:
 , где
, где  .
.
Вычислив интегралы, получим:
 - это и есть изменение энтропии в необратимом процессе теплопередачи при постоянном объеме.
- это и есть изменение энтропии в необратимом процессе теплопередачи при постоянном объеме.
II.) Энтальпия.
Рассмотрим термодинамическую систему, совершающую изобарический процесс.
В этом процессе  , и тогда давление в выражении для работы можно, как константу, внести под знак дифференциала в приращении объема
, и тогда давление в выражении для работы можно, как константу, внести под знак дифференциала в приращении объема  . Учтем это и запишем I начало ТД:
. Учтем это и запишем I начало ТД:
 , Þ
, Þ  .
.
Правая часть выражения является полным дифференциалом функции 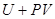 . Это функция получила специальное название - энтальпия
. Это функция получила специальное название - энтальпия  , видим, что
, видим, что 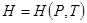 . Еще эту функцию называют «теплосодержание» или «тепловая функция». Изменение энтальпии при переходе из одного состояния в другое зависит только от начального и конечного состояния и не зависит от процесса перехода между ними.
. Еще эту функцию называют «теплосодержание» или «тепловая функция». Изменение энтальпии при переходе из одного состояния в другое зависит только от начального и конечного состояния и не зависит от процесса перехода между ними.

I начало ТД с введением функции «энтальпия» запишется проще:  , т.е. изменение энтальпии в изобарическом процессе равно сообщаемому системе количеству теплоты. Энтальпия системы
, т.е. изменение энтальпии в изобарическом процессе равно сообщаемому системе количеству теплоты. Энтальпия системы  играет ту же роль в процессах при
играет ту же роль в процессах при  , какую внутренняя энергия
, какую внутренняя энергия  играет в процессах при
играет в процессах при  .
.
Выразим теплоемкость системы в изобарическом процессе  .
.
Учтем  , и что
, и что  :
:  , Þ
, Þ 
Для нагревания при  :
: 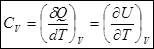 .
.
Для нагревания при  :
:  .
.
Эти соотношения справедливы для любого вещества, а в случаях идеального газа  ;
;  - определяют изменения внутренней энергии и энтальпии в любых процессах, независимо от того, является ли объем и давление постоянными.
- определяют изменения внутренней энергии и энтальпии в любых процессах, независимо от того, является ли объем и давление постоянными.
 , т.о. в общем случае
, т.о. в общем случае
I начало ТД:  .
.
III.) Свободная энергия.
Рассмотрим термодинамическую систему, совершающую адиабатическое расширение. В таком процессе работа совершается за счет убыли внутренней энергии  . Можно сказать, что внутренняя энергия характеризует способность системы совершать работу при адиабатическом расширении.
. Можно сказать, что внутренняя энергия характеризует способность системы совершать работу при адиабатическом расширении.
Иначе обстоят дела в случае изотермического расширения. В таком процессе 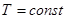 . Внутреннюю энергию использовать для характеристики способности системы совершать работу нельзя, т.к.
. Внутреннюю энергию использовать для характеристики способности системы совершать работу нельзя, т.к. 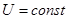 . Это побуждает нас отличать общую энергию, которой обладает система тел или тело, от той ее части, которую при данных условиях можно использовать для получения работы. Нужно найти другую функцию, которая характеризует работу и является функцией состояния.
. Это побуждает нас отличать общую энергию, которой обладает система тел или тело, от той ее части, которую при данных условиях можно использовать для получения работы. Нужно найти другую функцию, которая характеризует работу и является функцией состояния.
Та часть энергии системы, которая при данных условиях может быть использована для преобразования в механическую работу, называется свободная энергия  . В обратимых изотермических процессах свободная энергия характеризует способность системы совершать работу. Работа в таких процессах совершается за счет убыли свободной энергии
. В обратимых изотермических процессах свободная энергия характеризует способность системы совершать работу. Работа в таких процессах совершается за счет убыли свободной энергии  .
.
При изотермическом расширении, когда работа положительна, то свободная энергия убывает, и наоборот при сжатии работа отрицательна, а свободная энергия возрастает, за счет внешних сил, сжимающих тело. Система не может совершить работу, превышающую ее свободную энергию.
В механике энергия тела равна сумме потенциальной и кинетической энергий. Оба этих вида энергий макроскопических тел могут быть полностью преобразованы в механическую работу. Внутренняя энергия молекулярной системы, в интересующем нас случае, не может быть целиком превращена в работу. Посмотрим, чем отличаются  и
и  . При изотермическом расширении идеального газа от объема
. При изотермическом расширении идеального газа от объема  до объема
до объема  работа одного моля
работа одного моля  . Правая часть представляет собой убыль свободной энергии
. Правая часть представляет собой убыль свободной энергии  , и она тем больше, чем больше отношение объемов, т.е. чем сильнее сжат газ. А, напомним, внутренняя энергия идеального газа не зависит от объема.
, и она тем больше, чем больше отношение объемов, т.е. чем сильнее сжат газ. А, напомним, внутренняя энергия идеального газа не зависит от объема.
В изотермическом процессе сжатый газ совершает работу за счет подводимого тепла, но мы говорим о свободной энергии газа, т.к. работу совершает газ.
В общем случае, когда процесс протекает необратимо, совершаемая работа меньше чем в обратимом процессе, т.е. меньше чем изменение свободной энергии.  Þ
Þ  .
.
Возможны так же случаи, когда изменение свободной энергии не сопровождается совершением работы, например, расширение газа в пустоту. Работ не совершается, внутренняя энергия не изменяется, а способность совершать работу падает. Это так, потому что процесс расширения газа в пустоту необратим полностью, хотя и изотермический.
Свободная энергия  , так же как и внутренняя энергия является функцией состояния системы. А это вытекает из того, что при обратимом изотермическом процессе, при переходе из состояния 1 в состояние 2 и обратно в 1, работа
, так же как и внутренняя энергия является функцией состояния системы. А это вытекает из того, что при обратимом изотермическом процессе, при переходе из состояния 1 в состояние 2 и обратно в 1, работа  , следовательно, в таком переходе работа не зависит от пути, а только от начального и конечного состояния системы.
, следовательно, в таком переходе работа не зависит от пути, а только от начального и конечного состояния системы.
Рассмотрим I начало для изотермического процесса  ,
, 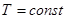 Þ
Þ  Þ
Þ  .
.
Мы нашли выражение для функции свободной энергии 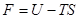 Þ
Þ 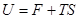 .
.
Внутренняя энергия системы состоит из суммы свободной  и связанной
и связанной  энергий системы. Свободную энергию можно рассматривать как потенциальную энергию системы, находящуюся при постоянных температуре и давлении
энергий системы. Свободную энергию можно рассматривать как потенциальную энергию системы, находящуюся при постоянных температуре и давлении 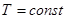 и
и  . Поэтому условием равновесия ТД системы будет условие минимума свободной энергии.
. Поэтому условием равновесия ТД системы будет условие минимума свободной энергии.
Если в системе 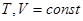 , то в системе могут идти только такие процессы, которые приводят к уменьшению свободной энергии в случае необратимых процессов, или оставляют неизменной свободную энергию в обратимых процессах.
, то в системе могут идти только такие процессы, которые приводят к уменьшению свободной энергии в случае необратимых процессов, или оставляют неизменной свободную энергию в обратимых процессах.
III начало ТД.
В начале XX в (1906 г.) в. в результате исследований свойств тел при низких температурах Нернстом было установлено третье начало термодинамики.
Непосредственной областью применимости третьего начала являются процессы при низких температурах. Однако оно играет существенную роль и в более широком температурном интервале, так как позволяет определять аддитивные постоянные в выражениях для энтропии, которые нельзя вычислить каким-либо другим термодинамическим путем.
В результате этих исследований и было сформулировано III начало ТД: по мере приближения температуры к абсолютному нулю энтропия всякой равновесной системы при изотермических процессах перестает зависеть от каких-либо термодинамических параметров состояния и в пределе  принимает одну и туже для всех систем постоянную величину, которую можно положить равной нулю.
принимает одну и туже для всех систем постоянную величину, которую можно положить равной нулю.
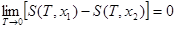 или
или  ,
,
где  - любой термодинамический параметр.
- любой термодинамический параметр.
Постоянство энтропии 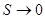 при
при 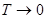 согласно III начала ТД означает что изотермический процесс является одновременно и изоэнтропическим, а следовательно, и адиабатическим. Таким образом, по третьему началу ТД нулевая изотерма совпадает с нулевой адиабатой.
согласно III начала ТД означает что изотермический процесс является одновременно и изоэнтропическим, а следовательно, и адиабатическим. Таким образом, по третьему началу ТД нулевая изотерма совпадает с нулевой адиабатой.
Некоторые следствия III начала ТД:
1) Недостижимость абсолютного нуля температуры.
Из третьего начала ТД непосредственно следует недостижимость абсолютного нуля температуры. Действительно, нулевая изотерма  совпадает с нулевой изоэнтропой
совпадает с нулевой изоэнтропой  , т.е. с граничным членом семейства
, т.е. с граничным членом семейства 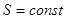 . Но охлаждение осуществляется в результате адиабатического процесса, когда система производит работу за счет убыли своей внутренней энергии. Так как адиабаты
. Но охлаждение осуществляется в результате адиабатического процесса, когда система производит работу за счет убыли своей внутренней энергии. Так как адиабаты 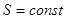 не пересекаются, то состояние с
не пересекаются, то состояние с  не может быть достигнуто никаким адиабатическим процессом, поэтому нельзя достигнуть ни в каком конечном процессе и абсолютный нуль температуры, совпадающей с
не может быть достигнуто никаким адиабатическим процессом, поэтому нельзя достигнуть ни в каком конечном процессе и абсолютный нуль температуры, совпадающей с  ; к нему можно лишь асимптотически приближаться.
; к нему можно лишь асимптотически приближаться.
2) Термические коэффициенты обращаются в ноль при 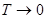 .
.
Термический коэффициент расширения  и термический коэффициент давления
и термический коэффициент давления  , как и вообще термодинамические величины
, как и вообще термодинамические величины  и
и  , характеризующие поведение системы при изменении температуры, могут быть получены дифференцированием соответствующих обобщенных сил
, характеризующие поведение системы при изменении температуры, могут быть получены дифференцированием соответствующих обобщенных сил 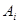 по температуре, где
по температуре, где  - соответствующий данной обобщенной силе независимый параметр.
- соответствующий данной обобщенной силе независимый параметр.
Используя первое начало ТД, нетрудно убедится, что  , а так как энтропия перестает зависеть от параметров состояния, то, следовательно, и термические коэффициенты обращаются в ноль.
, а так как энтропия перестает зависеть от параметров состояния, то, следовательно, и термические коэффициенты обращаются в ноль.
 Þ
Þ  .
.
В частном случае если в качестве обобщенной силы 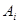 выбираем
выбираем  и соответственно,
и соответственно,  , то
, то  Þ
Þ  при
при  . Принимая в качестве обобщенных сил
. Принимая в качестве обобщенных сил 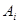 поверхностное натяжение
поверхностное натяжение 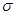 , ЭДС гальванического элемента и т.д. из формулы получаем, что все эти величины при
, ЭДС гальванического элемента и т.д. из формулы получаем, что все эти величины при 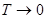 перестают зависеть от температуры и следовательно, температурный коэффициент поверхностного натяжения
перестают зависеть от температуры и следовательно, температурный коэффициент поверхностного натяжения  температурный коэффициент ЭДС и т.д. должны обращаться в нуль при приближении температуры к абсолютному нулю. (температурный коэффициент поляризации
температурный коэффициент ЭДС и т.д. должны обращаться в нуль при приближении температуры к абсолютному нулю. (температурный коэффициент поляризации 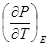 , намагниченности
, намагниченности  и т.д...). Эти выводы из III начала ТД подтверждаются экспериментально.
и т.д...). Эти выводы из III начала ТД подтверждаются экспериментально.
3) Вычисление энтропии и поведение теплоемкостей при 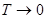 .
.
Третье начало ТД упростило вычисление всех термодинамических функций. До установления третьего начала для вычисления энтропии необходимо было знать температурную зависимость теплоемкости и термическое уравнение состояния.
Согласно третьему началу, энтропию можно находить, зная лишь зависимость теплоемкости от температуры и не располагая термическим уравнением состояния, которое для конденсированных тел неизвестно. Действительно из выражений для теплоемкостей  ,
,  по третьему началу, интегрированием получаем:
по третьему началу, интегрированием получаем:
 ,
, 
Важнейшая задача вычисления энтропии сводится к определению лишь температурной зависимости теплоемкости. По третьему началу энтропия при  конечна, поэтому интегралы в формулах должны быть сходящимися. Это будет выполняться, если подынтегральные функции
конечна, поэтому интегралы в формулах должны быть сходящимися. Это будет выполняться, если подынтегральные функции  на нижнем пределе возрастают медленнее, чем
на нижнем пределе возрастают медленнее, чем  :
:
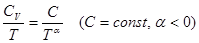 поэтому
поэтому 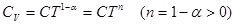 и,
и,
следовательно, 
теплоемкости стремятся к нулю быстрее, чем  .
.
4) Вырождение идеального газа.
Выражение для энтропии моля идеального газа  полученное при использовании уравнения Клапейрона-Менделеева
полученное при использовании уравнения Клапейрона-Менделеева  и положения о независимости теплоемкости
и положения о независимости теплоемкости  идеального газа от температуры, противоречит третьему началу в двух отношениях: во-первых, изменение энтропии при изотермическом процессе, когда
идеального газа от температуры, противоречит третьему началу в двух отношениях: во-первых, изменение энтропии при изотермическом процессе, когда 
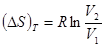 не равно нулю, и во-вторых, при
не равно нулю, и во-вторых, при 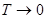 энтропия стремится не к постоянной величине, а к
энтропия стремится не к постоянной величине, а к  . Это указывает на то, что при низких температурах идеальный газ должен вести себя не по уравнению Клапейрона-Менделеева и закону
. Это указывает на то, что при низких температурах идеальный газ должен вести себя не по уравнению Клапейрона-Менделеева и закону  , а иначе. Такое отклонение идеального газа от классических газовых законов (получаемых из классической статистики) называется вырождением.
, а иначе. Такое отклонение идеального газа от классических газовых законов (получаемых из классической статистики) называется вырождением.
Третье начало, следовательно, предсказывает вырождение идеальных газов при низких температурах. Как показало развитие квантовой статистики, такое вырождение действительно имеет место. Оно обусловливается недостаточностью классической механики и основанной на ней классической статистики в области низких температур. Квантовая статистика показывает, что третье начало ТД является макроскопическим проявлением квантовых свойств реальных систем при низких температурах.
5 ) Вычисление энтропийной и химической постоянных идеальный газов.
Второе начало ТД оставляет открытым вопрос о явном виде энтропийной и химической постоянных идеального газа. Знание этих постоянных необходимо при рассмотрении равновесия в различных системах (химические реакции, испарение и др.). Третье начало может быть косвенно использовано для решения этой задачи, хотя классический идеальный газ и не удовлетворяет третьему началу.
Идея вычисления состоит в том, что рассматривается условие равновесия газа и твердого тела одного и того же вещества (равенство химических потенциалов вещества в обеих фазах), в которое входят выражения энтропии, как газа, так и твердого тела. Энтропия твердого тела определяется формулами  ,
,  . Для энтропии идеального газа используется выражение
. Для энтропии идеального газа используется выражение  . Энтропийная постоянная
. Энтропийная постоянная  в уравнении связана с химической постоянной газа. Эти постоянные можно вычислить методами статистической физики.
в уравнении связана с химической постоянной газа. Эти постоянные можно вычислить методами статистической физики.