Состояние идеального газа характеризуется тремя параметрами:
· давлением;
· температурой;
· удельным объемом (плотностью).
1. Давление - скалярная величина, характеризующая отношение силы, действующей по нормали к площадке, к величине этой площадки
 , (1)
, (1)
 ;
;  .
.
2. Температура - скалярная величина, характеризующая интенсивность хаотического поступательного движения молекул, и пропорциональная средней кинетической энергии этого движения.
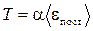 ,
,  при
при  (2)
(2)
Температурные шкалы
Эмпирическая шкала Цельсия (t 0C): 10C = 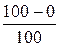 0C;
0C;
Эмпирическая шкала Фаренгейта:  .
.
Пример: t = 36,60C;  .
.
Абсолютная шкала Кельвина: 
Удельный объем (плотность)
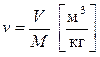 - удельный объем это объем вещества массой в 1 кг;
- удельный объем это объем вещества массой в 1 кг;
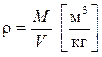 - плотность это масса вещества объемом в 1 м3;
- плотность это масса вещества объемом в 1 м3;  .
.
Молекулярно-кинетическая теория газов
1. Все вещества состоят из атомов или молекул, размеры которых порядка 10-10 м.
2. Атомы и молекулы вещества разделены промежутками, свободными от вещества. Косвенным подтверждением этого факта является изменяемость объема тела.

|
3. Между молекулами тела одновременно действуют силы взаимного протяжения и силы взаимного отталкивания.

|
4. Молекулы всех тел находятся в состоянии беспорядочного непрерывного движения. Хаотическое движение молекул называют также тепловым движением.
Скорость движения молекул связана с температурой тела в целом: чем больше эта скорость, тем выше температура. Таким образом, скорость движения молекул определяет тепловое состояние тела – его внутреннюю энергию.
Основное уравнение молекулярно-кинетической теории газов (уравнение Клаузиуса). Уравнение состояния идеального газа (Менделеева - Клапейрона)
Уравнение Клаузиуса
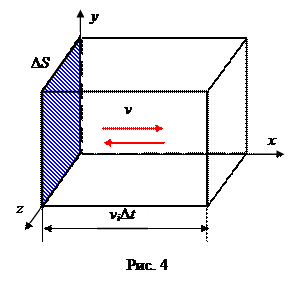 Вычислим давление, оказываемое молекулами на площадку D S.
Вычислим давление, оказываемое молекулами на площадку D S.
2-й закон Ньютона:





 . (1)
. (1)
Для одной молекулы:
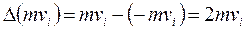 . (2)
. (2)
Число молекул в объеме параллелепипеда с основанием D S и высотой vi D t:
N = niV = ni D Svi D t (3)
n = N/V – концентрация молекул, равная отношению числа молекул к объему занимаемого ими пространства.
Для молекул, которые передают импульс площадке D S (в одном из трех взаимно перпендикулярных направлений движется 1/3 молекул, половина из них, т.е. 1/6 – на площадку D S)
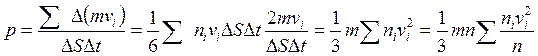
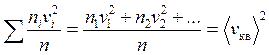 - средняя квадратичная скорость молекул
- средняя квадратичная скорость молекул
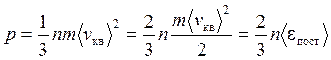

 , (4)
, (4)
 -средняя кинетич. энергия поступательного движения молекул
-средняя кинетич. энергия поступательного движения молекул
Уравнение Клаузиуса: давление идеального газа численно равно 2/3 средней кинетической энергии поступательного движения молекул, находящихся в единичном объеме.
Уравнение Менделеева - Клапейрона
Это уравнение связывает параметры состояния р, Т, М, V.
 ,
, 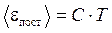



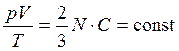
 - уравнение Менделеева – Клапейрона (5)
- уравнение Менделеева – Клапейрона (5)
1-й закон Авогадро: киломоли всех газов при нормальных условиях занимают одинаковый объем, равный 22,4 м 3 /кмоль. ( Если температура газа равна T0 = 273,15 К (0 °С), а давление p0 = 1 атм = 1,013·105 Па, то говорят, что газ находится при нормальных условиях.)


Уравнение Менделеева – Клапейрона для 1 моля газа
 . (6)
. (6)
Уравнение Менделеева – Клапейрона для произвольной массы газа
 - число молей.
- число молей. 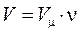 ,
, 



 (7)
(7)