КОНСПЕКТ ЛЕКЦИЙ
По курсу
„ Теория сжигания и топливосжигающие устройства ”
 МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
Донецкий национальный технический университет
Кафедра промышленной теплоэнергетики
Конспект лекций
по курсу
„ Теория сжигания и топливосжигающие устройства ”
для студентов очной и заочной формы обучения
специальностей
7.090510 "Теплоэнергетика"
7.090521 "Тепловые электрические станции"
7.000008 "Энергетический менеджмент"
Утверждено
на заседании кафедры
«Промышленная теплоэнергетика»
протокол № ___ от «___» _____________2014 г.
Утверждено
на заседании учебно-издательского совета ДонНТУ
протокол № ___ от «___» ____________ 2014 г.
Донецк, ДонНТУ, 2014
 |
УДК 621.15536.7.08
Конспект лекций по курсу «Теория сжигания и топливосжигающие устройства» / для студентов специальностей ПТ, ТЭС и ЭНМ дневной и заочной форм обучения / Сост.: Е.К. Сафонова, А.Л. Попов, Д.Л. Безбородов. Донецк: ДонНТУ, 2014. - с.
Приведен конспект лекций по дисциплине „ Теория сжигания и топливосжигающие устройства ”.
Составители: Е.К. Сафонова, доц.
А.Л. Попов, доц.
Д.Л.Безбородов, ст.преп.
Отв. за выпуск Е.К. Сафонова, доц.
ã Сафонова Е.К., Попов А.Л., Безбородов Д.Л.
ã Донецкий национальный технический университет, 2014 г.
РАСЧЕТНЫЙ МЕТОД ОПРЕДЕЛЕНИЯ ТЕПЛОТЫСГОРАНИЯ
Теплота сгорания газообразного топлива
Теплоту сгорания газообразного топлива можно рассчитать, если известны тепловые эффекты реакций горения (табл. 1) и химический состав топлива [в % (объемн.)].
Таблица 1
Теплота сгорания топлива
|
|
| Название топлива | Состав | ρ0 кг/м3 | Теплота сгорания | Низшая теплота сгорания, отнесенная к 1 кг кислорода в реакции горения А Мдж/кг (ккал/кг) | |||
| Qυ, Мдж/м3 (ккал/м3) | Qm, Мдж/кг (ккал/кг) | ||||||
| высшая | низшая | высшая | низшая | ||||
| Углерод | Сам | - | - | - | 34,1 (8140) | 34,1 (8140) | 12,77 (3050) |
| Скр | - | - | - | 32,8 (7850) | 32,8 (7850) | 12,35 (2940) | |
| Окись углерода | СО | 1,25 | 12,77 (3050) | 12,77 (3050) | 10,13 (2420) | 10,13 (2420) | 17,68 (4220) |
| Водород | Н2 | 0,09 | 12,77 (3050) | 108 (2580) | 143 (34180) | 121 (28900) | 15,11 (3610) |
| Метан | СН4 | 0,715 | 39,77 (9500) | 35,8 (8550) | 55,85 (13340) | 50,25 (12000) | 12,56 (3000) |
| Этан | С2Н6 | 1,34 | 70,0 (16700) | 63,6 (15200) | 52,17 (12460) | 47,52 (11350) | 13,28 (3170) |
| Пропан | С3Н8 | 1,97 | 99,2 (23700) | 91,3 (21800) | 50,3 (12030) | 46,4 (11080) | 12,77 (3050) |
| Бутан | С4Н10 | 2,59 | 129 (30700) | 118,5 (28300) | 49,4 (11840) | 45,7 (10930) | 12,81 (3060) |
| Пентан | С5Н12 | 3,21 | 159 (38000) | 146,5 (35000) | 49,4 (11840) | 45,9 (10840) | 12,77 (3050) |
| Циклогексан | С6Н12 | 3,74 | - | 164,9 (39340) | - | 43,9 (10480) | 12,88 (3070) |
| Этилен | С2Н4 | 1,25 | 63,6 (15200) | 59,0 (14100) | 50,8 (12140) | 47,3 (11280) | 13,82 (3300) |
| Ацетилен | С2Н2 | 1,16 | 58,4 (13970) | 55,5 (13480) | 50,3 (12000) | 48,4 (11530) | 15,71 (3750) |
| Бензол | С6Н6 | 2,88 | - | 140,5 (33530) | - | 39,82 (9620) | 13,08 (3120) |
| Сероводород | Н2S | 1,51 | 25,5 (6100) | 23,4 (5600) | 16,25 (4000) | 15,49 (3200) | 10,88 (2600) |
Так, например, низшую объемную теплоту сгорания газообразного топлива в кДж (ккал) подсчитывают по следующим формулам:
Qυн = 127,7 СО + 108 Н2 + 358 СН4 + 590 С2Н4 + 555 С2Н2 + 636 С2Н6 +
+ 913 С3Н8 + 1185 С4Н10 + 1465 С5Н12 + 234 Н2S кДж/м3; (1)
Qυн = 3,05 СО + 25,8 Н2 + 85,5 СН4 + 141 С2Н4 + 135 С2Н2 + 152 С2Н6 +
+ 218 С3Н8 + 283 С4Н10 + 350 С5Н12 + 56 Н2S ккал/м3, (1 а)
где 127,7; 30,5 – тепло, выделяемое при сгорании 1% (объемн.) СО, кДж (ккал);
108; 25,8 – аналогичные величины для Н2 … и т. д.;
СО, Н2, СН4 … и т. д. – содержание горючих составляющих топлива, % (объемн.).
В формуле (1) соответствующие тепловые эффекты выражены в килоджоулях.
|
|
Следует отметить, что расчетная величина теплоты сгорания может немного отличаться от опытной, так как в газе содержатся пыль и смолы.
Пример 1. Определить низшую объемную теплоту сгорания природного газа, состав которого дан, по формуле (1):
Qυн = 358 ∙ 88,69 + 636 ∙ 3,92 + 913 ∙ 0,9 + 1465 ∙ 0,46 = 36200 кдж/м3 (8640 ккал/м3).
Теплота сгорания твердого и жидкого топлив
Нахождение теплоты сгорания твердого и жидкого топлив расчетным способом носит приближенный характер, так как это топливо анализируют не по химическим соединениям, а лишь по химическим элементам.
Д. И. Менделеев предложил следующую формулу;
В пересчете на килоджоули формула принимает вид:
Qрв = 340 Ср + 1260 Нр – 109 (Ор – Sр) кДж/кг, (2)
Qрв = 81 Ср + 300 Нр – 26 (Ор–Sр) ккал /кг, (2 а)
где Ср, Нр, Ор, Sр - содержание элементов рабочего топлива, % по массе.
Высшую теплоту сгорания водорода, входящего в состав органических соединений, Менделеев принял равной 126 МДж/кг (30000 ккал/кг), а не фактическую высшую теплоту сгорания 142 МДж/кг (34180 ккал/кг). Снижение теплоты сгорания топлива из-за наличия в горючей массе кислорода учтено коэффициентом 26, полученном из опытов. Этот коэффициент показывает, что каждый процент по массе кислорода в топливе снижает теплоту сгорания топлива на 109 кдж (26 ккал). Теплота сгорания серы, по Менделееву, принята равной 10,9 МДж/кг (2600 ккал/кг).
На основании формулы (2) формула Менделеева для определения низшей массовой теплоты сгорания топлива принимает вид:
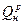 = 340 Ср + 1030 Нр - 109 (Ор – Sр) – 25 Wр кДж/кг, (3)
= 340 Ср + 1030 Нр - 109 (Ор – Sр) – 25 Wр кДж/кг, (3)
или в ккал/кг:
|
|
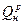 = 81 Ср + 246 Нр - 26 (Ор – Sр) – 6 Wр ккал/кг, (3 а)
= 81 Ср + 246 Нр - 26 (Ор – Sр) – 6 Wр ккал/кг, (3 а)
где W – содержание влаги в топливе, % по массе.
Формула Менделеева пригодна для всех видов твердого и жидкого топлив.
Из других топлив формул для подсчета теплоты сгорания следует отметить формулы Гуталя и Коновалова.
Формула Гуталя дает возможность рассчитать приближенно теплоту сгорания каменного угля по данным технического анализа:
Qв = 82 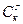 + а Vг ккал/кг, (4)
+ а Vг ккал/кг, (4)
где 82 – теплота сгорания 1% по массе С, принятая Гуталем;
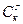 - выход сухого беззольного кокса от горючей массы топлива, % по массе;
- выход сухого беззольного кокса от горючей массы топлива, % по массе;
Vг – выход летучих, отнесенных к горючей массе топлива, % по массе;
а - коэффициент, зависящий от содержания летучих, определяемый экспериментально.
Этот коэффициент по существу представляет собой 1% теплоты сгорания горючей массы летучих топлива, кДж (ккал).
Формула Коновалова имеет вид
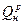 = АМо2, (5)
= АМо2, (5)
где Мо2 - теоретический расход массы кислорода на 1 кг топлива, определяемый в результате расчета или опыта, кг/кг;
А – значение теплоты сгорания, отнесенной к 1 кг кислорода при полном сжигании топлива.
Из табл. 1 видно, что значения А для различных горючих элементов колеблются в узких пределах, так например, значение А для углерода и водорода соответственно равно 12,77 и 15,11 МДж/кг, в то время как теплота сгорания этих элементов отличается примерно в 4 раза (34,1 и 121 Мдж/кг).
На этом основании и построена формула Коновалова. Коэффициент А для каменного угля и нефти принимают равным 12,77 МДж/кг (3050 ккал/кг), для торфа 13,2 МДж/кг (3150 ккал/кг) и для дров 13,6 МДж/кг (3250 ккал/кг).
Принцип подсчета коэффициента А определен на примере горения окиси углерода (СО + 0,5О2 = СО2):
А = 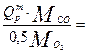
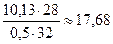 МДж/кг (~4220 ккал/кг).
МДж/кг (~4220 ккал/кг).
УСЛОВНОЕ ТОПЛИВО
Каждое топливо имеет различную теплоту сгорания. Для удобства учета, сравнения и пересчета с одного топлива на другое было предложено принять за единицу учета такое топливо, теплота сгорания которого составляет 29,3 МДж/кг (7000 ккал/кг), и назвать его условным, а любое другое топливо выражать через этот стандарт. Теплоту сгорания 29,3 МДж/кг (7000 ккал/кг) имеет хороший каменный уголь. Если на складе есть разное топливо, например мазут в количестве 100 т с теплотой сгорания 39,8 МДж/кг (9500 ккал/кг), то в пересчете на условное топливо получают величину 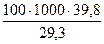 = 136 т. Такие пересчеты можно производить для любого топлива – твердого, жидкого и газообразного.
= 136 т. Такие пересчеты можно производить для любого топлива – твердого, жидкого и газообразного.
Условное топливо очень удобно для сравнения экономичности работы печей, работающих на различном топливе. При сравнении определяют расход условного топлива на единицу нагреваемого в печи материала (кг/т).
Отношение массовой теплоты сгорания данного топлива к теплоте сгорания условного топлива называется калорийным эквивалентом и обозначается Эк.
Например, для торфа с теплотой сгорания 12,77 МДж/кг (3050 ккал/кг) калорийный эквивалент Эк составит 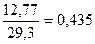 кг условного топлива. Теплоту сгорания газообразного топлива чаще относят к 1 м3.
кг условного топлива. Теплоту сгорания газообразного топлива чаще относят к 1 м3.
Отношение объемной теплоты сгорания данного топлива к теплоте сгорания условного топлива носит название коэффициента теплоплотности топлива (Эт).
П а р о к и с л о р о д н ы й г а з. Обогащение паровоздушного дутья кослородом и в особенности применение чистого парокислородного дутья приводит к повышению теплоты сгорания газа, так как последний не разбавляется содержащимся в воздухе азотом. При применении парокислородного дутья протекают следующие реакции:
С + О2 = СО + Q1; Q1 = 123200 кдж/кмоль (29430 ккал/кмоль);
CO + O2 = CO2 + Q2; Q2 = 285630 кдж/кмоль (68220 ккал/кмоль);
С + Н2О = СО + Н2 – Q3;
Q3 = 118820 кдж/кмоль (28380 ккал/кмоль);
С + СО2 = 2СО – Q4; Q4 = 162300 кдж/кмоль (38790 ккал/кмоль).
Количественное сочетание этих реакций, противоположных по тепловому эффекту, определяется тепловым балансом в слое.
Для увеличения теплоты сгорания газа особенно эффективно сочетать парокислородное дутье с повышенным давлением в генераторе, так как при возрастании давления возможные реакции С + 2Н2↔СН4 и СО+3Н2↔СН4+Н2О, согласно принципу Ле Шателье, идут в сторону образования метана, который переходит в парокислородный газ. При этом теплота сгорания газа доходит до 16750 – 20930 кдж/м3 (4000 – 5000 ккал/м3).
ВОЗДУХ
Для горения топлива необходим кислород, поступающий обычно из атмосферного воздуха, который, таким образом, как и топливо, является равноправным участником в процессе горения.
1. СОСТАВ ВОЗДУХА
В теплотехнических расчетах принимают следующий состав сухого атмосферного воздуха в объемных процентах: 79% N2; 21% О2. С целью упрощения инертные газы (аргон, неон и др.), а также углекислый газ, содержащиеся в небольших количествах (~ 1%), объединяют с азотом. На одну объемную единицу кислорода, поступающего для горения из воздуха, вводят 79:21 = 3,762 объемных единиц азота. Плотность сухого воздуха ρ 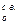 при t = 0оС (Т = 273оК) и р = 101 кн/м2 (1 ата) определяют по общему правилу путем деления молекулярной массы воздуха на объем киломоля (Vо = 22,4 м3):
при t = 0оС (Т = 273оК) и р = 101 кн/м2 (1 ата) определяют по общему правилу путем деления молекулярной массы воздуха на объем киломоля (Vо = 22,4 м3):
Мс.в. = 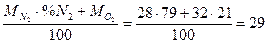 кг/кмоль,
кг/кмоль,
тогда ρ 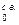 =
= 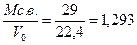 кг/м3.
кг/м3.
Соответственно плотность кислорода и азота будет
ρ 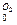 =
= 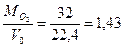 кг/м3;
кг/м3;
ρ 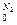 =
= 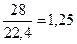 кг/м3.
кг/м3.
В 1 м3 (при нормальных условиях) содержится по массе
N2 = 0,79∙1,25=0,99 кг; О2=0,21∙1,43=0,303 кг.
Тогда состав сухого воздуха по массе будет следующий:
N2 = 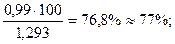 O2 =
O2 = 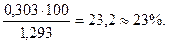
Практически в атмосферном воздухе всегда содержатся водяные пары. Такой воздух называется влажным. Влажный воздух может быть предельно насыщен водяными парами при изобилии влаги в данной местности, например у берегов моря, или не насыщен вследствие недостатка влаги (сухой климат). В последнем случае говорят о степени насыщения воздуха водяными парами φ. Степень насыщения в теоретических пределах может изменяться от φ = 0 до φ = 1. Если φ = 0, то воздух сухой, если φ = 1, то воздух предельно влажный, максимально насыщенный водяными парами. В зависимости от местности и времени года, т. е. температуры, степень насыщенности воздуха влагой чаще всего бывает φ = 0,5 ÷ 0,9 от предельно возможной влажности. Степень насыщения иначе называют показателем относительной влажности, которая после умножения на 100 будет выражена в процентах.
Размерным показателем влажности ρ 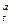 является количество влаги (в граммах), содержащееся в 1 м3 влажного воздуха, при данной температуре t и нормальном атмосферном давлении. ρ
является количество влаги (в граммах), содержащееся в 1 м3 влажного воздуха, при данной температуре t и нормальном атмосферном давлении. ρ 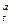 называют показателем абсолютной влажности. Величина ρ
называют показателем абсолютной влажности. Величина ρ 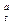 , г/м3, в условиях изобилия влаги может достигать своего максимального значения ρ
, г/м3, в условиях изобилия влаги может достигать своего максимального значения ρ 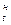 , г/м3, и будет показывать абсолютную влажность полного насыщения при данной температуре t. Отношение фактически имеющейся влаги ρ
, г/м3, и будет показывать абсолютную влажность полного насыщения при данной температуре t. Отношение фактически имеющейся влаги ρ 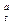 к максимально возможной ρ
к максимально возможной ρ 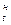 при той же температуре и давлении воздуха будет определять степень насыщения воздуха влагой φ = ρ
при той же температуре и давлении воздуха будет определять степень насыщения воздуха влагой φ = ρ 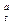 : ρ
: ρ 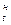 , или иначе относительную влажность, о чем говорилось ранее. ρ
, или иначе относительную влажность, о чем говорилось ранее. ρ 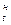 определяется физико – химическими свойствами воды и зависит прежде всего от температуры системы вода – воздух. Чем выше температура воздуха, тем больше он может содержать влаги при предельном насыщении.
определяется физико – химическими свойствами воды и зависит прежде всего от температуры системы вода – воздух. Чем выше температура воздуха, тем больше он может содержать влаги при предельном насыщении.
В зимнее время при температуре воздуха tв<0о в воздухе имеется небольшое количество водяных паров, хотя сама вода находится в твердом состоянии. В этом случае предельная влажность ρ 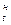 очень мала (1 – 5 г/м3), т. е. зимой воздух практически сухой, но относительная влажность самая высокая (φ = 0,8 ÷ 0,9), так как при понижении температуры воздуха φ = ρ
очень мала (1 – 5 г/м3), т. е. зимой воздух практически сухой, но относительная влажность самая высокая (φ = 0,8 ÷ 0,9), так как при понижении температуры воздуха φ = ρ 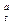 : ρ
: ρ 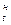 повышается из-за уменьшения ρ
повышается из-за уменьшения ρ 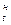 . В летнее время φ = 0,6 ÷ 0,8.
. В летнее время φ = 0,6 ÷ 0,8.
Объемное процентное содержание водяных паров в атмосферном воздухе, когда φ = 1, составляет при комнатной температуре (tв = 20о) примерно 2,5%. При степени насыщения воздуха водяными парами φ = 0,8 объемное процентное содержание водяных паров в воздухе составит примерно 1,5 – 2%. Влажный воздух можно представить в виде смеси сухого воздуха и водяных паров. П л о т н о с т ь в л а ж н о г о в о з д у х а складывается из массы сухого воздуха Мс.в., кг, и массы влаги ρ 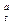 /1000 кг, содержащееся в 1 м3 влажного воздуха при tо С:
/1000 кг, содержащееся в 1 м3 влажного воздуха при tо С:
ρ 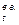 = Мс.в. +
= Мс.в. + 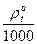 кг/м3. (6)
кг/м3. (6)
После соответствующих преобразований формула для определения плотности влажного воздуха примет вид:
ρ 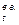 = 1,293
= 1,293 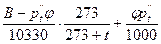 кг/м3, (7)
кг/м3, (7)
где р 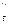 - парциальное давление водяных паров в насыщенном воздухе;
- парциальное давление водяных паров в насыщенном воздухе;
В – барометрическое давление воздуха, н/м2 (мм вод. ст.).
При экспериментальном определении влажности чаще всего находят количество влаги, приходящейся на 1 м3 сухого воздуха j (г/м3). Пересчет состава сухого газа на влажный производят по формулам.
2. РАСХОД КИСЛОРОДА ДЛЯ ГОРЕНИЯ ТОПЛИВА
Количество кислорода (кг), которое необходимо израсходовать для полного сгорания единицы топлива (1 кг), согласно стехиометрическому соотношению, в химической реакции горения называется удельным теоретическим расходом кислорода. Это стехиометрическое число ωо, кг/кг, зависит:
1) от природы горючих элементов топлива:
для углерода:
С + О2 = СО2; ωо = 32: 13 = 2,66 кг/кг;
для окиси углерода:
СО + 0,5О2 = СО2; ωо =16:28 = 0,572 кг/кг;
для водорода:
Н2 + 0,5 О2 = Н2О; ωо = 16: 2 = 8 кг/кг.
Углеводороды имеют значения ωо, близкие к углероду (табл. 2), так как масса водорода в углеводородах невелика;
2) от концентрации горючих элементов в техническом топливе, чем больше балласта в топливе, тем меньше ωо.
Таблица 2
Теоретический расход кислорода и атмосферного воздуха
на единицу топлива
| Название горючих топлив | Состав | Реакция горения | Расход кислорода | Расход воздуха | |||
| ωо | V 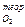
| L 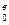
| |||||
| Кг/кг | М3/кг | М3/м3 | М3/кг | М3/м3 | |||
| Углерод | С | С+О2=СО2 | 2,667 | 1,867 | - | 8,89 | - |
| Окись углерода | СО | СО+0,5О2=СО2 | 0,572 | 0,40 | 0,5 | 1,90 | 2,38 |
| Водород | Н2 | Н2+0,5О2=Н2О | 5,60 | 0,5 | 26,74 | 2,38 | |
| Сера | S | S+O2=SO2 | 0.7 | - | 3.33 | - | |
| Метан | СН4 | СН4+2О2=СО2+2Н2О | 2,80 | 13,31 | 9,52 | ||
| Этан | С2Н6 | С2Н6+3,5О2=2СО2+3Н2О | 3,74 | 2,60 | 3,5 | 12,43 | 16,66 |
| Пропан | С3Н8 | С3Н8+5О2=3СО2+4Н2О | 3,64 | 2,54 | 12,10 | 23,80 | |
| Бутан | С4Н10 | С4Н10+6,5О2=4СО2+5Н2О | 3,58 | 2,50 | 6,5 | 11,90 | 30,94 |
| Пентан | С5Н12 | С5Н12+8О2=5СО2+6Н2О | 3,56 | 2,49 | 11,85 | 38,08 | |
| Циклогексан | С6Н12 | С6Н12+9О2=6СО2+6Н2О | 3,43 | 2,40 | 11,42 | 42,71 | |
| Этилен | С2Н4 | С2Н4+3О2=2СО2+2Н2О | 3,04 | 2,13 | 1,5 | 10,26 | 11,90 |
| Бензол | С6Н6 | С6Н6+7,5О2=6СО2+3Н2О | 3,0 | 2,10 | 7,5 | 12,4 | 35,70 |
| Сероводород | Н2S | Н2S+1,5О2=Н2О+О2 | 1,41 | 0,98 | 1,5 | 4,73 | 7,14 |
При наличии многих горючих составляющих в топливе стехиометрическое число
ωо = 0,01∑wxc 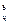 кг/кг, (8)
кг/кг, (8)
где wx – стехиометрическое число соответствующего горючего, кг/кг;
c 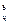 - концентрация горючего элемента в топливе, % по массе;
- концентрация горючего элемента в топливе, % по массе;
ωо - для твердого и жидкого топлива подсчитывается по формуле
ωо = 0,01(ωсСр + ωННр + ωSSр – Ор) кг/кг. (9)
После подстановки значений ωс, ωН и ωS из табл. (2) получаем следующую формулу:
ωо = 0,01(2,667Ср + 8Нр + Sр – Ор) кг/кг. (9 а)
Теоретический объемный расход О2 (V 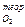 ), необходимый для полного сгорания 1 кг топлива, определится из выражения
), необходимый для полного сгорания 1 кг топлива, определится из выражения
V 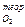 =
= 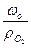 м3/кг, (10)
м3/кг, (10)
где ρ 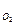 = 1,43 кг/м3 – плотность кислорода.
= 1,43 кг/м3 – плотность кислорода.
Например для углерода
V 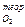 =
= 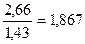 м3/кг.
м3/кг.
Значения V 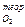 для горючих составляющих сведены в табл. 2. После подстановки в формулу (10) значения ωо из формулы (2), получим
для горючих составляющих сведены в табл. 2. После подстановки в формулу (10) значения ωо из формулы (2), получим
V 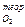 =
= 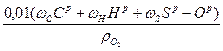 м3/кг, (10 а)
м3/кг, (10 а)
Или после подстановки ωС, ωН из табл. 2
V 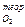 = 0,01[1,867Ср + 5,6 Нр + 0,7 (Sр - Ор)] м3/кг, (10 б)
= 0,01[1,867Ср + 5,6 Нр + 0,7 (Sр - Ор)] м3/кг, (10 б)
где 0,7 Ор - объем кислорода в 1 кг топлива, м3/кг.
В случае расчета V 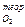 в м3 на 1 кг газообразного топлива соответствующие коэффициенты для горючих составляющих следует брать из табл. 2.
в м3 на 1 кг газообразного топлива соответствующие коэффициенты для горючих составляющих следует брать из табл. 2.
При расчете теоретического расхода кислорода, необходимого для полного сгорания 1 м3 газообразного топлива, нужно V 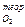 (м3/кг), подсчитанное по формуле (10 а) умножить на плотность ρт, кг/м3:
(м3/кг), подсчитанное по формуле (10 а) умножить на плотность ρт, кг/м3:
V 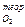 = 0,01
= 0,01 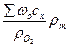 м3/м3. (11)
м3/м3. (11)
Формула (11) путем простых преобразований может быть приведена к виду
V 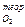 = 0,01∑V
= 0,01∑V 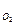 c
c 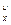 м3/м3, (12)
м3/м3, (12)
где V 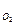 - теоретический объемный расход О2, необходимый для полного сгорания 1 м3 соответствующего горючего;
- теоретический объемный расход О2, необходимый для полного сгорания 1 м3 соответствующего горючего;
c 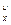 - содержание горючего компонента в топливе, % (объемн.).
- содержание горючего компонента в топливе, % (объемн.).
Стехиометрические объемные соотношения в реакции горения равны отношению молей. Так, для сгорания 1 м3 СО по реакции горения требуется V 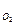 =0.5 м3 О2, а для сгорания СН4 2 м3 (см. табл. 2).
=0.5 м3 О2, а для сгорания СН4 2 м3 (см. табл. 2).
Пользуясь этими данными и зная состав газообразного топлива в объемных процентах, определяем V 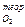 в м3/м3 топлива:
в м3/м3 топлива:
V 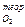 = 0,01 (0,5СО + 0,5Н2 + 2СН4 + … + 1,5 Н2S – О2) м3/м3, (13)
= 0,01 (0,5СО + 0,5Н2 + 2СН4 + … + 1,5 Н2S – О2) м3/м3, (13)
где О2 - содержание кислорода в топливе, % (объемн.).
Если обозначить углеводороды через СmHn, то количество кислорода, рекомендуемое для полного сгорания всех углеводородов, может быть представлено общей формулой
V 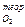 =0,01 (m +
=0,01 (m + 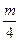 ) CmHn м3/м3.
) CmHn м3/м3.
Например, для горения 1 м3 этана С2Н6, когда m = 2 и n = 6,
V 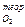 =0,01 (2 +
=0,01 (2 + 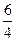 ) ∙ 100 = 3,5 м3/м3.
) ∙ 100 = 3,5 м3/м3.
Тогда в общем виде формула (13) примет вид
V 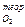 = 0,01[0,5Н2 + 0,5СО + 1,5Н2S + (m +
= 0,01[0,5Н2 + 0,5СО + 1,5Н2S + (m + 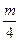 ) CmHn – O2 ] м3/м3. (13 а)
) CmHn – O2 ] м3/м3. (13 а)
3. РАСХОД ВОЗДУХА ДЛЯ ГОРЕНИЯ ТОПЛИВА.
КОЭФФИЦИЕНТ РАСХОДА ВОЗДУХА
Количество воздуха, необходимого для горения топлива, можно определять по объему (м3) или по массе (кг). Расход воздуха, отвечающий стехиометрическому, также называется теоретическим. Объемный расход воздуха обозначают Lо (м3/кг, м3/м3), а расход по массе Gо (кг/кг). Для расчета воздуха на горение существуют три метода: аналитический, приближенный, по графикам.
Аналитический метод расчета. Теоретический расход воздуха определяют по теоретическому расходу кислорода [формулы (11 – 13)] и объемной доле кислорода в воздухе k 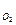 :
:
L 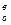 =
= 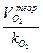 м3/м3, м3/кг. (14)
м3/м3, м3/кг. (14)
Подставив V 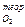 из формулы (10 а), получим теоретический объемный расход сухого воздуха для сжигания 1 кг твердого и жидкого топлива:
из формулы (10 а), получим теоретический объемный расход сухого воздуха для сжигания 1 кг твердого и жидкого топлива:
L 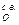 =
= 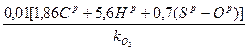 м3/кг. (15)
м3/кг. (15)
Для атмосферного воздуха k 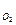 =0,21, и формула (15) принимает вид
=0,21, и формула (15) принимает вид
L 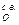 =0,0889Ср+0,26Нр+0,0333(Sр-Ор) м3/кг. (15 а)
=0,0889Ср+0,26Нр+0,0333(Sр-Ор) м3/кг. (15 а)
Объемный теоретический расход сухого воздуха на 1 м3 газообразного топлива определится по формуле (16):
L 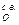 =
= 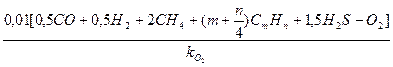 м3/м3. (16)
м3/м3. (16)
Для атмосферного воздуха k 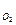 =0,21, и формула (16) принимает вид
=0,21, и формула (16) принимает вид
L 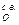 = 0,01(2,38СО+2,38Н2+9,52СН4+…+7,14Н2S-4,76О2) м3/м3. (16 а)
= 0,01(2,38СО+2,38Н2+9,52СН4+…+7,14Н2S-4,76О2) м3/м3. (16 а)
Коэффициенты, показывающие теоретический расход сухого атмосферного воздуха (м3) на 1 м3 соответствующего горючего, приведены в табл. (2).
Если для горения используют влажный воздух, в котором на 1 м3 сухой части содержится f, г, влаги или 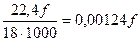 , м3, водяного пара, то расход влажного воздуха составит
, м3, водяного пара, то расход влажного воздуха составит
L 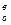 =(1+0,00124 f)L
=(1+0,00124 f)L 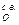 м3/ед. топл. (17)
м3/ед. топл. (17)
Чтобы обеспечить более быстрое и полное сгорание топлива, вводят избыточный воздух в некотором количестве сверх теоретического L 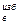 , зависящее от вида топлива и организации процесса его сжигания. Отношение объема избыточного воздуха L
, зависящее от вида топлива и организации процесса его сжигания. Отношение объема избыточного воздуха L 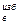 к теоретическому объемному расходу воздуха L
к теоретическому объемному расходу воздуха L 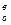 , необходимому для сжигания единицы топлива, носит название к о э ф ф и ц и е н т а и з б ы т к а в о з д у х а, обозначают его буквой α и выражают в долях от единицы или объемных процентах:
, необходимому для сжигания единицы топлива, носит название к о э ф ф и ц и е н т а и з б ы т к а в о з д у х а, обозначают его буквой α и выражают в долях от единицы или объемных процентах:
α= 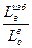 , или α=
, или α= 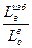 ∙100%. (18)
∙100%. (18)
Так как избыточный воздух переходит в продукты сгорания, увеличивая их объем, и тем самым повышает унос тепла с отходящими газами, то стремятся осуществить сжигание топлива при минимальном избытке воздуха, обеспечивающем полноту сгорания в данном конкретном случае. Чем лучше организация сжигания топлива, тем меньше избытка воздуха требуется. Ориентировочные нормы коэффициента избытка воздуха, которые могут изменяться в зависимости от организации процесса сжигания топлива (от конструкции горелок и форсунок), колеблются на практике в следующих пределах: для газообразных топлив α=0,03÷0,15, для жидких топлив α=0,15÷0,20.
Воздух в количестве, которое практически вводят для полного сгорания единицы топлива, называют д е й с т в и т е л ь н ы м р а с х о д о м воздуха (L 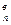 ). Отношение действительного расхода воздуха к теоретически необходимому носит название к о э ф ф и ц и е н т а р а с х о д а воздуха. Этот коэффициент обозначают буквой «n» и выражают так же, как и α. На практике часто α называют коэффициентом избытка воздуха, а подразумевают под ним коэффициент расхода n, вследствие чего могут возникать недоразумения. Если
). Отношение действительного расхода воздуха к теоретически необходимому носит название к о э ф ф и ц и е н т а р а с х о д а воздуха. Этот коэффициент обозначают буквой «n» и выражают так же, как и α. На практике часто α называют коэффициентом избытка воздуха, а подразумевают под ним коэффициент расхода n, вследствие чего могут возникать недоразумения. Если
 L
L 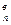 : L
: L 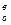 = n и L
= n и L 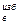 ∙L
∙L 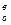 =α,
=α,
то n=1+α, (19)
следовательно, L 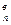 = n L
= n L 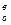 . (20)
. (20)
Приближенный метод расчета. Нужно отметить следующую закономерность: чем больше теплота сгорания топлива (Q 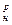 ), тем больше воздуха необходимо для сгорания единицы топлива. На использовании этой прямой пропорциональной зависимости между теплотой сгорания и расходом воздуха построены приближенные (инженерные) формулы для расчета расхода атмосферного воздуха:
), тем больше воздуха необходимо для сгорания единицы топлива. На использовании этой прямой пропорциональной зависимости между теплотой сгорания и расходом воздуха построены приближенные (инженерные) формулы для расчета расхода атмосферного воздуха:
L 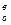 =k
=k  [м3/кг, м3/м3], (21)
[м3/кг, м3/м3], (21)
где k – поправочный коэффициент, зависящий от рода топлива, значение которого приведено в табл. (3) (значение его близко к единице; для углерода его значение максимально k = 1,10, для окиси углерода – минимально k = 0,788, для водорода k = 0,93).
Таблица 3
Значение коэффициента k в формуле (21)
| Вид топлива | Коэффициент k |
| Водород | 0,93 |
| Углерод | 1,10 |
| Антрацит | 1,10 |
| Угли | 1,10 |
| Жидкое топливо | 1,10 |
| Природный газ | 1,11 |
| Метан | 1,11 |
| Торф | 1,10 |
| Дрова | 1,06 |
| Коксовый газ | 1,02 |
| Окись углерода | 0,788 |
| Доменный газ | 0,81 |
| Генераторный газ | 0,87 |

В формуле (21) Q 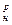 выражено в ккал.
выражено в ккал.
Для быстрого и ориентировочного определения расхода воздуха можно исходить из положения, что на 1000 ккал теплоты сгорания топлива требуется приблизительно 1 м3 воздуха. Лучшее приближение получается по формулам, приведенным в табл. 4.
Таблица 4
Эмпирические формулы для определения L 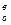 и V
и V 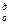 (м3/кг или м3/м3)
(м3/кг или м3/м3)
| Топливо | Теоретически необходимое количество воздуха | Количество продуктов сгорания (при n = 1) |
| Дрова | 4,66(1 - 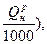 м3/кг м3/кг
| 5,3 – 4,055  м3/кг м3/кг
|
| Уголь | 1,01 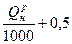 м3/кг м3/кг
| 0,89 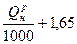 м3/кг м3/кг
|
| Жидкое топливо | 0,85 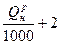 м3/кг м3/кг
| 1,11  м3/кг м3/кг
|
Газообразное топливо (Q 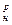 <3000 ккал/м3) <3000 ккал/м3)
| 0,875  м3/м3 м3/м3
| 0,725 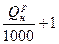 м3/м3 м3/м3
|
Газообразное топливо (Q 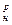 >3000 ккал/м3) >3000 ккал/м3)
| 1,09 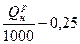 м3/м3 м3/м3
| 1,14 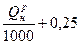 м3/м3 м3/м3
|
| Коксодоменная смесь | 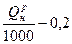 м3/м3 м3/м3
| 0,945 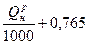 м3/м3 м3/м3
|
1. Объем углекислого газа
V 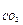 = 0.01∙ 1.867Cр м3/кг, (22)
= 0.01∙ 1.867Cр м3/кг, (22)
где 1,867 – объем углекислого газа, полученный при полном сгорании 1 кг углерода.
2. Объем водяных паров складывается:
а) из объема водяных паров, образовавшихся от сгорания 1 кмоля водорода топлива в количестве 22,4:2=11,2 м3/кмоль;
б) из объема водяных паров, полученных в результате испарения влаги топлива – 1,242 Wр, где 1,242 – удельный объем водяного пара (м3/кг);
в) при сжигании жидкого топлива его предварительно распыляют воздухом или паром; если обозначить через Wф количество пара (в килограммах), расходуемое в форсунках для распыления 100 кг топлива, то количество пара в продуктах сгорания увеличится на 1,242 Wф (м3/кг);
г) из объема водяных паров, перешедших из воздуха: 0,00124fL 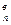 [см. формулу (17).
[см. формулу (17).
Общее количество водяных паров в продуктах сгорания
V 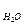 =0,01[11,2Нр+1,242(Wр+Wф)]+0,00124fL
=0,01[11,2Нр+1,242(Wр+Wф)]+0,00124fL 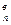 м3/кг. (23)
м3/кг. (23)
При наличии серы в продуктах сгорания будет присутствовать сернистый газ. Из 1 кг S получится 22,4:32 = 0,7 м3 SО2.
Следовательно
V 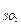 = 0,01∙0,75Sр, (23 а)
= 0,01∙0,75Sр, (23 а)
V 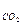 ÷V
÷V 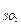 = V
= V 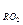 = 0,01(1,867Cр+0,7Sр) =
= 0,01(1,867Cр+0,7Sр) =
= 0,01∙1,867(Ср+0,375Sр) м3/кг (24)
4. Содержание азота в продуктах сгорания складывается из азота топлива 0,8Nр, где 0,8 – удельный объем азота (22,4:28 = 0,8 м3/кг), а азота воздуха V 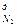 = (1 - k
= (1 - k 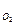 ) L
) L 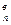 , где k
, где k 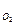 - объемная доля кислорода в воздухе [см. формулу (14)].
- объемная доля кислорода в воздухе [см. формулу (14)].
Следовательно, объем азота в продуктах сгорания
V 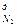 = 0,01∙0,8Nр + (1 - k
= 0,01∙0,8Nр + (1 - k 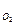 )L
)L 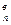 . (25)
. (25)
5. Объем избыточного кислорода воздуха
V 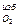 = k
= k 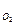 (n – 1) L
(n – 1) L 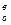 м3/кг. (26)
м3/кг. (26)
Общий объем продуктов сгорания (Vд) при сжигании твердого и жидкого топлива
Vд = 0,01(1,867Ср+0,7Sр)+0,01[11,2Нр+1,242(Wp+Wф)] + 0,00124 f вL 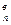 +
+
+ 0,01∙0,8Nр + (1 - k 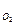 )L
)L 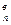 + k
+ k 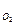 (n – 1) L
(n – 1) L 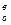 , (27)
, (27)
При сжигании газообразного топлива объем продуктов сгорания определяют по следующим формулам:
1. Объем углекислого газа:
V 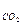 = 0,01[CO
= 0,01[CO 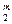 + COт + СН
+ COт + СН 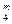 + ∑m(CmHn)т] м3/м3, (28)
+ ∑m(CmHn)т] м3/м3, (28)
где CO 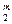 , COт и т. д. – составляющие топлива, % (объемн.).
, COт и т. д. – составляющие топлива, % (объемн.).
Из 1 м3 СО получается 1 м3 СО2, поэтому при окиси углерода стоит коэффициент 1. При горении углеводородов CmHn количество молей СО2 в реакции получается равным количеству атомов углерода. Например, при горении С2Н6 получается 2СО2 и т. д.
Общая формула для подсчета объема углекислого газа, полученного при полном сгорании углеводородов CmHn: