Различают калориметрическую, теоретическую и действительную температуры горения.
При подсчете калориметрической температуры горения принимают, что все тепло, выделяемое при полном сгорании топлива, используется для нагрева продуктов сгорания. Потери тепла в окружающую среду принимают равными нулю. Диссоциация продуктов сгорания при высокой температуре не учитывается.
При подсчете теоретической температуры горения потери тепла в окружающую среду также принимаются равными нулю однако в отличие от расчета калориметрической температуры горения в этом случае учитывается эндотермический процесс диссоциации продуктов сгорания при высокой температуре.
Расчетную температуру горения определяют, учитывая отвод тепла из зоны горения.
Калориметрическая и теоретическая температура горения, подсчитанные при условии, что топливо полностью сгорает в теоретически необходимом для горения объеме воздуха, причем температура воздуха и топлива радона 0° С, естественно зависят только от состава топлива и являются важной теплотехнической характеристикой топлива, в особенности при выборе топлива для осуществления высокотемпературных технологических процессов.
При сжигании топлива с избытком воздуха и при применении предварительного подогрева воздуха и топлива калориметрическая и теоретическая температуры горения зависят не только от состава топлива, но и от условий его сжигания.
Еще в большей степени зависит от условий сжигания, и в частности от конструкции топочной камеры, действительная температура горения.
Количество тепла, сообщаемое продуктам сгорания и обеспечивающее нагрев их до искомой температуры, можно определить из теплового баланса процесса горения.
|
|
Источниками тепловой энергии, выделяющейся в процессе горения, являются: теплотворность топлива и теплосодержание топлива и дутья (воздух, пар). В действительности, однако, не все тепло, выделяющееся при сгорании топлива, идет на нагрев продуктов сгорания.
В реальных условиях горение топлива протекает не мгновенно, поэтому в процессе сгорания одновременно происходит, с одной стороны, выделение тепла, с другой, — отдача тепла в среду, окружающую зону сгорания. Одна часть отданного тепла используется полезно для нагревания рабочих тел, другая составляет тепловые потери.
При высоких температурах происходит диссоциация некоторых составных частей продуктов сгорания, которая сопровождается поглощением определенного количества тепла.
Таким образом, в действительных условиях на нагрев продуктов сгорания идет только часть выделяющегося в процессе сгорания тепла, равная разности между суммой поступлений тепла из всех источников и суммой расходов тепла на теплоотдачу и диссоциацию.
Если обозначить:
Iн — теплосодержание (физическое тепло) топлива и дутья, приходящееся на единицу веса топлива;
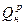 — низшую теплотворность единицы веса топлива;
— низшую теплотворность единицы веса топлива;
I н —теплосодержание (физическое тепло) продуктов сгорания, образующихся на единицу веса топлива;
q—количество тепла, отдаваемое в момент горения среде,
окружающей зону горения и приходящееся на единицу веса топлива;
qдисс—количество тепла, затрачиваемое на реакции диссоциации продуктов сгорания, также отнесенное к единице веса топлива
|
|
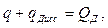
то можно написать
или 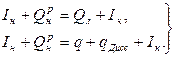 (6)
(6)
Уравнение (6) носит название уравнения теплового баланса процесса горения: левая часть его — приход тепла, правая — расход тепла.
Так как повышение температуры всякого тела определяется количеством тепла, сообщаемого телу его массой и теплоемкостью, связанными уравнениями:
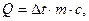
то и для продуктов сгорания топлива повышение температуры § их от какой-либо начальной температуры составит:
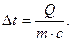
Если за начальную температуру принять 00 С, то приведенное равенство примет вид:
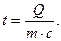 (7)
(7)
Количество тепла, сообщаемое продуктам сгорания, по уравнению (6) составит:
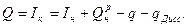 (8)
(8)
Подставляя полученное выражение в формулу (7), получаем
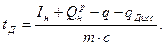 (9)
(9)
Таким образом, формально решение задачи нахождения температуры горения является вполне определенным, если известны все величины, входящие в уравнение (9). Однако для определения действительной температуры горения необходимо найти величину рассеивания тепловой энергии в момент сжигания, т. е. определить величину q. Точно решить эту задачу пока невозможно.
Если предположить, что все тепло, выделяющееся в результате процесса сгорания, целиком сообщается только продуктам: сгорания, т. е. что процесс сгорания происходит в адиабатических условиях, то
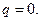
Тогда
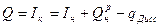 (10)
(10)
и вместо уравнения (9) будем иметь:
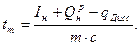 (14)
(14)
Полученная величина носит название теоретической температуры горения. Она всегда выше действительной температуры горения, определяемой формулой (9)
Продукты сгорания топлива, содержащие угольный ангидрид (СО2) и водяной пар (Н2О), нагреваются до высоких температур. При этом происходит диссоциация СО2 и Н2О результате которой изменяется объем продуктов сгорания.
|
|
Кроме того, количество тепла, расходуемое на повышение температуры продуктов сгорания, уменьшается, так как реакции диссоциации СО2 и Н20 идут с поглощением тепла.
Теоретическая температура горения определяется с учетом явления диссоциации в продуктах сгорания.
Температура горения в адиабатических условиях, определяемая без учета явления диссоциации продуктов сгорания, носит название калориметрической температуры горения.
При этом qдисс =0 и формула (11) переходит в элементарную калориметрическую формулу:
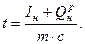 (12)
(12)
Если температура топлива и дутья, поступающих для сжигания, равна нулю, то Iн=0, и
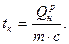 (13)
(13)
Д. И. Менделеев предложил называть эту величину жаропроизводительностью топлива. «Составив новое слово «жаропроизводительность», — писал Д. И. Менделеев, — я хотел удовлетворить условиям языка и сделать название сразу удобопонятным».
Пользуясь приведенным выше выражением можно определять калориметрическую температуру горения расчетным путем, исходя из данных об элементарном составе топлива и его теплотворности.
Количество продуктов сгорания, их объем (или вес) и состав определяются расчетом, как показано выше. Теплоемкость могла бы быть найдена по таблицам, если бы она не зависела от температуры. Влияние же температуры приводит к положению, когда необходимо знать теплоемкость при температуре, величина которой определяется. В общем виде решение можно было бы получить, если бы был известен вид функции, определяющей теплоемкость в зависимости от температуры. Если эта зависимость выражается уравнением
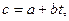 (14)
(14)
то исходное уравнение превращается в уравнение второй степени относительно t:
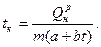 (15)
(15)
или
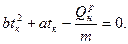 (16)
(16)
Если же принять для теплоемкости значение.
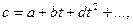 (17)
(17)
то степень общего уравнения на одну единицу больше высшего показателя степени при t в выражении для теплоёмкости. Решение таких уравнений в общем виде громоздко или вовсе недоступно. В таком случае задача решается методом последовательных приближений. Во всяком случае, решение может быть получено с любой заданной точностью.
Если бы можно было создать такие условия горения, которые обеспечивали бы все необходимые для достижения калориметрической температуры требования, то она была бы максимальной температурой, достижимой при сжигании топлива в идеальных условиях. В результате абсолютное значение такой температуры зависело бы исключительно от химического состава топлива, так как им определяются количество выделяющегося при сгорании тепла, количество и состав продуктов сгорания.
Очевидно, что такая температура вместе с тем могла бы служить и весьма существенной характеристикой топлива, представляя как бы верхний предел для температур, достижимых при сжигании топлива во всевозможных условиях.
Этот предел может изменяться лишь при воздействии факторов, непосредственно не связанных со свойствами (химическим составом) топлива. К числу таких факторов нужно отнести предварительный (до сжигания) нагрев горючего и воздуха. Так как благодаря такому подогреву в процессе участвует дополнительное количество тепла, то и калориметрическая температура повышается. Но в этом случае она перестает быть характеристикой топлива, а в большей мере становится зависимой от условий его сжигания.
Чтобы оставить за калориметрической температурой смысл характеристики топлива, ее необходимо всегда определять в строго тождественных для сравниваемых сортов горючего условиях. В качестве таких условий принимаются следующие:
1) температура воздуха и горючего равна 0° С;
2) количество воздуха равно тому, которое определено выше как теоретическое, т. е. минимально необходимое для полного окисления всех горючих составляющих топлива;
3) горение происходит мгновенно до полного окисления:
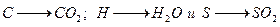
4) горение водорода приводит к образованию Н2О в парообразном состоянии, так что освобождающееся количество тепла равно низшему пределу теплотворности;
5) все выделенное тепло сообщается продуктам сгорания и расходуется исключительно на повышение их температуры.
Всякое отклонение от этих условий изменяет величину определяемой температуры и уменьшает ее значение как сравнительной характеристики топлива.
В самом деле, предварительный подогрев горючего и воздуха, в результате которого продуктам сгорания сообщаются дополнительные количества тепла, сверх выделяющегося при реакции, повышает калориметрическую температуру. Введение в смесь горючего и воздуха в количестве, большем чем теоретическое, вызывает увеличение массы продуктов сгорания, а значит и понижение калориметрической температуры.
Оба эти возможные отклонения связаны с условиями сжигания, поэтому и величина калориметрической температуры, определенной с учетом этих факторов, характерна уже не вообще для данного топлива, а лишь при сжигании его в определенных условиях, отличных от стандартных.
Рассмотрим пример определения калориметрической температуры горения.
Пример. Определить калориметрическую температуру горения бензола С6Н6, содержащего 92,3% С и 7,7% Н,
В 100 кг топлива содержится:
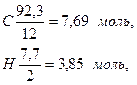
Для горения требуется кислорода:
для горения С........... 7,69 моль
То же Н........... 1,93 моль
Всего........... 9,62 моль
С кислородом войдет азота
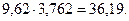
Всего воздуха
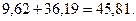
Откуда
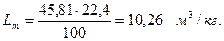
Образуется продуктов сгорания:
СО2 7,69 моль............ 16,1%
Н2О 3,85 моль............ 8,1%
N2 36,19 моль............ 75,8%
S 47,73 моль............ 100,0%
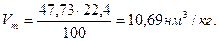
Теплотворность бензола
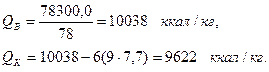
На 1 нм3 продуктов сгорания приходится:
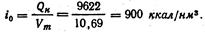
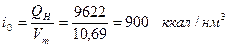
Искомая калориметрическая температура может быть определена из уравнения
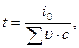
где 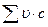 — сумма произведений
— сумма произведений 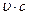 — объемных долей (составляющих продукты сгорания газов на их теплоемкости), соответствующие искомой температуре.
— объемных долей (составляющих продукты сгорания газов на их теплоемкости), соответствующие искомой температуре.
Из этого следует, что
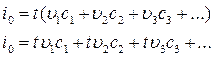
Произведения c1t, с2t, с3t... и т. д. есть не что иное, как значения величин теплосодержания отдельных составляющих при температуре t... ккал/м3. При помощи, таблиц определяют теплосодержание продуктов сгорания при нескольких температурах, из которых выбираются два значения, между которыми лежит истинное значение tK. Искомая температура определяется после этого прямолинейной интерполяцией между, найденными пределами. При некотором навыке эта операция обычно требует выбора лишь двух смежных значений температур.
В разбираемом примере требуется определить температуру продуктов сгорания, если теплосодержание их iо = 900 ккал/м3 и состав следующий:
СО2 ............ 0,161 м3
Н2О............ 0,081 м3
N2 ............ 0,758 м3
S 1,000 м3
Задаемся температурой tк' =2300°. Теплосодержание продуктов сгорания i' при этой температуре определяется так:
СО2 .............0,161×1354=217,8 ккал/м3
Н2О............ 0,081×1099=89,5 ккал/м3
N2 .............. 0,758×829,3=629,0 ккал/м3
i¢=936,3 ккал/м3
Очевидно, истинная температура лежит ниже 2300°. Принимаем 2200°.
Теплосодержание продуктов сгорания при этой температуре i" определяется из расчета:
СО2 .............0,161×1289=207,2 ккал/м3
Н2О............ 0,081×1042=84,5 ккал/м3
N2 .............. 0,758×790,3=600,0 ккал/м3
i¢=891,7 ккал/м3.
Температура 2200° меньше истинной, значение которой находим интерполяцией, принимая теплоемкость в интервале температур 2200—2300° постоянной.
Нагрев продуктов сгорания с 2200° до 2300°, т. е. на 100°, вызывает изменение теплосодержания их на i —i''= 936,3—391,7 = 44,6 ккал/м3. Из количества тепла, выделяемого топливом при сгорании (i0= 900 ккал/м3), для повышения температуры продуктов сгорания от 2200° до на х° остается io—i"= 900-891,7 = 8,3 ккал/м3. Полагая теплосодержание (или изменение его) пропорциональным температуре (теплоемкость постоянна), составляем пропорцию:
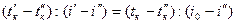
или
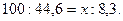
откуда
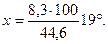
Следовательно, искомая температура
Зависимость калориметрической температуры горения от состава топлива
Д. И. Менделеев установил, что при сгорании различных видов горючего количество тепла, выделяющееся на единицу кислорода воздуха, необходимого для полного окисления горючего, меняется в малой степени.
Так, по подсчетам Д. И. Менделеева, на 1 кг необходимого для горения кислорода выделяется при сгорании углерода — 3034 ккал, водорода, содержащегося в твердом топливе, — 3065 ккал, клетчатки — 3257 ккал, а в среднем — 3150 ккал:
В пересчете на воздух эта величина равна 700 ккал/кг или около 900 ккал/нм3.
Количество тепла, выделяемое на 1 нм3 продуктов сгорания топлива различных видов, образующихся при полном сгорании в стехиометрическом объеме воздуха, также сравнительно мало меняется.
Так, при сгорании 1 кг-атома графита по уравнению
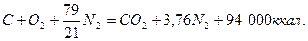
образуется 4,76 моля продуктов сгорания. Следовательно, на 1 нм3 продуктов сгорания выделяется:
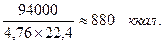
При сгорании моля водорода по уравнению
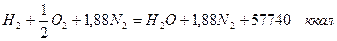
на 1 нм3 продуктов сгорания выделяется:
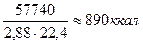
Таким образом, несмотря на большое различие в теплотворности углерода и водорода, количество тепла, выделяющегося на 1 нм3 продуктов их сгорания, колеблется всего лишь в пределах 880-890 ккал/нм3, т. е. является мало меняющейся величиной.
Указанное положение объясняется тем, что отношение объема продуктов сгорания углерода и водорода в стехиометрическом количестве воздуха весьма близко к отношению теплотворностей углерода и водорода, как это видно из следующего подсчета:
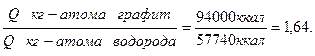
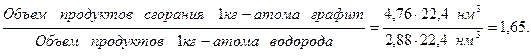
Малое различие в теплосодержании 1 нм3 продуктов сгорания обусловливает также малое различие калориметрических температур горения углерода и водорода в стехиометрическом количестве воздуха tмакс; tмакс углерода, находящегося в виде графита, равна 2175°, а водорода—2235°; среднее значение tмакс -2200°.
Отклонения для tмакс углерода и водорода от указанной величины равны 1,5%.
Несмотря на близкое значение tмакс молекулярного водорода и углерода, tмакс углеводородов не может быть подсчитана только на этой основе из-за необходимости учета теплоты разрыва связей между атомами в молекулах углеводородов.
Если реакция диссоциации углеводорода на углерод в виде графита и молекулярный водород экзотермична, то теплотворность углеводорода выше суммы теплотворностей эквивалентных количеств углерода и водорода, а следовательно, выше и tмакс углеводорода.
Если же процесс диссоциации углеводорода является эндотермичным, то tмакс углеводорода ниже, чем tмакс углерода и водорода, взятых в соотношении, соответствующем химическому составу углеводорода.
Тепловой эффект диссоциации углеводорода, проходящей с образованием графита и молекулярного водорода, определяется характером связей в молекуле углеводорода.
На разрыв двойной связи между атомами углерода в кг-молекуле углеводорода С=С расходуется около 100 тыс. ккал тепла, т. е. значительно меньше, чем на разрыв двух одинарных связей 2×С—С (2×63 = 126 тыс. ккал). Еще больше различие в теплоте разрыва одной тройной связи С =С (128 тыс. ккал) и трех одинарных связей 3×С—С (3×63= 189 тыс. ккал). В соответствии с этим непредельные углеводороды, в молекуле которых имеются двойные и в особенности тройные связи, характеризуются более высокой температурой горения по сравнению с предельными углеводородами.
Указанное различие особенно значительно у первых членов гомологических рядов углеводородов. Так,. tмакс этилена — Н2С = СН2 равна 2284°, у ацетилена НС = НС составляет 2620°, т. е. значительно превышают tмакс насыщенных углеводородов— (СН4 = 2043°, С2Н6 = 2097°). При увеличении молекулярного веса углеводородов и числа групп гомологической разности СН2 в молекуле, различие в калориметрической температуре горения между насыщенными и ненасыщенными углеводородами постепенно сглаживается и tмакс углеводородов всех гомологических рядов приближается к калориметрической температуре горения циклических углеводородов, состоящих только из групп СН2, т. е. к 2140°.
Кривые, приведенные на рис. 1, иллюстрируют указанное положение.
Калориметрические температуры горения в стехиометрическом объеме воздуха углеводородов нормального строения различных, изомеров весьма близки вследствие малого значения теплоты изомеризации по сравнению с теплотой горения так, различия в tмакс нормального октана и шестнадцати изооктанов, не превышают 6° или 0,3%.
Калориметрическая температура горения углеводородов парообразном состоянии примерно на 0,7% (или на 15°) превышает калориметрическую температуру горения углеводорода в жидком состоянии. В свою очередь калориметрическая температура горения углеводородов в жидком состоянии несколько выше калориметрической температуры горения твердых углеводородов.
|
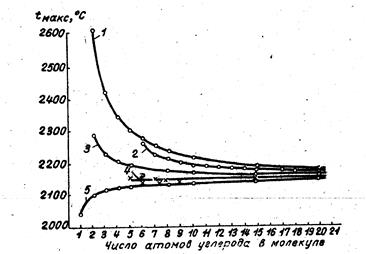
Различие в агрегатном состоянии углеводородов весьма мало сказывается на величине tмакс. В силу этого изменения отношении углерода и водорода в топливе, сильно сказываясь на его теплотворности, мало влияют на калориметрическую температуру горения.
На рис. 2 показана зависимость теплотворности и калориметрической температуры горения горючей массы топлива с малым содержанием кислорода от содержания в топливе водорода.
|
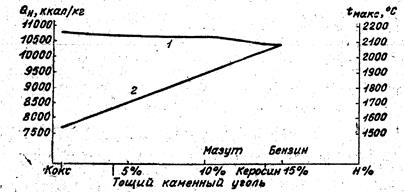
Содержание кислорода в горючей массе топлива сильно сказывается на теплотворности, прежде всего вследствие того, что присутствие, кислорода соответственно понижает содержание горючих компонентов, а также из-за того, что содержание кислорода, химически связанного с горючими компонентами, понижает тепловыделение в процессе их последующего горения.
Так, в соответствии с формулой Д.И. Менделеева
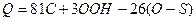
замена в горючей массе каменных углей 1 % углерода кислородом понижает теплотворность горючей массы на 81 ккал в результате уменьшения содержания углерода и, кроме того, дополнительно на 26 ккал вследствие частичного окисления горючего кислородом.
Калориметрическая температура горения (tмакс) топлива снижается при этом в гораздо меньшей степени, так как содержание кислорода в горючей массе требует меньшего расхода воздуха и соответственно снижает объем* продуктов сгорания., Вследствие этого, например, tмакс углеводородов и соответствующих им спиртов отличаются меньше чем на 1%, несмотря на значительно более высокую теплотворность углеводородов.
Присутствие в топливе незначительного количества влаги также понижает его калориметрическую температуру горения в значительно меньшей степени, чем теплотворность, и лишь высокое содержание балласта, переходящего в продукты сгорания, т. е. влаги в твердом топливе или азота и двуокиси углерода в газообразном, заметно понижает tмакс.