Существование s-комплекса (комплекса Уэланда) доказано экспериментально.
Скорость образования конечных веществ определяется переходом p-комплекса в s-комплекс, а не отрывом протона от s-комплекса (первичный кинетический изотопный эффект в реакциях нитрования равен единице) и сильно зависит от характера и расположения заместителей в ядре субстрата, которые увеличивают или уменьшают стабильность s-комплекса. Например, стабильность комплексов и скорость реакции увеличиваются в ряду:
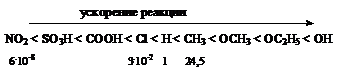
Если принять скорость нитрования бензола за единицу, то относительная скорость нитрования толуола в тех же условиях будет 24,5, трет-бутилбензола – 15,5, бензилхлорида – 0,71, цианистого бензила – 0,35, хлорбензола – 0,03, а нитробензола – 6.10-8.
В зависимости от условий азотная кислота образует следующие электрофильные частицы:
- нитроний-катион NO2Å, в виде сольватированного иона в протонных растворителях (наиболее активный);
- соли нитрония (NO2ÅClO4-), в виде сольватированной ионной пары в диполярных апротонных растворителях (сульфолан - тетраметиленсульфон и т. п.);
- ацетилнитрат (CH3COONO2) и его протонированную форму, при смешении азотной кислоты с уксусным ангидридом (наименее активные).
Концентрированная азотная кислота и её смеси с другими кислотами образуют нитроний-катион NO2Å по схеме:

Молекула HNO3 являясь основанием Льюиса, присоединяет протон с образованием H2NO3Å, а затем отщепляет молекулу воды.
В случае чистой азотной кислоты и «меланжа» схема имеет вид:


Существование нитроний-катиона доказано криоскопическими измерениями, спектральными методами, а также выделением и изучением рентгеноструктурным методом солей нитрония, которые представляют собой белые кристаллические вещества с четкими температурами плавления: NO2ÅClO4- – 135°С, NO2ÅBF4- – 170°С. При добавлении азотной кислоты температура замерзания серной кислоты понижается примерно в четыре раза больше, чем можно ожидать, если бы диссоциация не происходила, т. е. при добавлении одной молекулы азотной кислоты образуется четыре частицы.
Нитрование менее селективно, чем сульфирование, вследствие меньшего размера и большей активности атакующей частицы. Тем не менее, правильный выбор нитрующего агента позволяет существенно повысить выход целевого продукта. Так, при нитровании о -ксилола образуются 3- и 4-нитро- о -ксилолы (3-нитро- о -ксилол используется в производстве мефенамовой кислоты, а 4-нитро- о -ксилол - в производстве рибофлавина (витамина В2)):

Нитрование о -ксилола (NO2)BF4 (борфторидом нитрония) в сульфолане позволяет получить 80% 3-нитро - и только 20% 4-нитроизомера, а HNO3 в 50% H2SO4, наоборот, 70% 4-нитро - и только 30% 3-нитроизомера.
III. Влияние основных технологических параметров на процесс нитрования
1.Концентрация кислоты. Безводная азотная кислота содержит около 1% ионов нитрония, а в 95% - концентрация NO2Å падает почти до нуля. Добавление концентрированной H2SO4 к азотной смещает равновесие HNO3 + H+ = NO2+ + H2O вправо и содержание нитроний-иона в таких смесях значительно выше, чем в чистой азотной кислоте. При концентрации H2SO4 90%, степень диссоциации азотной кислоты – 100%


Серная кислота в нитрующих смесях способствует превращению HNO3 в ÅNO2 и связывает воду, смещая тем самым суммарную реакцию в сторону образования нитросоединения.
В связи с этим на практике используется такое понятие, как фактор нитрующей активности (ФНА), который численно равен минимальной концентрации отработанной серной кислоты, обеспечивающей полное использование азотной кислоты (ср. с p-сульфирования).
2.Модуль ванны – отношения объема кислотного и органического слоев. Реакция нитрования в большинстве своем является гетерогенным процессом и протекает, в основном, в кислотном слое, так как в нем максимальная концентрация нитроний-катиона, и растворимость углеводорода в смеси кислот значительно больше, чем растворимость NO2Å в углеводороде. Поэтому увеличение объема кислотного слоя приводит к увеличению общей скорости гетерогенного процесса нитрования. Обычно величина модуля ванны составляет 1,5¸4.
3.Интенсивность перемешивания определяет величину поверхности раздела фаз в гетерогенной среде. При её увеличении скорость процесса увеличивается до тех пор, пока скорость диффузииреагирующих веществ не станет больше, их скорости химического взаимодействия (кинетическая область). Дальнейшая интенсификация перемешивания не влияет на скорость процесса.
4.Температурный коэффициент константы скорости нитрования около 3, т. е. при увеличении температуры на 10°С скорость реакции возрастает в 3 раза. Однако в гетерогенных процессах значительную роль играет диффузия, поэтому температурный коэффициент значительно ниже (1,5) и зависит от перемешивания. Повышая интенсивность перемешивания реакционной массы можно перевести реакцию в кинетическую область и увеличить температурный коэфициент до 2-3.
5.Тепловой эффект (150 кДж/моль) и скорость процесса нитрования значительны, поэтому решающую роль в организации производства играют вопросы отвода тепла реакции. В связи с этим следует обращать особое внимание на аппаратурное оформление процесса: а)размер и способ оформления теплообменной поверхности, б)обеспечение высокого коэффициента теплопередачи, в)необходимость предварительного охлаждения реагентов; а также на его организацию - правильный выбор порядка слива компонентов.
6.Порядок слива компонентов может быть: 1) прямой; 2) обратный; 3) параллельный. Скорость выделения тепла регулируется скоростью смешения реагентов. Первые два способа используются при периодическом ведении процесса, а третий – при непрерывном.
Прямой слив: нитрующую смесь добавляют к нитруемому соединению. В химфармпромышленности этот способ является основным. Азотная кислота используется полностью. Основным продуктом является мононитросоединение (избыток углеводорода).
К сожалению, идут побочной реакции между субстратом и нитрозилсерной кислотой, и процесс следует вести при низкой температуре. Поэтому, а также из-за низкого содержания нитрующего агента в реакционной массе скорость процесса невысокая. Теплообменная поверхность аппарата используется нерационально, так как объем углеводорода обычно меньше объема нитрующей смеси.
Обратный слив: к нитрующей смеси добавляют нитруемое соединение. Нитрование идет в избытке азотной кислоты, поэтому быстрее и побочные комплексы не образуются, поверхность теплообмена используется более рационально, более благоприятны тепловые условия процесса. Недостатки – образование динитросоединений, возможность протекания окислительных процессов за счет избытка азотной кислоты.
При непрерывном ведении процесса и параллельном сливе компонентов достигаются наилучшие условия нитрования. Однако это требует более сложного аппаратурного оформления процесса, а также обязательной механизации и автоматизации его.
7.Время проведения процесса нитрования во многих случаях лимитировано не кинетикой реакции, а возможной скоростью отвода тепла от реакционной массы. Вследствие этого интенсификация теплообмена может значительно сократить время проведения операции.
8.Катализаторы в процессах нитрования пока практически не используются. Однако известно, что в присутствии ртути и ее солей нитрование бензола и его производных азотной кислотой приводит к получению полинитрофенолов (окислительное нитрование). Таким способом из бензола можно получить динитрофенол и пикриновую кислоту:

При нитровании нитрующей смесью окисления ароматического кольца не наблюдается.
Кислоты Льюиса, например, AlCl3, BF3, облегчают генерацию NO2Å и ускоряют нитрование аренов азотной кислотой и нитратами металлов в серной кислоте (BF3 дорог и ядовит)

IV. Нитрование смесью азотной и серной кислот
- самый распространенный и детально разработанный метод нитрования ароматических соединений. В производстве лекарственных веществ и витаминов применяется чаще всего.
1.Преимущества метода: 1. Возможность применения стехиометрического количества азотной кислоты. 2. Почти постоянная концентрация NO2Å в широком диапазоне соотношений H2SO4/HNO3 (см. рисНизкое окислительное действие азотной кислоты. 4. Низкая коррозия (или отсутствие таковой) стальной и чугунной аппаратуры в серно-азотных нитрующих смесях. 5. Хорошая растворяющая способность серной кислоты, ее высокая температура кипения и теплоемкость.
2.Нитрующая смесь готовится смешением концентрированной серной кислоты (r=1,%-ая кислоты, моногидрата и даже олеума с содержанием SO3 до 20%) с концентрированной азотной кислотой (r=1,4¸1,5) (Азотная кислота (r=1,52) содержит около 99,67% HNO3). При мононитровании избыток азотной кислоты ~ 5%, а при получении полинитросоединений - 10¸20% от теории. Концентрация серной кислоты должна быть тем выше, чем меньше реакционная способность субстрата и чем больше число нитрогрупп вводится в его молекулу. (Например, состав смеси для мононитрования толуола: 35% HNO3, 50% H2SO4, 12% H2O, а для введения второй нитрогруппы необходима безводная смесь, состоящая из 33% HNO3 и 67% H2SO4.)
Состав нитрующей смеси строго определен в каждом конкретном случае. При этом к концу реакции на 1 моль H2SO4 должно приходиться не более двух молей воды, образующейся во время реакции и введенной с нитрующей смесью или нитруемым соединением.
3.Схема приготовление нитрующей смеси включает аппаратуру для отмеривания, смешения и хранения приготовленных смесей.
В качестве смесителя может быть использован любой аппарат, обеспечивающий интенсивное перемешивание жидкости и отвод тепла, выделяющегося в результате смешения кислот, внутренние поверхности которого защищены от кислой коррозии.
Интенсивное перемешивание компонентов осуществляется при помощи погружного насоса, механической мешалки и путем барботирования воздуха через реакционную массу. Однако, воздух, барботируя через смесь кислот, вносит с собой влагу и выдувает из смеси некоторое количество окислов азота, снижая концентрацию азотной кислоты. Кроме того, барботеры весьма быстро разъедаются и выходят из строя.
Температура смеси не должна быть выше 35-40°С. Превышение этой температуры приводит к частичному разложению азотной кислоты с образованием окислов азота. В случае использования отработанной кислоты, содержащей небольшое количество нитропродуктов и нитрозилсерную кислоту, повышение температуры может привести к ухудшению качества реакционной массы и образованию взрывчатых полинитросоединений, а также к повышенной коррозии аппаратуры.
Установку для смешения кислот большой производительности снабжают выносным теплообменником, что позволяет поддерживать температуру смеси на заданном уровне.
4.Скорость добавления нитрующей смеси к нитруемому веществу определяется скоростью отвода тепла реакции и зависит от теплообменной поверхности реактора.
Поэтому для охлаждения нитраторы помимо рубашки обычно имеют дополнительныетеплообменные элементы, выполненные либо в виде внутренних двухстенных цилиндров (диффузоров), либо в виде змеевиков. В некоторых случаях в нитраторе размещают несколько змеевиков, концентрически вставленных друг в друга. Это уменьшает полезную емкость нитратора, но позволяет проводить процесс с большей скоростью.
Подачу охлаждающей воды во внутренний змеевик целесообразно вести, засасывая её с помощью вакуума для того, чтобы в случае течи змеевика вода не попадала в реакционную массу.
5.Эффективное перемешивание реакционной массы, необходимое для увеличения межфазной поверхности, а, следовательно, и скорости реакции, осуществляется быстроходной пропеллерной или турбинной мешалкой. Остановка мешалки при нитровании опасна, так как при отсутствии перемешивания реакция замедляется и в нитромассе накапливается нитрующий агент. При последующем пуске мешалки реакция пойдет очень бурно, с большим выделением тепла, что может привести к взрыву. Поэтому рекомендуется установка специальных устройств, следящих за исправностью мешалки.
6.В случае вязких реакционных масс, например, при нитровании сульфокислот, используют типовые сульфураторы с рубашкой и якорной мешалкой. Применение внутренних змеевиков и охлаждающих элементов нецелесообразно, так как на них может происходить кристаллизация реакционной массы. В этом случае поверхность теплообмена мала, и процесс идет очень долго. В данном случае интенсивность перемешивания не играет решающей роли, так как нитросульфопродукты и исходные сульфокислоты растворимы в нитрующей смеси и реакционная масса является гомогенной.
7.Непрерывное проведение процессов нитрования наиболее целесообразно, поскольку реакция в большинстве случаев протекает с большой скоростью, а реакционные массы, как правило, имеют очень малую вязкость. Это уменьшает количество нитропродуктов, одновременно находящихся в аппарате, и тем самым значительно увеличивает безопасность процесса, ликвидируются непроизводительные затраты времени на загрузку, выгрузку, осмотр аппарата, предварительное охлаждение продуктов и т. п. Это позволяет увеличить производительность аппаратуры в 10-15 раз.
Одна из распространенных конструкций нитраторов непрерывного действия представляет собой цилиндрический сосуд, внутри которого размещена трубчатка, а в центральной широкой трубе – пропеллерная мешалка, работающая как осевой насос. В межтрубном пространстве циркулирует охлаждающий рассол. Субстрат подается сверху в центральную трубу. Во время движения по ней он предварительно охлаждается. Внизу, при выходе из центральной трубы, сырье интенсивно перемешивается с подаваемой снизу нитрующей смесью, и эмульсия поднимается вверх по охлаждаемым трубкам. Длина трубчатки и производительность реактора рассчитываются таким образом, чтобы за время прохода по трубчатке реакционная масса успела прореагировать. Такой реактор работает в режиме, близком к режиму полного вытеснения. При изготовлении и эксплуатации таких реакторов особое внимание следует обратить на плотность соединения труб с трубной решеткой. Нарушение герметичности недопустимо, так как может явиться причиной проникновения хладоагента в реакционную массу. Недостатком конструкции является также наличие патрубка в нижнем днище, что для аппарата, заполненного агрессивными жидкостями, нежелательно.
В связи с проведением реакции нитрования в условиях гетерогенной среды, наибольшее применение для непрерывного ведения процессов нитрования получили реакторы полного перемешивания. Процесс мононитрования в большинстве случаев может быть осуществлен в одну ступень. В отдельных случаях, с целью уменьшения объема аппарата процесс осуществляют в каскаде из двух или нескольких реакторов. Для получения полинитросоединений непрерывным способом применяют каскад реакторов полного перемешивания или секционный реактор. В этом случае в каждой ступени каскада поддерживаются условия, оптимальные для данной стадии ведения процесса.
Примеры нитрования смесью азотной и серной кислот при получении химфармпрепаратов.
- Бензойную кислоту (в производстве билигноста) нитруют меланжем (концентрированная азотная кислота, содержащая 7,5-9% H2SO4 и до 4,5% воды), при 30-40°С, выход целевого продукта 75%.

Нитрование активных субстратов связано с опасностью образования взрывоопасных ди - или тринитропродуктов, а потому должно проводиться при низких температурах с соблюдением необходимых мер предосторожности.
- Фенилмасляную кислоту (при получении хлорбутина) медленно добавляют к охлажденному до 15-14°С меланжу (обратный слив). Концентрация HNO3 в нитрующей смеси должна быть 70-74%:

- о - Ксилол в производстве мефенамовой кислоты нитруют, постепенно добавляя нитрующую смесь, охлажденную до 15°С, к ксилолу при -3±2°С (" прямой слив ").

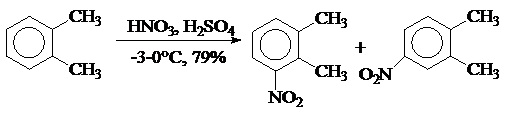
- L-Тирозин (получение меотиронина), вследствие высокой реакционной способности и легкой окисляемости субстрата, нитруют до 3,5-динитротирозина при температуре -5¸0°С:
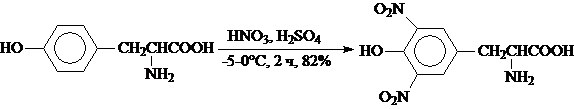
- Пиридин и его производные нитруются крайне плохо вследствие протонирования и дезактивации субстрата. Практического значения этот процесс не имеет.
- Хинолин и изохинолин (особенно) нитруются значительно легче, давая смесь 5- и 8-нитрохинолинов с высоким выходом:

- Азолы нитруются довольно трудно вследствие протонирования по гетероатому. Тиазол не нитруется даже в олеуме при 160°С.
Однако их алкилпроизводные реагируют легко. Например, 4-метилтиазол нитруется довольно легко при 70°С:

2-Ацетиламинотиазол в производстве нитазола нитруется еще легче при температуре от 10-12°С до 45-50°С. Нитрование ведут серно-азотной нитрующей смесью, приготовленной из концентрированной H2SO4 и 59%-ной HNO3 (избыток HNO3 равен 10%)

Интересный метод нитрования нитрата 2-аминотиазола путем внесения его в концентрированную серную кислоту при 8-10°С. Полученный 2-амино-5-нитротиазол без выделения ацетилируют уксусным ангидридом при нагревании с получением нитазола:

Для введения нитрогруппы в трудно нитруемые соединения используют смесь нитратов щелочных металлов (KNO3, NaNO3) и концентрированной серной кислоты. Высокая нитрующая активность такой смеси объясняется отсутствием воды в исходной системе. Так, удалось провести нитрование пиридина с выходом 15¸20% при добавлении небольшими порциями нитрата калия в нагретый до 330°С раствор пиридина в 18%-ом олеуме.
9.Недостатком метода нитрования смесями азотной и серной кислот (или олеума) является необходимость регенерации серной кислоты из отработанных кислот (после разбавления нитромассы водой). Особенно сложной является эта проблема на химфармпредприятиях, производящих, как правило, мононитросоединения.
Для решения этой проблемы серную кислоту заменяют другими кислотными агентами, легче поддающимися регенерации.
С этой целью применяют:
- полифосфорную кислоту, фторид водорода (нитрование бензола при 0°С с выходом 83%);
- нерастворимые катиониты типа сульфированного стирола (например, амберлит IR-120), обезвоженные азеотропной отгонкой воды с толуолом или другими способами. Возможно, что нитрование здесь проходит на поверхности сульфокатионита через образование нитроний-катиона или ионных пар последних с анионными центрами смолы типа R-(SO3-…ÅNO2). Увеличение размера "нитрующей частицы" в последнем случае и регулярное строение катионита вследствие стерических препятствий уменьшает орто -замещение.
Так, если при нитровании толуола серно-азотными нитрующими смесями, в зависимости от температуры, отношение орто -: пара - около 1,5, то при нитровании конц. HNO3 на катионите оно уменьшается до 0,7-0,9.
- Вместо катионитов предложено также использовать каталитические количества серной или фосфорной кислот, нанесенные на носители (например, Al2O3, Al2O3 с SiO2).
10.Типовой процесс выделения нитропродуктов из реакционной массы (не только при нитровании меланжем) складывается из стадий:
1. Отстаивание или сепарация реакционной массы для отделения нитропродукта от отработанной кислоты. Если нитропродукт является в обычных условиях жидкостью, то отстаивание проводят при температуре производственного помещения, а если твердым веществом, то при повышенной температуре, чтобы продукт находился в расплаве. При этом реакционную массу иногда предварительно разбавляют водой. Сепарацию можно проводить в отстойниках как периодического, так и непрерывного действия.
2. Нейтрализация и промывка нитропродукта, содержащего небольшое количество захваченных или растворенных кислот, разбавленным раствором соды или аммиака, и водой.
3. Очистка нейтрализованных и промытых жидких нитропродуктов перегонкой. Легко застывающие продукты кристаллизуют, гранулируют и сушат.
4. Экстракция нитропродукта, оставшегося в отработанной кислоте (после сепарации реакционной массы). Это позволяет увеличить выход целевого продукта и облегчить утилизацию отработанной кислоты.
Экстракцию проводят обычно субстратом. Нитропродукт, вследствие большей растворимости, переходит в органический слой. Если отработанная смесь содержит азотную кислоту, то параллельно происходит частичное нитрование экстрагента за счет остатков азотной кислоты. После разделения в отстойнике отработанную кислоту направляют на концентрирование и денитрацию, а раствор нитропродукта в нитруемом веществе загружают в нитратор.
V. Нитрование концентрированной азотной кислотой
-используется значительно реже, чем нитрование меланжем.
Достоинство метода – не надо регенерировать серную кислоту. Недостатки метода: 1) низкая концентрация нитроний катиона; 2) быстро теряется реакционную способность при разбавлении водой, выделяющейся в процессе нитрования; 3) азотная кислота является сильным окислителем; 4) она более сильно по сравнению с меланжем реагирует с черными металлами; 5) расход азотной кислоты обычно в 1,5 раза выше теоретического.
Однако, учитывая относительно невысокую цену на азотную кислоту, высокую стоимость и малый тоннаж многих лекарственных веществ, этот метод нитрования часто используют в химфармпредприятиях, на которых экономически невыгодно организовывать регенерацию отработанной серной кислоты
Метод применяют, как правило, для нитрования активированных аренов, либо для О-нитрования. Этим методом нитруют п-цимол (1-изопропил-4-метилбензол, из эвкалиптового и тминного масла) при (-15°С); тетралин (1,2,3,4-тетрагидронафталин), ксилол. Первичные ароматические амины нитруют после защиты аминогруппы, либо 100% HNO3, которая превращает амин в N-нитроамин, который после С-нитрования гидролизуется. Ароматические альдегиды при нитровании на холоду образуют молекулярные соединения – нитраты альдегидов, которые в H2SO4 легко превращаются в нитропроизводные альдегидов. Фенилуксусная и коричная кислоты нитруются, главным образом, в п -положение.


- В синтезе левомицетина азотную кислоту используют при получении "нитроэфира" (3°С):

По другой методике получение нитроэфира ведут методом "обратного слива" в избытке азотной кислоты при температуре 8¸12°С. Повышение температуры нитромассы недопустимо, так как она может разлагаться со взрывом.
- При получении нитросорбида используют 98%-ную азотную кислоту:

Устранение недостатков метода связано с уменьшением окислительных свойств кислоты и увеличением концентрации электрофильных частиц. Поэтому, чем выше концентрация азотной кислоты и ниже температура нитрования аренов, тем оно идет быстрее и меньше сопровождается окислением. (Окислительное действие кислоты уменьшается с увеличением концентрации). С этой целью предложены модификации метода.